马铃薯Y病毒生防酒糟菌株的筛选及鉴定
2021-12-07沈硕
沈 硕
(1.青海大学农林科学院,青海 西宁 810016;2.青海省马铃薯育种重点实验室,青海 西宁 810016;3.青藏高原生物技术教育部重点实验室,青海 西宁 810016;4.西北马铃薯教育部工程研究中心,青海 西宁 810016)
马铃薯Y病毒(Potato virus Y,PVY)属马铃薯Y病毒科(Potyviridae)马铃薯Y病毒属(Potyvirus),是引起马铃薯病害的常见病毒之一,可长期存在于感染的块茎中并通过蚜虫非持续性地传播。PVY宿主种类繁多,可侵染34个属170多种植物,被侵染的植物中茄科植物较多,其次是豆科和藜科植物[1-2]。经PVY感染的马铃薯,一般减产50%,当其与马铃薯X病毒(Potato virus X,PVX)或马铃薯A病毒(Potato virus A,PVA)共同侵染时,马铃薯的花叶将会产生严重的皱缩症状,植株变矮小,叶片蜷曲皱缩,能够造成80%的减产[3]。目前有关马铃薯Y病毒病的研究主要是针对烟草马铃薯Y病毒病。烟草马铃薯Y病毒病也称脉坏死病、褐脉病、黄斑坏死病等,是由PVY导致的一种系统侵染的病害,于世界各地广泛分布,在世界烟草产区属于重要病害之一[4-5]。截至目前,有关PVY生物防治的研究主要集中于筛选PVY拮抗菌、分离纯化拮抗菌发酵产物中有效的大小分子化合物和探索这些化合物抑制PVY的相关机制[6-9]。但这些研究均未涉及到酒糟菌。
原料发酵完毕后等待蒸的废料称为糟醅。糠壳、水分、淀粉、曲药在一定的温度和酸度下充分混合作用的过程称为糟醅发酵[10],酒曲、窖泥和现场生产环境是其微生物菌系的主要来源[11]。由于中国传统的白酒固态发酵生产工艺普适性较低,同时生产地域、发酵周期、产品特点等众多因素限制了相关研究技术及手段,并且糟醅微生物区系研究的鉴定工作极为繁琐,因此对其探究相对较少[12]。目前,有关青稞白酒酒糟菌株在生防方面的应用仅仅涉及到除草活性的研究[13-14]。
本研究首次将青稞酒糟中分离得到的菌株用于抑制PVY活性的研究,并对筛选到的菌株进行分子生物学鉴定,以期为青稞白酒酒糟菌株生物防治提供一种新的途径,进而为抗马铃薯Y病毒病生防制剂的开发奠定理论基础。
1 材料与方法
1.1 供试材料
6株酒糟菌(JZ1-4-2、JZ2-4-2、JZ2-4-15、JZ2-1-13、JZ3-1-12、JZ1-1-2)由本实验室从青稞白酒酒糟中分离纯化保存;马铃薯Y病毒毒源以及三生-NN烟(Nicotianatabacumvar.samsunNN)和普通烟(Nicotianatabacum)由贵州大学提供。
1.2 供试培养基
酒糟菌菌株培养基采用牛肉膏蛋白胨培养基:牛肉膏3g,蛋白胨10g,氯化钠5g,琼脂20g,蒸馏水1000ml,pH 7.0-7.2。以不加琼脂的培养基为液体发酵培养基[15]。
1.3 仪器
核酸浓度测定仪、普通PCR仪器、荧光定量PCR仪器(伯乐)、电泳槽、恒温培养箱(型号:BPC-250F,厂家:上海一恒科学仪器有限公司)、4℃离心机、超净工作台(型号:SW-CJ-1C,厂家:苏州净化设备有限公司)、接菌针、培养皿、脱脂棉、封口膜、毛刷、锥形瓶、灭菌锅(型号:HVA-110,厂家:上海天呈科技有限公司)、pH计、蒸馏水制备仪、摇床、研钵、研杵、电子天平。
1.4 酒糟菌发酵液的制备
将斜面保存的酒糟菌划线于牛肉膏蛋白胨培养基平板,在37℃条件下培养24h进行活化。挑取一环活化完成酒糟菌接种于相应的液体培养基中(50ml锥形瓶中盛装20ml液体培养基)在37℃、180rpm/min条件下振荡培养2 d制备发酵液。
1.5 PVY接种[16]
将带毒叶片和磷酸缓冲液(m∶v=1∶2)置于研钵中用研杵进行研磨得病毒汁液,然后将发酵液与病毒汁液(v∶v=1∶1)充分混匀,室温放置30min后接种在PVY系统侵染寄主三生烟上。即在三生烟叶片表面均匀的洒一层600目的金刚砂,用蘸有发酵液与病毒汁液混合液的毛刷顺叶脉方向单次刷叶面,待叶面液体变干、变白时用无菌水反复冲洗叶面,直至将残留金刚砂冲洗完毕即可。以只接无菌的发酵培养基的植株作为阴性对照,以只接PVY汁液的植株作为阳性对照,以只接磷酸缓冲液的植株作为空白对照,每个处理进行2次重复。
1.6 Real-time PCR定量检测PVY含量体系建立[16]
1.6.1 RNA的提取
将接种1周后采集幼嫩的顶部叶片进行总RNA的提取,烟草叶片总RNA的提取按照TaKaRa MiniBEST Plant RNA Extraction Kit (TaKaRa)的说明书进行。
1.6.2 反转录
反转录按照PrimeScriptTMRT Master Mix(Perfect Real Time)(TaKaRa)的说明书进行。以下为反应体系:5×PrimeScript RT Master Mix(Perfect Real Time) 2μl,Total RNA体积为500除以RNA浓度,取RNase Free dH2O补足至10μl,总体积10μl。
反应条件:烟草内参的反转录条件为37℃ 15min,55.2℃ 5sec,4℃无限循环;PVY反转录条件为37℃ 15min,52℃ 5sec,4℃,无限循环。
按照标准荧光定量PCR引物设计原则,通过DNAMAN6.0软件(LynnonBiosoft,Quebec,Canada)对GenBank中已有的PVY和烟草Actin基因全序列进行序列比对,选取每个序列最为保守的区域进行引物设计,引物通过PerPrimer软件进行Real-time PCR特异性引物设计,然后利用Oligo6.0软件和在线分析软件OligoCalc(http://www.basic.northwestern.edu/biotools/oligocalc.html)对所设计的引物进行评价,并且通过在线BLSAT程序(http://www.ncbi.nlm.nih.gov/blast/)进行验证,从而避免病毒特异性引物序列和任何烟草基因组序列同源。引物通过上海生物工程有限公司合成(表1)。

表1 引物序列Table.1 Primers used in this study
1.6.3 Real-Time PCR
Real-Time PCR按照PrimeScriptTMRT Master Mix(Perfect Real Time)(TaKaRa)的说明书进行。当PCR反应阶段每个循环的延伸终止后,收集荧光信号。

表2 Real-Time PCR反应体系及程序Table.2 The reaction system and procedure of Real-Time PCR
1.7 PVY抑制率计算方法[17]
根据Real Time qPCR原始检测结果,按照2-ΔΔct相对定量计算公式,计算出各处理中目的基因PVY的表达量:
(1)F={[待测组目的基因平均CT值-待测组内参基因平均CT值]-[对照组目的基因平均CT值-对照组内参基因平均CT值]}
(2)菌株对PVY抑制率=(对照中PVY的表达量-处理中PVY的表达量)/对照中PVY的表达量×100%=1-处理中PVY的表达量
1.8 活性酒糟菌的分子生物学鉴定及系统发育树的构建
菌株DNA提取按照上海生工生物工程(上海)股份有限公司的柱式细菌DNA提取试剂盒的程序操作。PCR扩增体系:10Buffer 2.5μl,模板DNA 1μl,Taq酶(5U/μl)0.2μl,dNTP(2.5mmol/L)2μl,引物F27(5′-AGAGTTTGATCCTGGCTCAGG-3′)和引物P1541(5′-AAGGAGGTGGTGATCCAGCCGCA-3′)(10pmol/μl)各1μl,补水至25μl。反应条件为:94℃ 5min,94℃ 30s,55℃ 30s,72℃ 80s,共30个循环;72℃ 10min。PCR反应条件:94℃变性45s,50℃退火45s,72℃延伸75s,50μl反应体系30个循环。PCR产物经琼脂糖凝胶电泳检测,回收产物送至上海生工生物工程(上海)股份有限公司测序。
将得到的16S rDNA序列在网站https://www.ezbio cloud.net/上进行序列对比,用MEGA 7.0软件,采用Neighbor-Joining方法(Bootstrap值为1000次)绘制系统发育进化树[15]。
2 结果与分析
2.1 总RNA结果检测
为保证荧光定量PCR检测的准确性,需对提取烟草总RNA的质量和浓度进行检测。本试验所提取样品RNA的1%琼脂糖凝胶电泳结果如图1所示:28S rRNA和18S rRNA两条主带很清晰,28S位于18S的上方,并且前者亮度约为后者的2倍。同时,RNA的浓度经分光光度法进行检测后,OD260/OD280比值都在1.8-2.0范围内,说明所提取RNA的完整性较好,满足反转录实验要求,可进行后续实验。
2.2 Real-time PCR定量检测体系的准确性分析
对所有样品的反转录产物cDNA进行Real-time PCR后得到目的基因PVY的扩增曲线均呈现典型的S型,基线基本平整,指数区斜率较大而且比较平滑,扩增曲线较为理想(图2a);熔解曲线均只呈现单一峰,表明不存在引物二聚体和非特异性扩增(图2b),符合定量检测要求。
2.3 PVY生防酒糟菌的筛选
根据Real-time PCR后得到ddCt值,经计算发现:6株酒糟菌(JZ1-4-2、JZ2-4-2、JZ2-4-15、JZ2-1-13、JZ3-1-12、JZ1-1-2)中菌株JZ1-4-2对PVY的抑制活性较高,抑制率为99.95%;菌株JZ2-1-13和JZ1-1-2对PVY的抑制活性次之,抑制率分别为99.61%和99.07%;JZ2-4-2和JZ3-1-12对PVY的抑制活性中等,抑制率分别为52.70%和57.37%;JZ2-4-15对PVY无抑制活性。
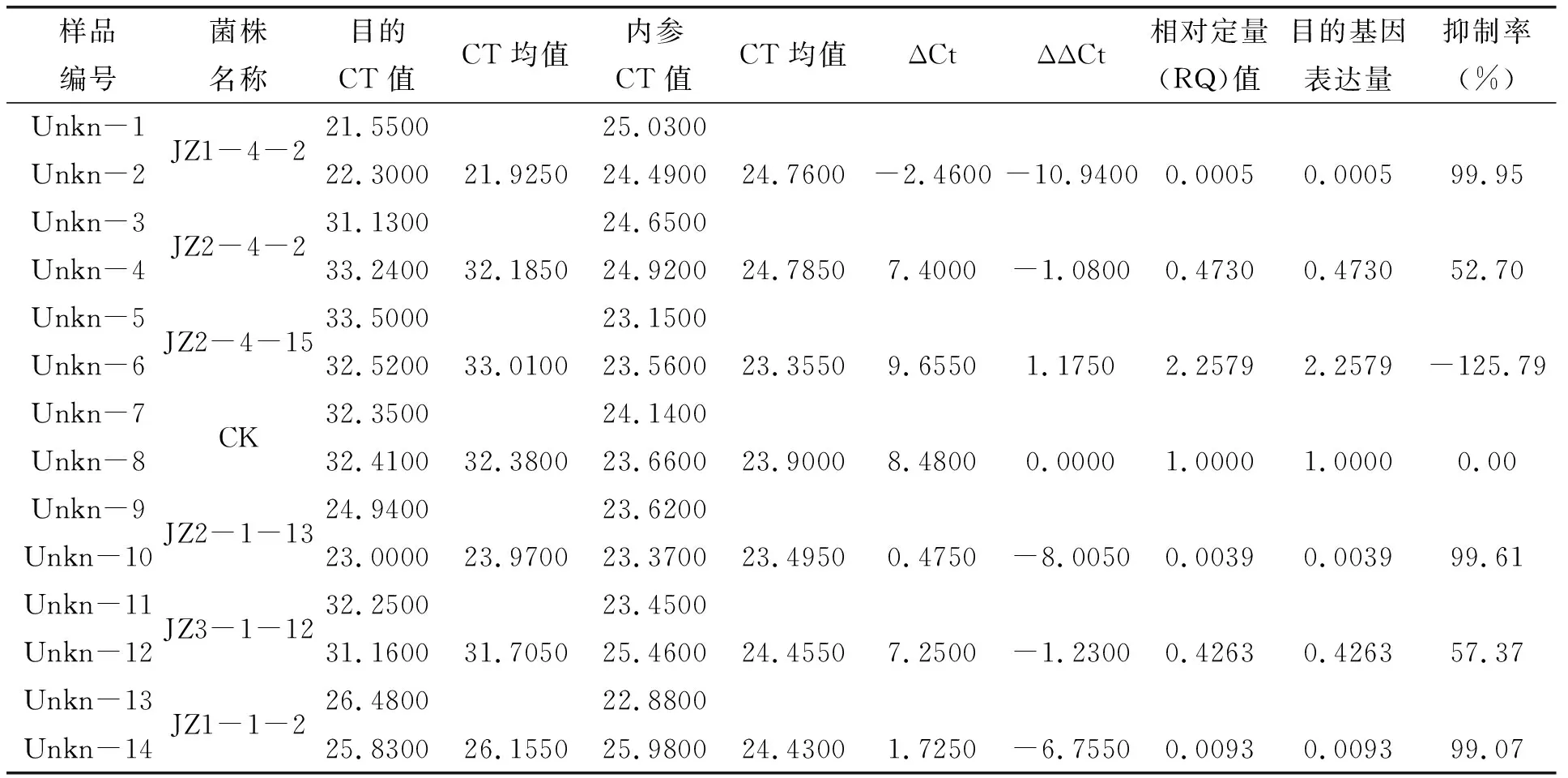
表3 酒糟菌抑制PVY的活性Table.3 The inhibitory activity of strains from distiller’s grain against PVY
2.4 活性菌株的分子生物学鉴定
将3株活性酒糟菌JZ1-4-2、JZ2-1-13和JZ1-1-2的16S rDNA序列的测序结果在https://www.ezbiocloud.net/identify网站上进行比对,选择相似性在99%以上的序列,用MEGA 7.0软件绘制系统发育树(图4、图5、图6)。结果表明,3株活性菌株均为芽孢杆菌属(Bacillussp.)。其中,菌株JZ1-4-2为枯草芽孢杆菌(Bacillussubtilissubsp.subtilis)、菌株JZ2-1-13为解淀粉芽孢杆菌(Bacillusamyloliquefaciens)、菌株JZ1-1-2为巴基斯坦芽孢杆菌(Lysinibacilluspakistanensis)。
3 讨论与结论
本研究采用PVY与酒糟菌株发酵液混合的钝化模式,按照摩擦接种方法对烟草进行PVY接种,通过Real-time PCR定量检测的方法,对6株酒糟菌(JZ1-4-2、JZ2-4-2、JZ2-4-15、JZ2-1-13、JZ3-1-12、JZ1-1-2)发酵液抑制PVY的活性进行测定。结果表明:菌株JZ1-4-2对PVY的抑制活性最高,菌株JZ2-1-13和JZ1-1-2对PVY的抑制活性次之,菌株JZ2-4-2和JZ3-1-12对PVY的抑制活性中等。由于菌株JZ1-4-2、JZ2-1-13和JZ1-1-2对PVY的抑制效果明显,确定为活性菌株。经鉴定,菌株JZ1-4-2为枯草芽孢杆菌(Bacillussubtilissubsp.subtilis)、菌株JZ2-1-13为解淀粉芽孢杆菌(Bacillusamyloliquefaciens)、菌株JZ1-1-2为巴基斯坦芽孢杆菌(Lysinibacilluspakistanensis)。
生物源农药主要是利用其钝化和保护原理来防治病毒病,宁南霉素对烟草花叶病有很好的钝化效果,其主要是通过植物体内的抗病毒活性物质来抑制病毒的侵染和增殖[18]。这与本研究的实验结果一致,不同酒糟菌株发酵液与病毒汁液等比例混合反应30min,使得酒糟菌株发酵液中的活性物质对PVY侵染活性进行了钝化,从而使得目的基因PVY的表达量下降,对PVY表现出抑制作用。
芽孢杆菌种类繁多、分布广泛、抗逆性强,绝大多数种类对人畜无危害,为非致病细菌,因此,是被广泛应用于农业、食品加工和医学等领域的理想的生防微生物[19]。本研究鉴定结果表明对PVY具有抑制作用的3株酒糟菌均属于芽孢杆菌属。截至目前,已有大量关于枯草芽孢杆菌生物防治方面的研究,这些研究主要集中于枯草芽孢杆菌对植物病原真菌的抑制作用、发酵条件的优化以及生防机制探究等方面[20-23]。
本研究表明枯草芽孢杆菌对PVY具有较好的生防效应,但有关发酵液中活性物质的分离、纯化和鉴定以及生防机制的研究还需进一步探究。目前,巴基斯坦芽孢杆菌的研究在国内还未见相关报道,而本研究中巴基斯坦芽孢杆菌对PVY的抑制作用,说明该芽孢杆菌具有成为生防菌的潜力。本项目通过筛选活性菌株,能够发现酒糟菌的抑制PVY的新活性,从而开辟极端微生物新的应用领域,发现其新的研究价值。为微生物源的生物防治提供一种新的途径,进而为马铃薯Y病毒生防制剂的开发提供理论及科学依据。下一步拟对活性菌株的次级代谢产物进行分离,确定活性化合物,为开发成熟的农用生防抗病毒菌剂及其先导化合物提供更完善的理论依据。
