基于网络药理学分析疏肝健脾解毒方抗乳腺癌潜在靶点和作用机制
2021-12-06万杰鑫赵斌胡慧明吴双双官扬南昌市第三医院南昌330009江西中医药大学南昌330004
★万杰鑫 赵斌 胡慧明 吴双双 官扬(.南昌市第三医院 南昌 330009;.江西中医药大学 南昌 330004)
乳腺癌在我国女性中发病率逐渐升高,并逐渐呈现年轻化,其已成为女性肿瘤发病率增长最快的一种肿瘤,严重危害女性健康[1-2]。乳腺癌的发生、发展是多种危险因素共同作用引起的[3],化疗和手术是治疗乳腺癌的主要手段,但化疗导致严重的毒副作用,且手术给患者带来较大创伤。近年来,中医药预防和辅助西医治疗乳腺癌方面体现出良好的优势。
中医认为肝郁证是乳腺癌癌前病变中医的重要病证。李琳霈等[4]认为肝郁脾虚、瘀毒内结是引起乳腺癌癌前病变的重要病机之一。中药疏肝健脾解毒方在疏肝理气、软坚散结、活血化瘀、消肿止痛等方面有较好的疗效,具有预防和治疗乳腺癌作用[5]。有研究证实疏肝健脾解毒方可能通过诱导细胞凋亡,达到抑制人乳腺癌细胞MCF-7的增殖,且可有效降低乳腺癌癌前病变肝郁证大鼠模型血清中性激素水平[6-7]。白术、茯苓、郁金、柴胡健脾疏肝、行气解郁;蒲公英、白花蛇舌草、半枝莲清热解毒、消肿散结,该方扶正抗癌,标本同治。
白花蛇舌草性寒、味微苦;半枝莲性寒、味辛微苦。二者皆属清热解毒类中药, 具有清热利湿、凉血解毒、软坚散结等功效。研究表明二者在制肿瘤细胞增殖、诱导肿瘤细胞凋亡、增强机体免疫、降低端粒酶活性等方面起到协同作用[8]。郁金为姜科姜黄属植物温郁金(Chrcuma wenyujinY.H.chenet C.ling)、姜黄(Curcuma lougaL)、广西莪术(Curcumak wangsiensisS.G.Lee et C.F.Liang)、或蓬莪术(CurcumaphaeoeaulisVal.)的干燥块根, 药用历史悠久。其药性寒, 味辛, 苦, 归心、肝、胆经, 具有活血行气镇痛、消心解郁、利胆退黄、凉血止血之功效。临床诊疗表明郁金的提取物能够有效抑制多种肿瘤细胞的生长、减少肿瘤细胞数目、缩小肿瘤细胞体积[9]。中药柴胡是狭叶柴胡(BupleurumscorzonerifoliumWilld.)或伞形科植物柴胡(Bupleurum chineseDC)的干燥根,味辛、苦,性微寒,有抗炎、抗菌、抗肿瘤等功效[10],多项研究表明柴胡可逆转肿瘤多药耐药,其联合化疗药物治疗乳腺癌可降低化疗药物的副反应,对乳腺癌患者的预后起到一定的改善效果[11-13]。茯苓[Poria cocos(Schw.) Wolf]为我国传统的药用真菌, 是多孔菌科卧孔菌属真菌茯苓的干燥菌核, 其主要成分为茯苓糖,胡康等[14]报道了茯苓提取物通过抑制SATB1来降低MDA-MB-231乳腺癌细胞的体外迁移能力,进而控制乳腺癌的发展。白术(Atractylodes macrocephalaKoidz.) 为健脾益气类中药,具有调节胃肠功能、抗衰老、抗炎、抗肿瘤、提高免疫力、保肝以及改善和治疗糖尿病的作用。LEE等[15]研究发现白术能够提高肿瘤患者的免疫力,进而抑制肿瘤细胞的生长繁殖从而达到抗肿瘤的作用。蒲公英为菊科植物蒲公英(Taraxacum mongolicumHand.-Maz.)、碱地蒲公英(Taraxacum borealisinenseKitam.) 或同属数种植物的干燥全草;其味苦、甘, 性寒, 归肝、胃经, 具有清热解毒、消肿散结、利尿通淋的功效, 可用于乳痈、肺痈、肠痈、热淋涩痛、湿热黄疸、清肝明目[16]。研究表明蒲公英萜醇可通过线粒体途径诱导乳腺癌细胞凋亡,进而对乳腺癌细胞起抑制作用[17]。
中药的治疗作用涉及多成分、多靶点的综合调节作用,疏肝健脾解毒方预防和治疗乳腺癌的作用机制研究多集中在临床研究或细胞学层面,但缺乏多层次多层面抗乳腺癌的作用机制研究。网络药理学从多成分、多靶点和多通路等多个方面研究中药复方作用机制,为中药研究提供了新思路[18]。本研究采用网络药理学方法分析疏肝健脾解毒方抗乳腺癌的作用机制,为深入开展疏肝健脾解毒方预防和治疗乳腺癌的基础实验研究及临床治疗提供依据。见图1。

图1 技术路线图
1 材料与方法
1.1 疏肝健脾解毒方化学成分的收集疏肝健脾解毒方有郁金、柴胡、茯苓、白术、白花蛇舌草、半枝莲、蒲公英。依托中药系统药理学数据库和分析平台(http://lsp.nwu.edu.cn /tcmsp.php)、中草药综合数据库TDT(http://tcm.cmu.edu.tw)检索疏肝健脾解毒方的主药成分。以口服生物利用度(OB), 类药性(DL)为限制条件进行活性成分筛选[19-20],以 OB≥30 %且 DL≥0.18 为筛选阈值得到疏肝健脾解毒方的活性成分。
1.2 乳腺癌差异基因的收集设定“breast cancer normal”为关键词,物种来源限定“Homo sapiens”,通过美国国立生物技术信息中心(National Center of Biotechnology Information,NCBI)基因表达数据库 (http://www.ncbi.nlm.nih.gov/geo/)获得乳腺癌差异基因。
1.3 疏肝健脾解毒方活性成分-作用靶点网络的构建利用TCMSP数据库(http://tcmspw.com/tcmsp.php)预测疏肝健脾解毒方活性成分的作用靶点,通过Perl语言(https://www.perl.org/)对所获得的预测靶点蛋白名进行转换成相对应的基因名,并剔除重复靶点。并通过 Cytoscape 3.7.2 软件(http://www.Cytoscape.org/)构建疏肝健脾解毒方活性成分-作用靶点网络。
1.4 疏肝健脾解毒方-活性成分-关键靶点-疾病网络构建依据“1.2”“1.3”所得结果,应用Cytoscape 3.7.2中的关联(Merge)功能,将2个结果合并成疏肝健脾解毒方-活性成分-关键靶点-疾病网络图,成分作用靶点图和疾病靶点图交集部分即是活性成分抗乳腺癌的关键靶点,通过Network Analyzer工具计算网络拓扑参数,以探索疏肝健脾解毒方抗乳腺癌的作用机制。以180≤NW≤500,OB≥30 %,DL≥0.18为 筛选条件,筛选疏肝健脾解毒方中的791种成分,并与有靶点蛋白的活性成分进行交叉对比,筛选出重合物质进行分子对接,进一步验证活性成分与关键靶点的结合效果。
1.5 乳腺癌靶点PPI网络构建及分析将乳腺癌靶点导入Cytoscape中的插件“BisoGenet”,分析其靶点蛋白质与蛋白质的相互作用(proteinprotein interaction,PPI)。利用节点的度中心性(degree centrality,DC)和介数中心性(betweenness centrality,BC)能够识别关键蛋白[21],对PPI网络进行度中心性(DC)、介数中心性(BC)拓扑结构分析。
1.6 GO与KEGG通路 富 集分 析利 用R语 言对药物靶点基因进行Gene Ontology(GO)和Kyoto Encyclopedia of Genes and Genomes(KEGG)Pathway富集分析。以P<0.05为筛选标准确定药物靶点基因参与的生物学过程和通路,寻找可能的作用通路。选择 GO 功能中的生物过程、分子功能和细胞成分共参数对基因进行富集分析。采用 omicshare平台(http://www.omicshare.com/)对 KEGG 通路富集分析结果以高级柱状图进行可视化。
2 结果
2.1 疏肝健脾解毒方活性成分的筛选通过在 TCMSP 及TDT平台检索,并将2个数据库筛选结果合并,共获得疏肝健脾解毒方共有791种成分,其中郁金222种,柴胡349种,茯苓34种,白术55种,白花蛇舌草37种,半枝莲94种,蒲公英0个。将化学成分的口服利用度(OB)和类药性(DL)的阈值分别设置为OB≥30 %,DL≥0.18获取方中主药的成分,获得82种主要活性成分。见表1-2。其中郁金10个、柴胡14个、茯苓15个、白术7个、白花蛇舌草7个、半枝莲26个、蒲公英0个,预测靶点共239个。活性成分中β-谷甾醇为郁金、白花蛇舌草、半枝莲共有的成分;谷甾醇为半枝莲、郁金共有的成分;黄芩苷为柴胡、半枝莲共有成分;豆甾醇是柴胡、白花蛇舌草、半枝莲共有的成分;槲皮苷是柴胡、白花蛇舌草、半枝莲共有的成分。从表1-2可见郁金中化合物莪术内酯,(Zedoarolide B)在82个候选化合物中具有最高的OB值(135.56 %),半枝莲中Stigmasta-5,22-dien-3-ol-acetate在82个候选化合物中具有最高的DL值(0.86),根据DL和OB值筛选前10化合物的结构。见图2-3。

表1 疏肝健脾解毒方中DL值前10的化合物基本信息

表2 疏肝健脾解毒方中OB值前10的化合物基本信息
2.2 乳腺癌差异基因获取及筛选通过在基因表达数据库(GEO)中检索基因芯片信息平台GPL14550,利用R语言(https://www.r-project.org/)筛选差异基因,筛选标准为P<0.05和|logFC|>1,并结合相关文献共得到689个乳腺癌差异表达基因,其中上调基因316个,下调基因373个。见图4。取前40个差异最明显的基因构建分层聚类图。见图5。图5中每列代表样本,其中类型为“C”(conNum)为对照组,类型为“T”(treatNum)为实验组。每行代表差异基因,颜色由绿到红代表基因的表达情况,即由低表达到高表达。

图2 疏肝健脾解毒方中DL值前10的化合物

图3 疏肝健脾解毒方中OB值前10的化合物
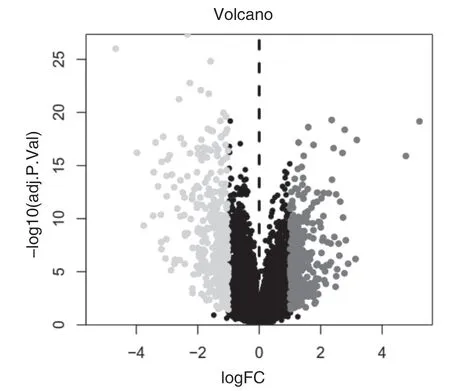
图4 差异基因的火山图
2.3 “活性成分-靶点”网络的构建依据TCMSP平台,检索疏肝健脾解毒方的51个主要活性成分的靶点,共239个。借助Cytoscape 3.7.2软件构建“活性成分-靶点”网络。见图6。度值大小与疏肝健脾解毒方活性成分作用于该靶点的可能性大小呈正比。图6中共有288个节点,1 150条边,中间粉色椭圆代表活性成分,活性靶点为蓝色平行四边形状,分布于四周。
2.4 “药物-活性成分-关键靶点-疾病”网络通过Cytoscape 3.7.2软件中的Merge功能将成分-靶点网络和疾病靶点相互作用网络合并,得到与乳腺癌相关的疏肝健脾解毒方活性成分的潜在靶点,见表3,构建疏肝健脾解毒方-活性成分-关键靶点-疾病网络图。见图7。该网络总共包含38个节点,45条边。橙色节点代表乳腺癌药物靶点基因,有21个;绿色节点代表白花蛇舌草,有1个;黄色节点代表白术,有1个;蓝色节点代表半枝莲,有9个;紫色节点代表柴胡,有2个;粉色节点代表郁金,有1个;红色节点为3种中药组成(其中MOL000098、MOL000449为白花蛇舌草、半枝莲、柴胡共有的成分;MOL000358为白花蛇舌草、半枝莲、郁金的共有成分),有3个。主要的网络拓扑参数如下:网络直径(Network diameter)为6,平均相邻数目(Avg.number of neighbors)为2.368。图7结果进一步表明,白花蛇舌草的2-甲氧基-3-甲基-9,10-蒽醌作用于β-2肾上腺素能受体;白术的3β-乙酰氧基苍术碱作用于β-2肾上腺素能受体;半枝莲的5-羟基-7,8-二甲氧基-2-(4-甲氧基苯基)色酮、7-羟基-5,8-二甲氧基-2-苯基-色酮、白杨素-5-甲醚、汉黄芩素、三裂鼠尾草素、荠苎黄酮作用于β-2肾上腺素能受体,黄芩素、木犀草素作用于基质金属蛋白酶-9,(2R)-5,7-二羟基-2-(4-羟基苯基)铬-4-酮作用于糖皮质激素受体,汉黄芩素作用于转录因子AP-1、间质胶原酶,黄芩素作用于原癌基因c-Fos,木犀草素作用于转录因子AP-1、间质胶原酶、杆状病毒IAP重复蛋白-5、肝细胞生长因子受体;柴胡的山奈酚作用于转录因子AP-1、间质胶原酶、信号转导与转录激活因子1-α/β、醛缩酮还原酶、抗白细胞蛋白酶,荜澄茄素作用于β-2肾上腺素能受体;郁金的柚皮素作用于过氧化氢酶。

图5 差异表达的基因热图
以180≤NW≤500,OB≥30 %,DL≥0.18为筛选条件,筛选疏肝健脾解毒方中的791种成分,并与表3中所含蛋白进行交叉对比,筛选出重合物质共15种。将该15种物质分别与相应基因(度值>1)进行分子对接,见表4。总分大于4的认为该物质可能起作用,故得出结论:beta-sitosterol(β-谷甾醇),Stigmasterol(豆甾醇),Cubebin(荜澄茄素),3β-acetoxyatractylone(3β-乙酰氧基苍术碱)可能作用于ADRB2基因;beta-sitosterol(β-谷甾醇)可能作用于JUN基因;luteolin(木犀草素),quercetin(槲皮素)可能作用于MMP9基因;betasitosterol(β-谷甾醇)可能作用于PRKCA基因;quercetin(槲皮素),kaempferol(山奈酚)可能作用于STAT1基因;quercetin(槲皮素)可能作用于BIRC5基因。

图6 疏肝健脾解毒组方-靶点网络

表3 与乳腺癌相关的疏肝健脾解毒方活性成分的潜在靶点

表4 分子对接结果
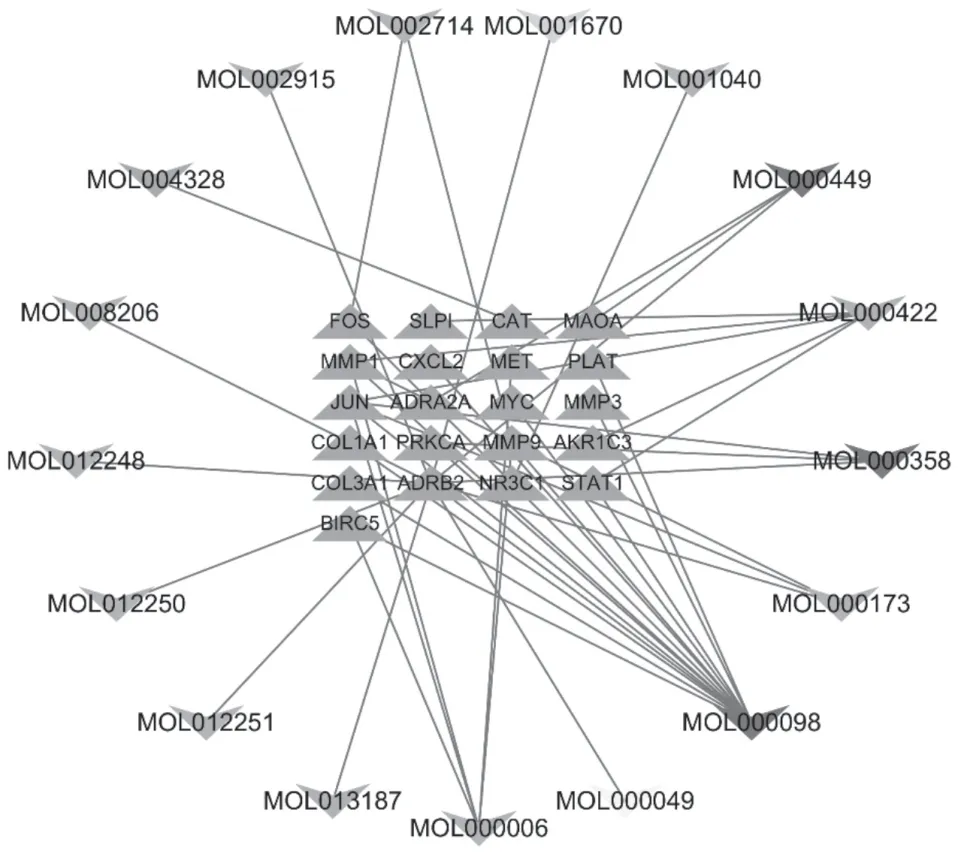
图7 疏肝健脾解毒方-乳腺癌靶点网络
2.5 PPI网 络构建利 用Cytoscape 3.7.2的 插 件BisoGenet,得到乳腺癌相关靶点蛋白质1914个, 33614条边,见图8A;对其进行度中心性(DC)拓扑结构分析,限定Degree最小值为61,得到乳腺癌相关靶点蛋白质296个,8310条边,见图8B;再进行介数中心性(BC) 拓扑结构分析,限定Degree最小值为600,得到乳腺癌相关靶点蛋白质22个,149条边。见图8C。
PPI网络结构图进一步显示,疏肝健脾解毒方有可能作用于异核核糖核蛋白U、E3泛素蛋白连接酶、Myc-原癌基因蛋白、组蛋白乙酰转移酶、过渡内质网ATP酶、COP9信号体复合物亚基5、DNA复制许可因子、内质网伴侣BiP、多泛素-C、核苷胺、细胞肿瘤抗原p53、组蛋白脱乙酰酶1、乳腺癌I型易感蛋白、雌激素受体、热休克蛋白90α、细胞周期蛋白依赖激酶2、生长因子受体结合蛋白2、14-3-3蛋白ζ/δ、连环蛋白β-1、热休克蛋白90β、高亲和力神经生长因子受体、表皮生长因子受体。
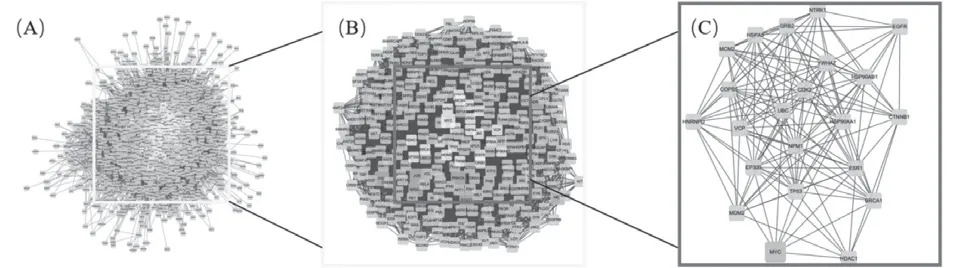
图8 乳腺癌靶点PPI网络
2.6 潜在靶点基因GO生物功能及KEGG通路富集分析对疏肝健脾解毒方的组方活性成分-潜在靶点网络中的21个靶点进行GO生物功能富集分析,结果选取前20个。靶点基因富集结果显示:主要有20条生物学过程(BP),20个分子功能相关过程(MF),6个细胞组分(CC)表达过程。见图9-11。GO富集分析进一步显示:疏肝健脾解毒方治疗乳腺癌的核心基因的GO功能主要涉及对活性氧的反应、氧化应激反应、细胞对氧化应激的反应、含胶原的细胞外基质、DNA结合转录激活活性-RNA聚合酶II特异性、核心启动子结合、丝氨酸型内肽酶活性等。
KEGG通路富集分析显示,疏肝健脾解毒方活性成分-潜在靶点网络中的21个靶点主要富集在47条信号通路,根据P<0.05筛选出前20条。见图12。其中放松信号通路、L-17信号通路、乙型肝炎信号通路、类风湿性关节炎信号通路、糖尿病并发症中的年龄-年龄信号通路、肿瘤坏死因子信号通路、安非他明成瘾信号通路、结直肠癌信号通路、卡波西肉瘤相关疱疹病毒感染信号通路、癌症中的转录失调信号通路、阿米巴原虫病信号通路、癌症蛋白多糖信号通路、膀胱癌信号通路、流体剪切应力和动脉粥样硬化信号通路、MAPK信号通路、幽门螺杆菌感染的上皮细胞信号通路、利什曼病信号通路、ErbB信号通路、粘附斑激酶信号通路、PD-L1的表达与PD-1的检测通路可能为疏肝健脾解毒方抗乳腺癌的关键信号通路,提示疏肝健脾解毒组方可能通过以上各通路协调发挥作用。
利用Cytoscape 3.7.2将活性成分、靶点、关键信号通路进行可视化分析,得到与乳腺癌相关的疏肝健脾解毒组方活性成分-潜在靶点-信号通路网络。见图13。

图9 潜在靶点基因的BP分析

图10 潜在靶点基因的MF分析

图11 潜在靶点基因的CC分析
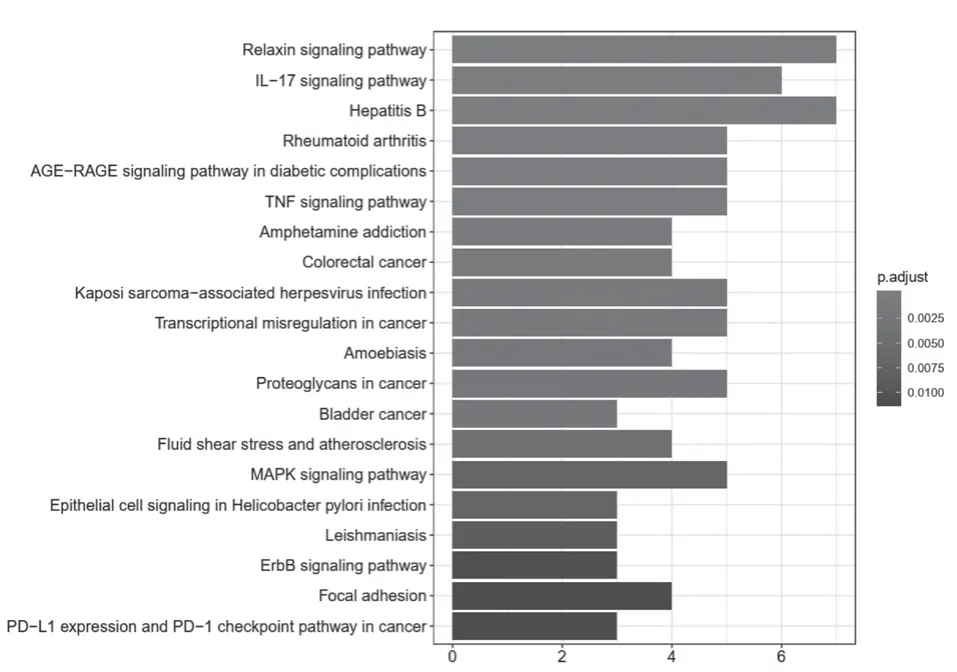
图12 KEGG通路富集分析柱状图

图13 与乳腺癌相关的疏肝健脾解毒组方活性成分-潜在靶点-信号通路网络
3 讨论
乳腺癌是女性中最常见的癌症,是导致女性第二大癌症死亡的疾病,占所有女性恶性肿瘤的比例达8 %~12 %[22]。乳腺癌的发生、发展是多种危险因素共同作用引起的,呈现多样性。我国中医认为产生乳腺癌的内因为正气不足, 气血亏虚,外因为外毒侵袭,情志内伤致肝脾郁结, 最终气血瘀滞, 痰瘀互结于乳房而致病[23]。中药疏肝健脾解毒方具有疏肝解郁、活血化瘀、清热解毒之功效,起到预防和治疗乳腺癌作用。本研究通过构与乳腺癌相关的PPI 网络、疏肝健脾解毒组方活性成分-预测靶点网络,从而构建与预防和治疗乳腺癌相关的组方活性成分-潜在靶点网络,进一步分析疏肝健脾解毒组方预防和治疗乳腺癌的作用机制。
与抗乳腺癌相关的疏肝健脾解毒组方活性成分-潜在靶点网络包括21个靶点,分别是STAT1、SLPI、PRKCA、PLAT、NR3C1、MYC、MMP9、MMP3、MMP1、MET、MAOA、JUN、FOS、CXCL2、COL3A1、COL1A1、CAT、BIRC5、AKR1C3、ADRB2、ADRA2A。其中,度值大于1的 关键 靶 点 为ADRB2、JUN、MMP1、MMP9、PRKCA、FOS、STAT1、BIRC5。推测疏肝健脾解毒组方预防和治疗乳腺癌的作用机制很可能与这些靶点有关。
在靶点基因的 KEGG 通路富集分析中,筛选得到 47条信号通路,其中主要的信号通路为信号转导通路,包括放松信号通路、IL-17信号通路、MAPK信号通路、ErbB信号通路、PD-L1的表达与PD-1的检测通路;肿瘤相关信号通路包括肿瘤坏死因子信号通路、结直肠癌信号通路、癌症中的转录失调信号通路、癌症蛋白多糖信号通路、膀胱癌信号通路等。因此,推断疏肝健脾解毒组方预防和治疗乳腺癌的机制很可能与这些信号通路有关。
综上所述,本研究通过结合网络药理学方法从多成分、多靶点和多通路的角度探索疏肝健脾解毒组方预防和治疗乳腺癌的机制,为下一步进行的作用机制相关实验研究提供了基础,疏肝健脾解毒组方具体的作用机制仍有待未来进一步实验验证与研究。
