嗜酸乳杆菌复合益生菌片对小鼠免疫功能的影响及机制研究
2021-12-06朱自平汪振炯朱华
朱自平,汪振炯,朱华
(1.廊坊市农林科学院,河北 廊坊 065000;2.南京财经大学食品科学与工程学院,江苏省现代粮食流通与安全协同创新中心,江苏 南京 210023;3.江苏第二师范学院生命科学与化学化工学院江苏省生物功能分子重点建设实验室,江苏 南京 211200)
益生菌是能够通过调节肠道菌群的平衡来维持宿主消化系统和肠道健康的一类活的微生物的总称[1-2]。益生菌不仅可以维持宿主肠道微生物稳态和屏障功能,还能调节肠黏膜的免疫功能,可有效地提高肠道干扰素水平以及吞噬细胞和自然杀伤细胞的活性,已被证实是一种良好的免疫激活剂。益生元是指一些不被宿主消化吸收却能被宿主体内的菌群选择性利用并转化为有益于宿主健康的物质[3]。常用的益生元为低聚糖类,包括低聚果糖、低聚半乳糖、低聚木糖、低聚异麦芽糖、大豆低聚糖、菊粉等。合生元又称合生素或共生元,是益生菌和益生元的混合制剂[4]。其中,益生元作为益生菌的营养和能量来源,可协同促进益生菌在肠道的定植和功效发挥。基于合生元的多样性功能,研究已经证实了其免疫保护增强的作用[5],合生元增强吞噬细胞等的功效,已广泛应用于人类和动物保健与疾病预防治疗过程[6-9]。其中,有报道表明热灭活乳双歧杆菌BL-99能够增强免疫球蛋白A(immunoglobulin A,IgA)的分泌,促使小肠黏膜上的淋巴细胞的分化及增殖[10],并激活自然杀伤细胞(natural killer cell,NK)和巨噬细胞(macrophage),生成白介素1(interleukin1,IL-1)、白介素 6(interleukin 6,IL-6)、白介素 12(interleukin 12,IL-12)、ɑ 肿瘤坏死因子(tumor necrosis factor ɑ,TNF-ɑ)及干扰素(interferon,IFN)等细胞因子,激活肠黏膜免疫系统,调节机体的免疫应答,进而增强机体免疫力[11]。Finamore等[12]研究发现,乳杆菌与长双歧杆菌的复合益生菌能够通过影响初始T细胞、记忆T细胞,B细胞、调剂性T细胞和NK细胞,提高人体的免疫力,其中,两株益生菌的混合物并没有改变NK细胞的总数,但增加了NK细胞的活性,从而改善了先天性免疫。翟云等[13]研究发现,乳双歧杆菌M8可以提高免疫抑制模型大鼠的淋巴细胞百分比、T淋巴细胞转化增殖能力和提高血清IgA、免疫球蛋白G(immunoglobulins G,Ig G)、白介素 2(interleukin 2,IL-2)、IL-6、Ⅱ型干扰素(IFN-γ)及 TNF-ɑ 水平,从而改善细胞免疫、体液免疫及固有免疫应答调控,增强模型大鼠的免疫功能。乳杆菌能在进入机体后激活肠黏膜免疫系统,起到保护机体免受感染源的侵袭、抗突变和防癌、预防糖尿病和心血管疾病的作用[14-16]。
本文使用嗜酸乳杆菌LA85和低聚果糖复配组成合生元菌剂(复合益生菌片),并饲喂健康小鼠,通过监控小鼠的体重、免疫器官指数(脾脏指数和胸腺指数)、细胞免疫(淋巴细胞增殖)、体液免疫[半数溶血值(half value of hemolysin,HC50)]、巨噬细胞吞噬能力和 NK 细胞活性等指标[17-19],以确定嗜酸乳杆菌复合益生菌片对小鼠免疫能力的影响,为进一步开发、应用嗜酸乳杆菌合生元提供一定的理论依据。
1 材料和方法
1.1 主要试剂
嗜酸乳杆菌LA85:微康益生菌(苏州)股份有限公司;低聚果糖:量子高科(中国)生物股份有限公司;生理盐水、汉克氏液(pH7.2)、RPMI1640培养液、小牛血清、青链霉素、刀豆蛋白 A(concanavalin A,ConA)、琼脂糖、噻唑蓝(thiazolyl blue tetrazolium bromide,MTT)、磷酸盐缓冲液、补体(豚鼠血清)、文齐氏试剂、1%NP-40裂解液、吉姆萨染液:北京索莱宝科技有限公司;SA缓冲液、乳酸锂、碘硝基氯化四氮唑、吩嗪二甲基酯硫酸盐、氧化型辅酶I:上海源叶生物科技有限公司;Tris-HCl、Na2CO3、冰醋酸、盐酸、异丙醇(均为分析纯):国药化学上海有限公司;绵羊红细胞(sheep red blood cell,SRBC)、鸡红细胞:南京森贝伽生物技术有限公司;小鼠淋巴瘤细胞YAC-1:上海一研生物科技有限公司。
1.2 实验动物
健康SPF级ICR小鼠[雌性,共240只,动物许可证号SCXK(京)2016-0011]:北京维通利华实验动物技术有限公司。
1.3 主要仪器
电子天平(BSA 124S型):德国赛多利斯公司;超净工作台(SW-CJ-2D):苏州净化设备公司;细胞培养箱[BPN-150CRH(UV)]:上海一恒科学仪器有限公司;全波段酶标仪(Epoch型):美国BioTek公司;台式高速低温冷冻离心机(TGL16M):上海赫田科学仪器有限公司。
1.4 方法
1.4.1 复合益生菌片制备
向经过冷冻干燥的嗜酸乳杆菌LA85菌粉中,添加一定量低聚果糖及其他食品级辅料(玉米淀粉、麦芽糊精等),混合,利用淀粉糖浆为黏合剂,湿法制粒压片法得到该复合益生菌片,1 g/片,每片含嗜酸乳杆菌LA85 1.0×106CFU和低聚果糖0.25 g,4℃保存。
1.4.2 实验动物处理和分组
将240只小鼠随机分为4组,每组60只,分别开展迟发型变态反应(delayed type hypersensitivity,DTH)、脏器/体重比值、半数溶血值测定和抗体生成细胞检测实验(实验Ⅰ组)、巨噬细胞吞噬鸡红细胞能力实验(实验Ⅱ组)和ConA诱导小鼠淋巴细胞转化和NK细胞活性测定实验(实验Ⅲ组)。各实验组低、中、高剂量设为人体推荐食用量的5倍、10倍、30倍,每组中的60只小鼠随机分为4小组,每小组15只,以0.167 g/kg bw(低剂量组)、0.333 g/kg bw(中剂量组)、1.000 g/kg bw(高剂量组)的剂量分别灌胃小鼠,同时设生理盐水为阴性对照组。各剂量组及阴性对照组均按20 mL/kg bw给予灌胃(以生理盐水稀释后灌胃),每周根据小鼠体重增长情况调整灌胃量,30 d后,分别测定相关免疫功能指标。
1.4.3 脏器/体重比值测定
小鼠称重,采血处死,取脾脏、胸腺等器官,称重,计算脾脏/体重比值和胸腺/体重比值。
1.4.4 迟发型变态反应
采用足趾增厚法评估迟发型变态反应(DTH)的程度。具体方法:小鼠给予复合益生菌片30 d,第25天,每只小鼠腹腔注射0.2 mL 2%(用生理盐水配制,体积分数)压积SRBC悬液,致敏后4 d,测量小鼠左后足趾厚度。随后每只小鼠在测量部位皮下注射20 μL 20%SRBC,注射后24 h测量左后足趾厚度,同一部位测量3次取平均值,以注射前后足趾厚度的差值(足趾肿胀度)来表示DTH程度。
1.4.5 ConA诱导的小鼠淋巴细胞转化实验(MTT法)
饲喂复合益生菌片30 d后处死小鼠,无菌取脾制备单细胞悬液,调整细胞浓度到2×107个/mL,按MTT法,在570 nm处测定OD值,利用加ConA实验孔的OD值和不加ConA实验孔的OD值之差评估小鼠的淋巴细胞增殖能力。
1.4.6 抗体生成细胞检测实验(改良玻片法)
小鼠给予复合益生菌片30 d,第25天每只小鼠腹腔注射0.2 mL 2%(用生理盐水配制,体积分数)压积SRBC进行免疫,4 d后无菌取全脾制成单细胞悬液,以每管0.5 mL分装小试管,向管内再加50 μL 10%SRBC(用SA缓冲液配制,体积分数)和脾细胞悬液20 μL,迅速混匀,倾倒至已刷琼脂糖薄层的玻片上,制平行片,待琼脂凝固后,将玻片水平扣放在片架上,放入CO2培养箱中继续孵育1.5 h,然后将用SA缓冲液稀释的补体(1∶8,体积比)放入玻片架凹槽内,继续孵育2.0 h,计数溶血空斑数。
1.4.7 血清溶血素溶血值的测定
小鼠给予复合益生菌片30 d,第25天每只小鼠腹腔注射0.2 mL 2%(用生理盐水配制,体积分数)压积SRBC进行免疫,4 d后摘除眼球取血,静置1 h以充分析出血清,随后离心收集血清。用SA缓冲液稀释300倍,依次取血清稀释液0.1 mL,10%(体积分数)SRBC 0.05 mL,补体0.1 mL,混匀后37℃保温30 min后置于冰浴终止反应,离心,取上清液0.05mL加文齐氏试剂0.15 mL,混匀放置10 min后用酶标仪在540 nm处测定OD样品,空白样品为取0.0125 mL 10%(用SA缓冲液配制,体积分数)压积SRBC,加文齐氏试剂至0.2 mL充分混匀,放置10 min之后测定540 nm处ODSRBC,半数溶血值HC50按下式计算。
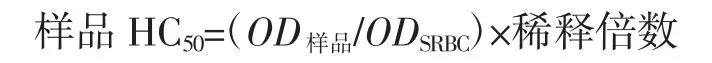
1.4.8 腹腔巨噬细胞吞噬鸡红细胞实验
小鼠给予复合益生菌片30 d后,每只腹腔注射5%压积鸡红细胞悬液1 mL。2.5 h后处死小鼠,腹腔注入2 mL生理盐水洗涤,取腹腔液制滴片,移至37℃恒温箱孵育30 min。孵育结束后用生理盐水漂洗,固定细胞,染色,镜检计数100个巨噬细胞,吞噬率和吞噬指数按下式计算。

1.4.9 NK细胞活性测定(乳酸脱氢酶测定法)
实验小鼠喂食复合益生菌片30 d后,处死小鼠,无菌取其脾脏,制成脾细胞悬液作为效应细胞,裂解红细胞并进一步调整细胞浓度为2×107个/mL。按效靶比为50∶1,将YAC-1细胞(靶细胞)和脾细胞(效应细胞)各100 μL加入U型96孔培养板,靶细胞自然释放孔加靶细胞和含10%胎牛血清的RPMI1640完全培养液各100 μL,靶细胞最大释放孔加靶细胞和1%NP40各100 μL,上述均设3个平行孔,37℃,5%CO2环境下培养4 h。随后,离心5 min,各孔吸取100 μL上清液置于平底96孔板,随后加入100 μL乳酸脱氢酶基质液置于暗处反应10 min后加入30 μL 1 mol//L的HCl溶液终止反应,在492 nm处利用酶标仪读取OD值,并进一步按以下公式计算NK细胞活性。

1.5 数据处理
所有实验数据用平均值±标准差(X±SD)表示,采用DPS7.05软件对各组实验数据进行单因素方差分析,P<0.05作为显著性标准。
2 结果与讨论
2.1 复合益生菌片对小鼠体重的影响
饲喂复合益生菌片期间,小鼠活动正常,生长发育良好,未观察到异常体征或死亡。表1~表3为各实验组小鼠体重变化。
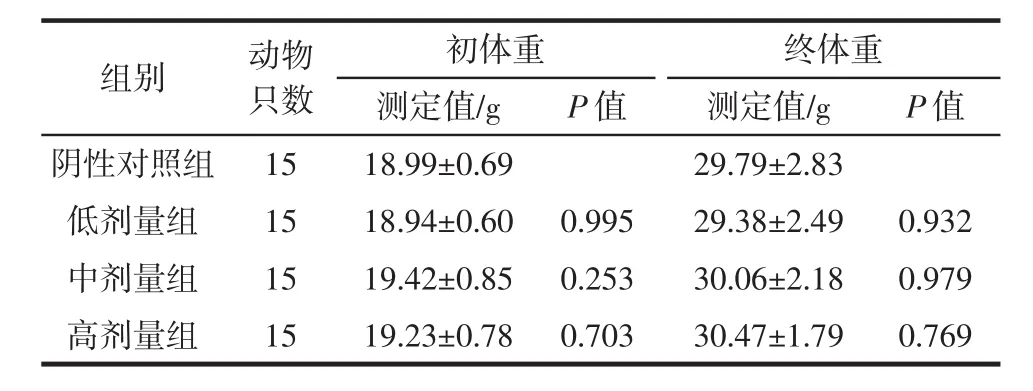
表1 实验Ⅰ组小鼠的体重变化Table 1 The weight changes of mice in experimental group I
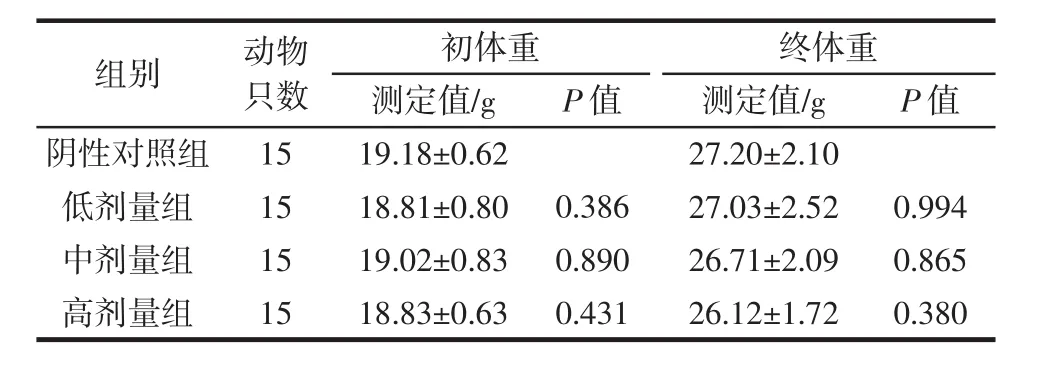
表2 实验Ⅱ组小鼠的体重变化Table 2 The weight changes of mice in experimental group Ⅱ
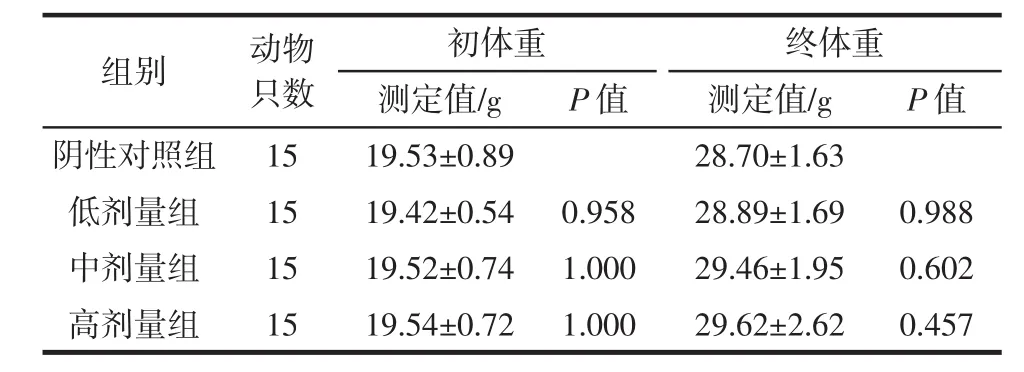
表3 实验Ⅲ组小鼠的体重变化Table 3 The weight changes of mice in experimental group Ⅲ
由表1~表3可知,饲喂复合益生菌片30 d后,各实验组小鼠体重增长正常,各剂量组与对照组之间无显著性差异(P>0.05),可以初步得出长期口服该复合益生菌片对动物生长安全性良好。
2.2 复合益生菌片对小鼠脏器/体重比值的影响
小鼠的胸腺及脾脏的绝对脏器比值如表4所示。
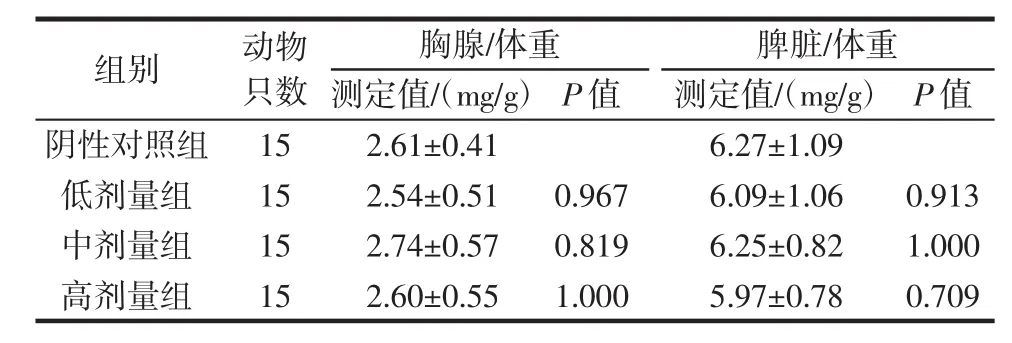
表4 复合益生菌片对小鼠脏器/体重比值的影响Table 4 Effect of probiotic compound tablets on the ratio of organ and body weigh in the mice
饲喂复合益生菌片30 d后,其脾脏/体重比值和胸腺/体重比值与对照组间相比无明显差异(P>0.05)。
2.3 复合益生菌片对小鼠细胞免疫功能的影响
复合益生菌片对各组小鼠迟发型变态反应(DTH)的影响见图1。
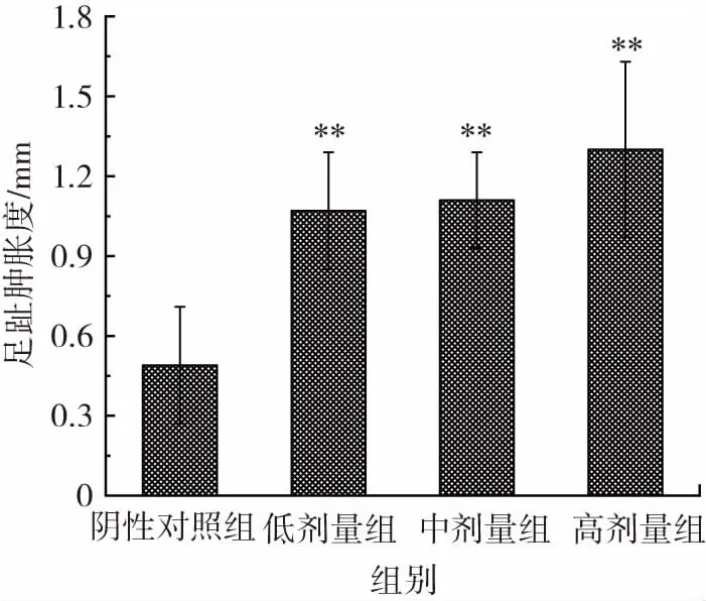
图1 复合益生菌片对小鼠迟发型变态反应(DTH)的影响Fig.1 Effect of probiotic compound tablets on delayed-type hypersensitivity(DTH)in the mice
由图1可知,与阴性对照组比较,经口给予小鼠不同剂量的复合益生菌片30 d,在低、中、高剂量组的小鼠足趾肿胀度均极显著提高(P<0.01),表明该复合益生菌片可影响小鼠DTH。
复合益生菌片对各组小鼠淋巴细胞增殖的影响见表5。
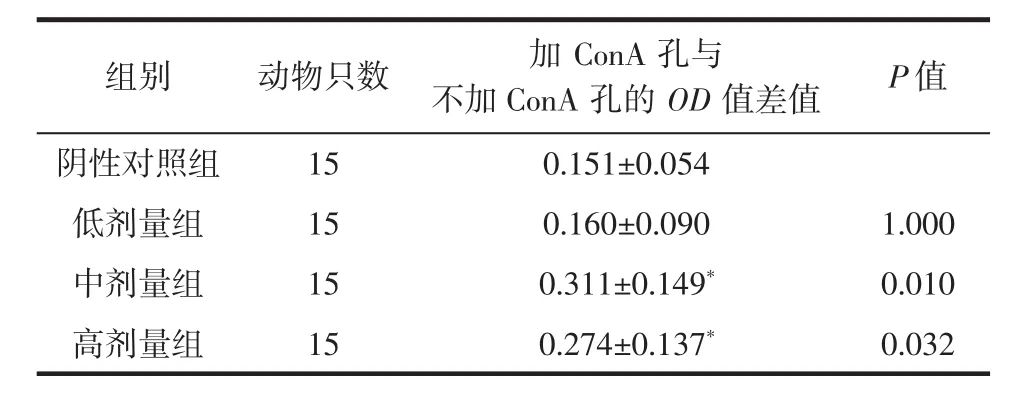
表5 复合益生菌片对淋巴细胞增殖的影响Table 5 Effect of probiotic compound tablets on lymphocyte proliferation
由表5可知,经统计学分析,与阴性对照组相比,经口给予小鼠不同剂量的复合益生菌片30 d后,其淋巴细胞增殖能力在中、高剂量组显著增强(P<0.05),表明该复合益生菌片能在中高剂量水平上有效促进由ConA诱导的小鼠淋巴细胞增殖。T淋巴细胞和B淋巴细胞的增殖是机体细胞免疫的直接反馈,可以判定细胞免疫功能阳性[20]。
2.4 复合益生菌片对体液免疫的影响
复合益生菌片对抗体生成细胞数和小鼠半数溶血值的影响见图2。
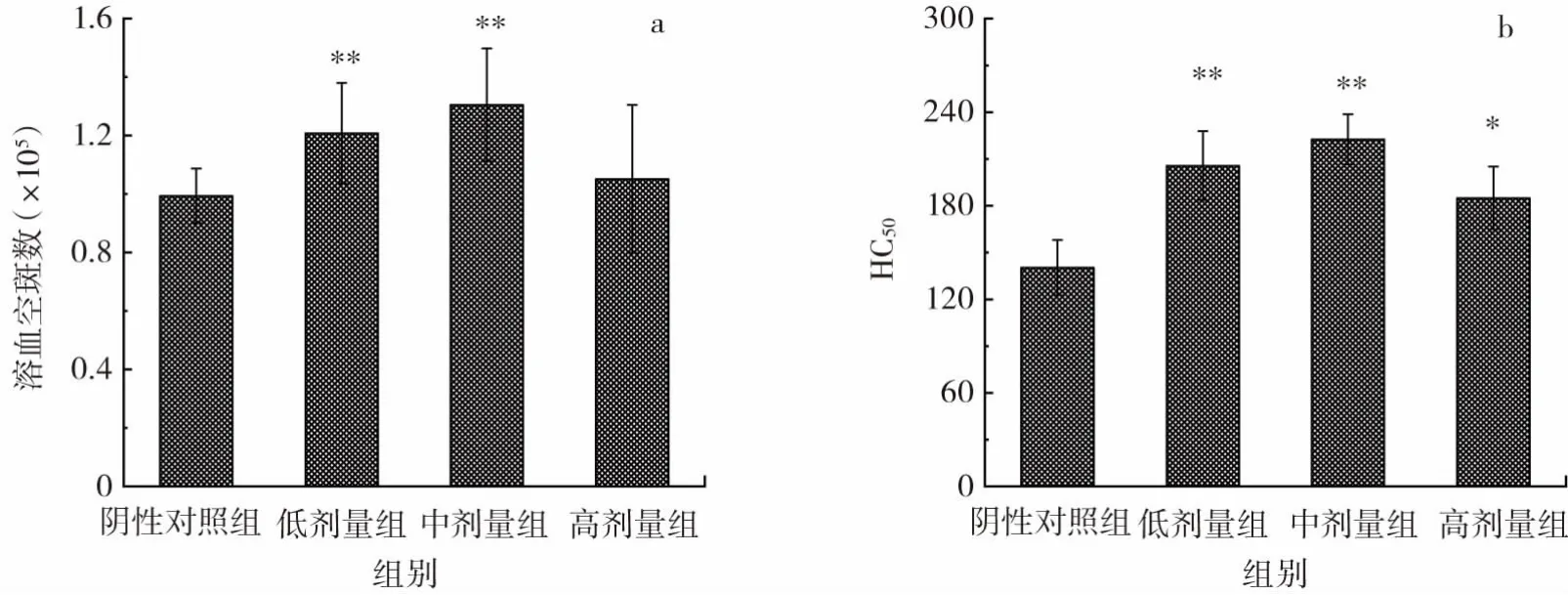
图2 复合益生菌片对抗体生成细胞数和小鼠半数溶血值的影响Fig.2 Effect of probiotic compound tablets on antibody-producing cells and half hemolysin value in mice
由图2a可知,喂食30 d后,中、低剂量复合益生菌片均可极显著提高小鼠抗体细胞生成数(P<0.01)。进一步由图2b可知,喂食低剂量和中剂量复合益生菌片可极显著提高小鼠半数溶血值(HC50)(P<0.01),而喂食高剂量复合益生菌片可显著提高HC50值(P<0.05)。因此可以证明复合益生菌片可有效改善小鼠体液免疫功能。
2.5 复合益生菌片对小鼠单核-巨噬细胞吞噬功能的影响
饲喂复合益生菌片对实验小鼠巨噬细胞吞噬鸡红细胞能力的影响见表6。
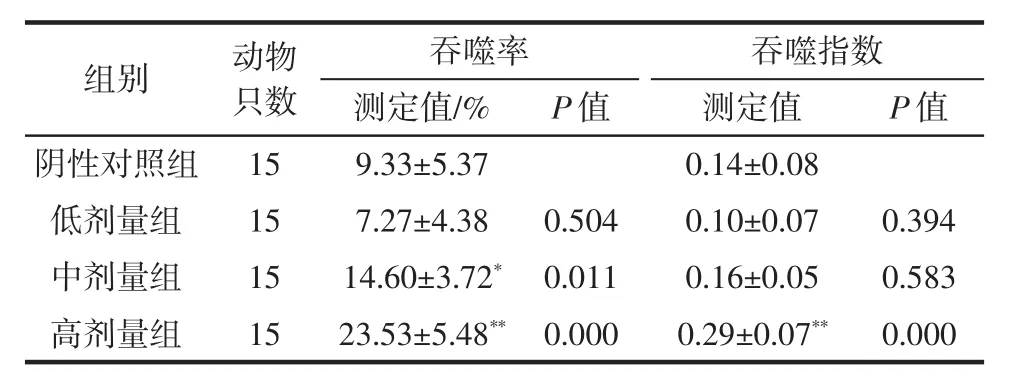
表6 复合益生菌片对小鼠巨噬细胞吞噬鸡红细胞能力的影响Table 6 Effect of probiotic compound tablets on mice peritoneal macrophages phagocytosis of chicken red blood cells
由表6可知,与阴性对照组相比,中、高剂量组复合益生菌片对吞噬鸡红细胞能力有显著性差异,且高剂量组的吞噬率和吞噬指数较阴性对照组有极显著提高(P<0.01),表明饲喂复合益生菌片有助于提高机体的非特异性免疫功能。
2.6 复合益生菌片对小鼠NK细胞活性的影响
饲喂复合益生菌片对小鼠NK细胞活性的影响见图3。
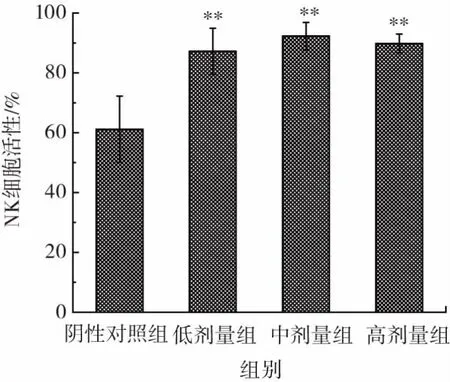
图3 复合益生菌片对小鼠NK细胞活性的影响Fig.3 Effect of probiotic compound tablets on the activity of NK in mice
由图3可知,经口给予小鼠不同剂量的复合益生菌片30 d后发现,各处理剂量的复合益生菌片均可极显著提高NK细胞的活性(P<0.01)。结合其对小鼠巨噬细胞吞噬鸡红细胞能力的实验结果可知饲喂复合益生菌片可有效提高单核-巨噬细胞吞噬功能和NK细胞活性,从而提高机体的非特异性免疫功能。
3 结论
饲喂以嗜酸乳杆菌LA85和低聚果糖等复配压片所制得的复合益生菌片对小鼠体重增长无影响。喂食各剂量组复合益生菌均可显著提高小鼠足趾肿胀度(DTH)(P<0.01);在中、高剂量水平上有效促进小鼠淋巴细胞增殖(P<0.05),低、中剂量水平上可极显著提高小鼠抗体生成细胞数(P<0.01)和 HC50值(P<0.01),高剂量水平则可提高HC50值(P<0.05),证明可有效改善小鼠细胞免疫能力和体液免疫能力。此外,饲喂复合益生菌片可有效提高单核-巨噬细胞吞噬功能和NK细胞活性,因此,该复合益生菌片对小鼠细胞免疫、体液免疫、非特异免疫功能均具有一定的增强作用,证明饲喂复合益生菌片有助于全面调动机体免疫系统,阻止外来物质的侵入,从而增强机体免疫力。综上所述,嗜酸乳杆菌LA85复合益生菌片具备较好地增强小鼠机体免疫的能力,且安全性良好,应用前景广阔。
