海藻酸钠/羧甲基微胶囊对副干酪乳杆菌生存率影响的研究
2021-12-05葛得龙张鸿飞李明霞王文博范艳萍邹鹏飞高媛媛
葛得龙,张鸿飞,刘 娇,李明霞,王文博,范艳萍,邹鹏飞,高媛媛
(1.潍坊医学院生命科学与技术学院,山东潍坊 261053;2.潍坊医学院药学院,山东潍坊 261053;3.青岛根源生物技术集团有限公司,国家企业技术中心,山东青岛 266000;4.潍坊医学院基础医学院,山东潍坊 261053)
益生菌(Probiotics),被定义为“通过改善肠道微环境的平衡来有益地影响宿主健康的活微生物补充剂”(Trabelsi 等,2013;Li,2009),其对维持肠道微生态平衡、肠道屏障免疫功能、促进肠道消化、吸收功能具有重要的生理意义,另外,还可用于炎症性结肠炎(Li 等,2016),乳糖不耐症,急性肝衰竭(Lv 等,2014)、肝硬化(Shi 等,2017)、高胆固醇血症,免疫紊乱和癌症(Eslami 等,2019;Fareez 等,2015)等。研究表明,益生菌可以减少金黄色葡萄球菌的定植和感染(Piewngam 等,2018)。此外,益生菌(如乳酸杆菌)作为食品添加剂可以增加仔猪的体重并改善其健康状况,成为畜牧饲料中抗生素的替代品之一(张璐等,2008)。然而,大多数益生菌对许多食物、人胃肠道的环境(如氧气、光照、湿度、pH 等)和储存温度等非常敏感(Izquierdo 等,2017;Celik 等,2016),存活率较低。因此,提高食品加工中益生菌活力,以抵抗不利的环境条件,目前受到越来越多的关注,具有重要的研究意义(Chavarri 等,2010)。
微胶囊(Yao 等,2017;Dorazio 等,2015)、水凝胶(Dafe 等,2017)等是提高益生菌生存率的有效方法,可以将益生菌固定在材料中,使其与外界环境隔离开,从而提高其存活率(李漫等,2014)。微胶囊的制备方法主要有冷冻喷雾干燥法(Broeckx等,2017;Ten 等,2016;Broeckx 等,2016)、挤出法(Dafe 等,2017;Rodrigues 等,2017)、乳化法、电喷雾法(Linran 等,2017;Coghetto 等,2016;Dos 等,2014)等。胶囊的壁材主要分为海藻酸钠(Alg)、壳聚糖(Bepeyeva 等,2017)、乳清蛋白(Soukoulis 等2013;Ying 等,2010)、玉米淀粉(Mandal 等,2015)、大豆蛋白(Gonzalez 等,2018)、羧甲基纤维素及有机-无机杂化复合材料(Li 等,2017)等,在微胶囊中添加保护剂如乳糖、葡萄糖等可以进一步提高益生菌的活力(Jofre 等,2015)。Huq 等(2017)将益生菌(鼠李乳杆菌)包裹在藻酸盐微球(ACL-1)) 中,在微球中添加纳米纤维素和卵磷脂,可以提高鼠李糖乳杆菌在胃通道和胃储存过程中的生存能力。Fareez 等(2015)将植物乳杆菌LAB12 掺入壳聚糖(Ch)包被的藻酸盐-黄原胶(Alg-XG)微胶囊中,可以时间和pH 依赖性释放,提高了其在模拟胃液和肠液中的存活率。Singh 等(2017)以京尼平为交联剂,将益生菌(鼠李糖乳杆菌)成功包封在羧甲基纤维素-壳聚糖微球中,具有耐热和pH 不敏感的特性。其主要机理是富含阴离子的材料(如海藻酸钠、羧甲基纤维素)滴入Ca2+溶液时,COO-与Ca2+发生离子交联,瞬间固化形成具有“网格结构”的凝胶(Coghetto 等,2016)。但是,这些凝胶是多孔的,孔径约为17 nm,很难阻断周围环境的小分子和离子(如H 离子、消化酶等)(Yao 等,2018)。目前发展的技术如层层自组装(Anselmo 等,2016)、填充无机纳米颗粒(Cavalu 等,2017)等可以改善这一问题。
羧甲基壳聚糖是由壳聚糖改性合成(程佳儿等,2018),具有良好的水溶性、生物相容性和无毒性(Jiang 等,2015);此外,向Alg 中加入N,O-羧甲基壳聚糖(CMCS),可以形成比Alg 凝胶更紧凑的“蛋壳”结构,这是因为CMCS 上的COO-也参与了Ca2+的离子交联(Mi 等,2005)。这种混合凝胶体系具有pH 响应性(Chen 等,2004),可以运用于胃肠道蛋白药物的定位释放(Yang 等,2013;Lin等,2005)。此外,该体系还可以作为伤口敷料。例如,Shi 等(2016)开发了一种羧甲基壳聚糖-海藻酸-胶原(称为CSCM)组成的生物相容性复合微球,作为一种新型止血材料。但是,由Alg 和CMCS 包埋益生菌用于胃肠道递送的研究鲜有报道。因此,在本研究中,以海藻酸钠和N,O-羧甲基壳聚糖为壁材制备微胶囊,研究其对副干酪乳杆菌活力的影响。
1 材料与方法
1.1 材料与仪器 海藻酸钠和氯化钙均购自国药集团;N,O-羧甲基壳聚糖购自上海阿拉丁生化科技股份有限公司;MRS 肉汤、MRS 培养基均购自青岛高科园海博生物技术有限公司。
分析天平(赛多利斯科学仪器(北京)有限公司)、恒温培养振荡器(ZWY-2102C,上海智城分析仪器制造有限公司)、数显电热培养箱(HPX-9272 MBE 上海博迅实业有限公司医疗设备厂)、高速冷冻心机(赛默飞公司)、洁净工作台(苏州安泰空气技术有限公司)、恒温鼓风干燥箱(上海智城分析仪器制造有限公司)和涡旋机(VORTEXKylin-bell5)。
1.2 试验方法
1.2.1 副干酪乳杆菌生长曲线的测定 取少量副干酪乳杆菌冻干粉接种于无菌MRS 肉汤中,于37 ℃培养24 h,连续活化3 次,1%接种量再次培养,每隔2 h 测定菌悬液的吸光度(OD600)。
1.2.2 静电液滴法微胶囊的制备 副干酪乳杆菌过夜培养24 h 后,离心(4 ℃,4000 r/min,10 min)收集,洗涤3 次,5 mL 生理盐水重悬。与45 mL 的1.5%(wt%)海藻酸钠及1%葡萄糖凝胶溶液充分混合,使用静电纺丝设备将混合液喷入0.2 moL 的氯化钙溶液中,硬化30 min 后过滤洗涤,转移至1.5% CMCS 溶液中,继续交联10 min 后过滤洗涤,0.2 moL 的氯化钙溶液中,硬化30 min。将样品在-80 ℃中预冻过夜,在冷冻干燥机中冻干24 h。
1.2.3 传统挤出法微胶囊的制备 副干酪乳杆菌过夜培养24 h 后,离心(4 ℃,4000 r/min,10 min)收集,洗涤3 次,5 mL 生理盐水重悬。与45 mL 1.5%(wt%)海藻酸钠、1%葡萄糖、1.5%的CMCS溶液凝胶溶液充分混合,使用静电纺丝设备将混合液喷入0.2 moL 的氯化钙溶液中,硬化30 min后过滤洗涤。将样品在-80 ℃中预冻过夜,冷冻干燥机冻干。
1.2.4 微胶囊包埋产率的测定 称取0.1 g 微胶囊置于9 mL 磷酸盐缓冲液中,37 ℃恒温振荡,微胶囊溶解并释放包埋的干酪乳杆菌,过一系列10倍梯度稀释后,取合适稀释度的菌悬液于MRS琼脂培养基上,37 ℃下厌氧培养48 h,进行活菌计数。相应微胶囊的包埋产率计算公式如下:
包埋产率/%=微胶囊中活菌数量/最初加入的活菌数量。
1.2.5 红外波谱(FTIR)分析测定 采用传统的固体溴化钾压片法。简而言之,取出适量的溴化钾粉末置于60 ℃烘箱中过夜烘干。取冻干的1 mg微胶囊和100 mg 溴化钾晶体,将溴化钾倒入研钵中充分研磨至粉末并放入红外干燥箱中充分干燥。然后加入压片磨具并用千斤顶制备成透明的溴化钾片。先将空白溴化钾压片的红外结果选为背景,样品的红外光谱就自动扣除了溴化钾红外光谱的影响。波谱测量范围为4000~450 cm,每次测量结果为16 次测量结果平均值。
1.2.6 模拟液的配制 人工模拟胃液(SGF):用浓盐酸将0.2%(m/V)NaCl 溶液pH 调至2.0,加入定量的胃蛋白酶并使其最终浓度为3.0 g/L,最后0.22 μm 的膜过滤除菌。
人工模拟肠液(SIF):将胰蛋白酶和胆盐均匀分散于磷酸盐缓冲液(0.1 mol/L,NaH2PO4,pH 7.0)中,使其最终浓度分别为1.0 g/L 和4.5 g/L,用0.1 mol/L 的NaOH 将溶液pH 调至7.4,最后用0.22 μm 的膜过滤除菌。
1.2.7 微球在模拟胃肠液中的存活试验 称取0.1 g 湿微胶囊置于9 mL 人工胃液中,37 ℃、100 r/min的水浴摇床中振荡温育,分别于0、5、30、60、120 min时离心收集微球,无菌水洗涤后在9 mL 10%柠檬酸钠溶液中溶解,当稀释后采用涂布平板法进行活菌计数。同时以0.1 mL 未微胶囊化的副干酪乳杆菌悬液作对照试验。
1.2.8 在连续的模拟胃肠液中的存活试验 称取0.1 g 湿微胶囊,置于9 mL 人工胃液中,37 ℃、100 r/min 的水浴摇床中振荡温育1 h 后,离心收集微球,生理盐水洗涤后加入9 mL 人工肠液,60 min和120 min 时取样进行活菌计数。同时以1 mL 未微胶囊化的杆菌悬液作对照试验。
1.2.9 长期储存试验 游离细菌和包裹在生理盐水中的细菌微胶囊在4 ℃中保存4 周,模拟长期储存的水基商业产品。每周采用平板计数法检测细菌活力;将1 g 微球悬浮于9 mL 10%柠檬酸钠水溶液中,使微胶囊溶解。连续稀释48 h,MRS 琼脂平板计数法测定活菌数。
1.3 数据处理 每组试验做3 个平行,运用Graph Pad 8.0.2 进行数据分析与处理,并用软件中ANOVA 分析进行数据统计与作图,数据以“平均数±标准差”表示,以P <0.05 和P <0.01 作为有统计学差异和有显著统计学差异的判断标准,P >0.05 作为无统计学差异的判断标准。
2 结果与讨论
2.1 副干酪乳杆菌生长曲线的测定 副干酪乳杆菌的生长曲线如图1 所示。在6 h 左右开始进入对数生长期,12 h 左右增殖最快;在16 h 左右,进入平台期;这与益生菌自身的生长习性相关。
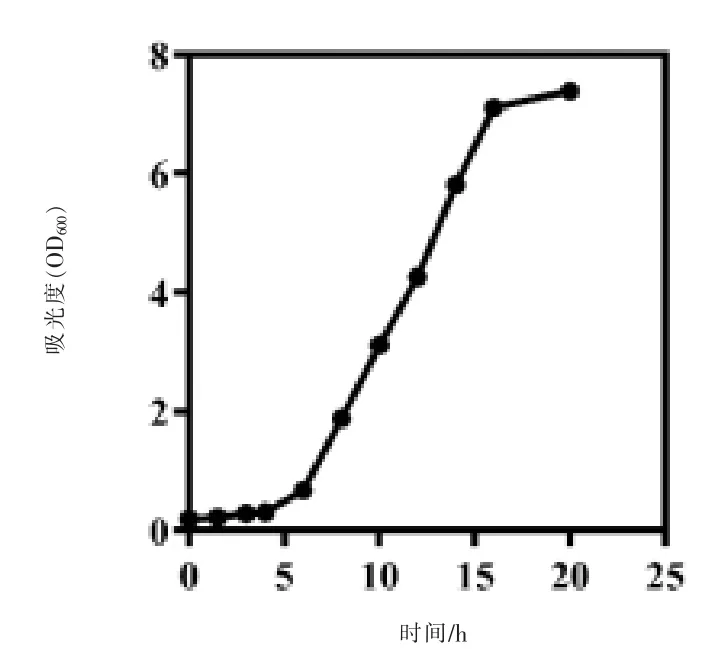
图1 副干酪乳杆菌的生长曲线
2.2 微胶囊性能评价
2.2.1 微胶囊平均粒径 如表1 所示,传统滴注法制备的不同配比的微胶囊(AC-1、AC-2、AC-3)的平均粒径分别为(2.30±0.08)mm、(2.39±0.09)mm 和(2.56±0.08)mm,粒径无显著统计学差异(P>0.05);而采用静电液滴方法制备的微胶囊,平均粒径为(1.03±0.09)mm,与传统滴注法相比,平均粒径较小,有显著统计学差异(P <0.01);但制备工艺较复杂,耗时较长。造成这种粒径大小显著性差异的原因主要是静电液滴法中施加的电荷降低了聚合物液滴的表面张力,使其在重力的作用下产生的液滴更小。
2.2.2 微胶囊包埋产率 如表1 所示,传统滴注法制备的配比为1∶1 的微胶囊的包埋产率为(92.37±2.74)%,与同为传统滴注法制备的AC-1 和AC-3微胶囊相比,包埋产率分别提高了38.42%和39.58%,具有显著的统计学差异(P <0.01);而与采用静电液滴法制备的E-AC 微胶囊相比,包埋产率仅提高了0.17%,无显著的统计学差异(P >0.05)。
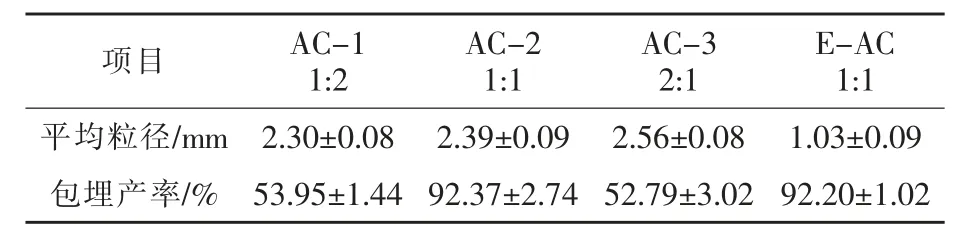
表1 不同配比的微胶囊平均粒径和包埋产率
2.2.3 FTIR 测定 对Alg 和CMCS 的单分子生物材料(图2A 和图2B),强吸收带和宽吸收带分别代表波长3481 cm 和3363 cm 附近的峰,这是由于-OH 的伸缩和强不对称吸收引起的。在波长1616 cm 和1596 cm 附近存在羧酸阴离子,在波长1029 cm 和1310 cm 处存在C-O-C 伸缩振动,这是天然多糖Alg 的固有特性。微胶囊在波长2928 cm 和2962 cm 处显示出双峰(图2C 和图2D)。这是由于CH3-和CH2-基团的不对称伸缩振动造成的。这些峰归因于脂肪酸中存在的典型官能团,它们是细胞膜成分的一部分,这表明益生菌被包封在微胶囊中。
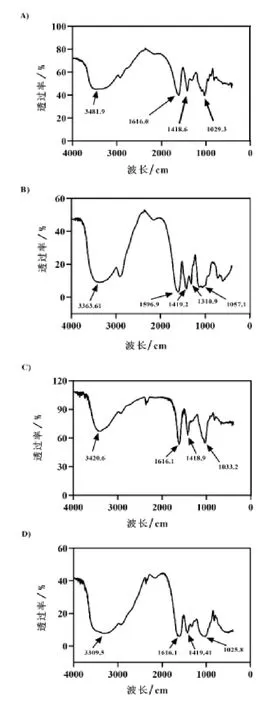
图2 FTIR 结果
2.2.4 微胶囊表面形态 图3 分别为SEM 捕获的冻干E-AC 和AC-2 珠微胶囊的珠状结构和表面形貌。所有配方的微胶囊表明存在明显褶皱,形状不规则。E-AC 为长梭形珠状结构,而AC-2 为珠状结构。这种不均匀性反映了表面聚合物浓度较高;特别是外层CMCS,在冷冻干燥过程除水后表现出更高的收缩率。表面形貌观察表明,微胶囊表面光滑、致密。SEM 图像显示,细菌并没有出现在表面,这说明它们被包埋在了基质中。无孔的致密表面提供了更强的物理屏障,阻止SJF 在通过肠道时扩散,从而保护细菌不从被包裹的基质中逃逸。细菌表面呈杆状结构,表明细胞均匀分布在材料基质表面,直至珠子的核心。

图3 SEM 结果
2.2.5 微胶囊抗酶降解试验 E-AC 微胶囊在人工模拟胃液SGF(加入胃蛋白酶)中的结果显示,E-AC 在0、30、60 min 和120 min 内形态呈珠状,未发生明显变化,表明微胶囊有pH 敏感性和抗酶降解性。
2.2.6 微胶囊胃肠道模拟试验 益生菌在经过人胃肠道时,有相当一部分损失;因此,在模拟胃肠道条件下研究了包埋对细胞存活率的影响。将游离和包裹的益生菌暴露在模拟的胃和肠道环境中,以评估其存活率。由图4 可知,游离的益生菌在1 h 内损失了3 log10cfu/mL,而2 h 时损失了7 log10cfu/mL,而微胶囊E-AC 在2 h 时仍有8.4 log10cfu/mL。说明微胶囊对胃酸的耐受性明显高于游离益生菌,这主要是由于CMCS 和Alg 形成了更加致密的网格结构,有利的保护了益生菌免受外界不利环境的杀伤。在进入SIF 溶液后,未检测到游离益生菌,微胶囊依然有7.58 log10cfu/mL的存活率,存在显著性差异。说明益生菌对碱性环境不耐受,而微胶囊化可以明显提高益生菌的存活率。
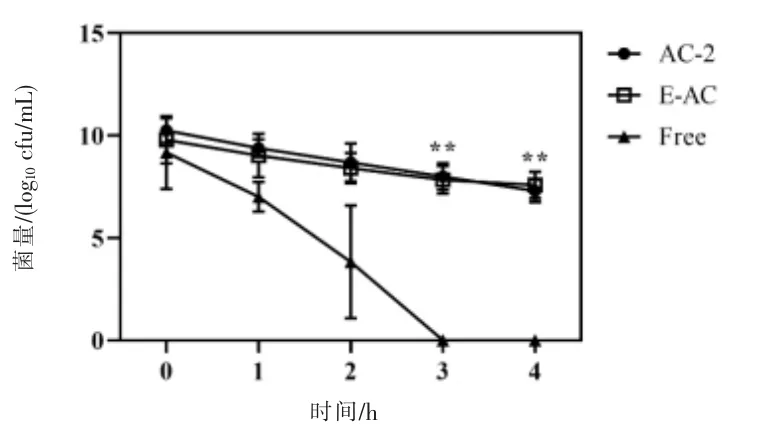
图4 微胶囊胃肠道模拟试验结果
2.2.7 长期储存性试验 微胶囊在4 ℃的生理盐水中保存4 周,以模拟长期存储条件。由图5 可知,4 周后,游离的益生菌减少了4.5 log10cfu/mL,而在储存过程中,微胶囊化的益生菌下降了2.9 log10cfu/mL。结果表明,在长期储存过程中,微胶囊化在一定程度上对于提高益生菌的存活率非常有效。
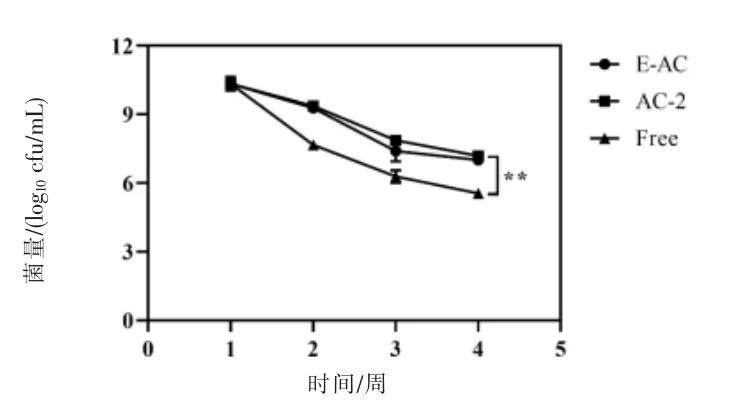
图5 微胶囊长期储存试验结果
3 结论
综上所述,静电液滴法制备的微胶囊粒径比传统滴注法较小,在提高益生菌长时间储存和胃肠道转运过程中的生存能力方面具有很大的优势。可以推测,Alg 和CMCS 交联形成的紧凑的“蛋壳”结构和pH 敏感性提高了益生菌的生存能力。因此,本研究开发的微胶囊有望用于功能性食品和药品中敏感益生菌的封装和传递。
