TLR4、MyD88、NF-κB在乙型肝炎病毒肝硬化患者中的表达及其临床意义
2021-12-04马良赵阳伍华英徐伟苗浒
马良,赵阳,伍华英,徐伟,苗浒
(华北石油管理局总医院1.感染性疾病科,2.老年医学科,3.血液内分泌科,4.医学检验科,5.医务科,河北 沧州062552)
乙型肝炎病毒是一类嗜肝DNA 病毒,流行病学调查显示,全球范围内,约有3 亿人感染或携带HBV,且高发于亚洲和非洲[1]。有研究报道,中国约有2 300 万慢性乙型肝炎患者,而乙型肝炎病毒感染人数则高达1.3 亿[2]。乙型肝炎病毒感染人体后,机体会产生抗病毒免疫应答,一方面可控制病毒的复制,清除病毒,促使部分患者病情得到缓解甚至康复;另一方面,抗病毒免疫应答会诱使机体发生炎症反应,导致部分患者肝脏受到损伤或坏死,甚至进展为肝硬化或肝癌[3-4]。对大多数儿童和部分成年人则难以有效清除病毒或控制病毒的发展,进而表现为病毒携带者或慢性肝炎,而约10%~30%的患者会发展为肝硬化或肝癌[5-6]。因此分析肝硬化的发病机制,探讨有效的诊断指标具有十分重要的临床意义。乙型肝炎病毒感染所致的不同临床转归与病毒和宿主免疫系统之间的作用存在密切联系。Toll样受体4(toll-like receptor 4,TLR4)、髓样分化因子88(myeloid differentiation factor 88, MyD88)、核转录因子-κ(nuclear factor-kappa B, NF-κB)信号通路广泛存在于机体各个组织细胞中,是疾病发生、发展过程中重要通路,可介导炎症因子在细胞中的表达[7-8]。研究发现,TLR4、MyD88、NF-κB信号通路与肝免疫异常、炎症反应所致的肝损伤、肝星状细胞的活化及肝纤维化、肝癌的发生发展密切相关[9-10]。基于此,本研究通过探讨肝硬化中TLR4、MyD88、NF-κB 信号通路的表达及其在诊断预后中的临床价值,旨在为临床诊治肝硬化及评价预后提供依据。
1 资料与方法
1.1 一般资料
选取2017年1月—2019年1月华北石油管理局总医院收治的130 例乙型肝炎肝硬化患者为研究对照(肝硬化组),选择同期130 例乙型肝炎患者为乙肝组,130 例健康人群为对照组。其中肝硬化组根 据ChildPugh 分 级[11]:A 级49 例,B 级47 例,C 级34 例;根据肝硬化程度分为:代偿期肝硬化49 例,失代偿期肝硬化48 例,原发性肝癌33 例。本研究经医院医学伦理委员会批准,患者家属签署知情同意书。
1.2 纳入与排除标准
纳入标准:①肝硬化组及乙肝组患者需符合中华医学会肝病学分会制定的《慢性乙型肝炎防治指南(2015 更新版)》相关诊断标准[12];②原发性肝癌患者需符合中华人民共和国卫生部制定的《原发性肝癌诊疗规范(2011年版)》相关标准[13];③纳入研究对象及其家属知情且同意。排除标准:①既往手术史者;②非乙型肝炎病毒因素所致肝硬化者;③合并严重其他疾病者;④精神状态异常或依从性差者。
1.3 观察指标
所有研究对象于入组次日清晨空腹抽取静脉血5 ml×3 管。一管采用AU 5800 全自动生化分析仪(美国贝克曼库尔特有限公司)检测丙氨酸氨基转移酶(ALT)、天门冬氨酸氨基转移酶(AST)、总胆红素(TBIL)水平;一管采用FACSCalibur 流式细胞仪(美国BD 公司)分离单核细胞并检测其表面TLR4 阳性率。一管以3 000 r/min 离心5 min,分离血清。采用microlab star 多功能酶标仪(瑞士Hamilton公司)进行酶联免疫吸附试验检测MyD88 和NF-κB水平。
1.4 统计学方法
数据分析采用SPSS 22.0 统计软件。计量资料以均数±标准差(±s)表示,比较用方差分析,组间进一步两两比较,若方差齐性,采用LSD-t检验,若方差不齐,采用Dunnett-t检验;相计数资料以构成比或率(%)表示,比较用χ2检验;相关分析用Pearson 法,绘制ROC 曲线,P<0.05 为差异有统计学意义。
2 结果
2.1 3组一般资料比较
肝硬化组、乙型肝炎组、对照组的性别、年龄比较,差异无统计学意义(P>0.05);3 组ALT、AST 及TBIL 水平比较,差异有统计学意义(P<0.05),肝硬化组和乙型肝炎组各指标水平均高于对照组(P<0.05);肝硬化组各指标水平均高于乙型肝炎组(P<0.05)。见表1。
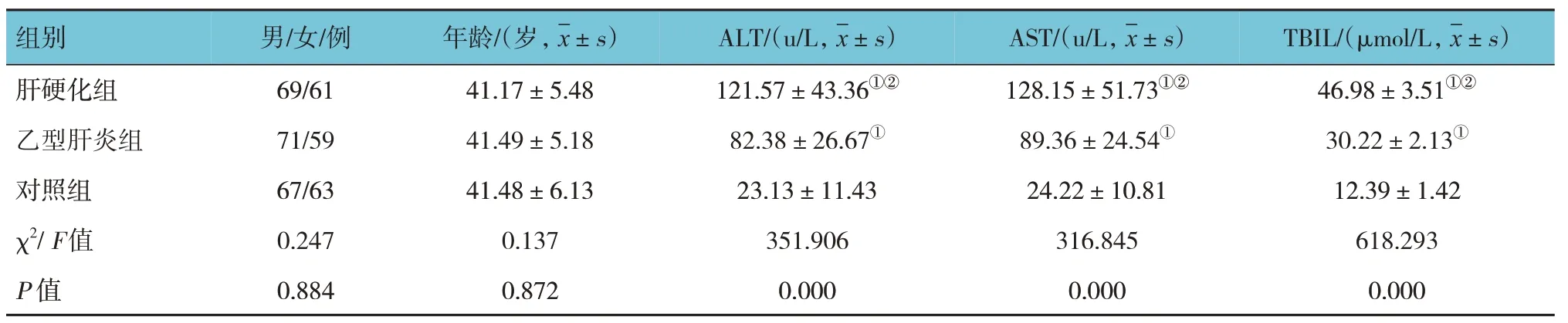
表1 3组一般资料比较 (n=130)
2.2 3组TLR4、MyD88、NF-κB水平比较
肝硬化组、乙型肝炎组、对照组TLR4、MyD88、NF-κB 水平比较,差异有统计学意义(P<0.05),肝硬化组和乙型肝炎组各指标水平均高于对照组(P<0.05);肝硬化组各指标水平均高于乙型肝炎组(P<0.05)。见表2。
表2 3组TLR4、MyD88、NF-κB水平比较(n=130,±s)
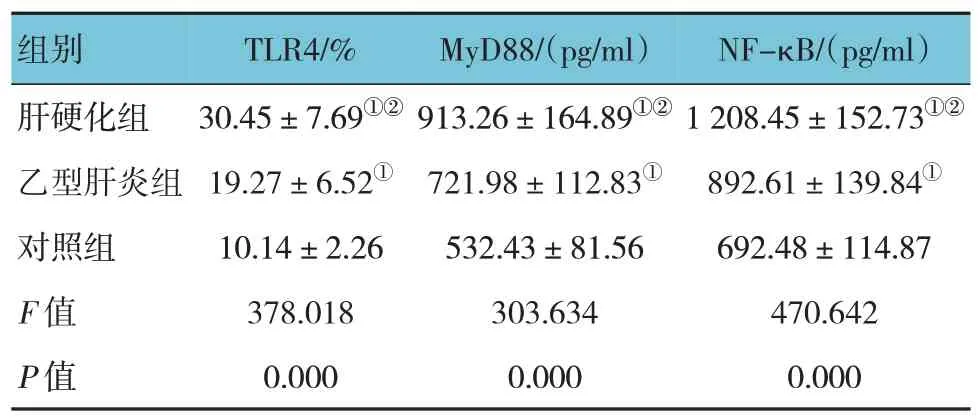
表2 3组TLR4、MyD88、NF-κB水平比较(n=130,±s)
注:①与对照组比较,P<0.05;②与乙肝组比较,P<0.05。
组别肝硬化组乙型肝炎组对照组F 值P 值TLR4/%30.45±7.69①②19.27±6.52①10.14±2.26 378.018 0.000 MyD88/(pg/ml)913.26±164.89①②721.98±112.83①532.43±81.56 303.634 0.000 NF-κB/(pg/ml)1 208.45±152.73①②892.61±139.84①692.48±114.87 470.642 0.000
2.3 不同级别ChildPugh 肝硬化患者TLR4、MyD88、NF-κB水平比较
ChildPugh A 级、ChildPugh B 级和ChildPugh C 级患者TLR4、MyD88、NF-κB 水平的比较,差异均有统计学意义(P<0.05),ChildPugh C 级患者各指标水平均高于ChildPugh B 级患者(P<0.05),ChildPugh B级患者各指标水平均高于ChildPugh A 级患者。见表3。
表3 不同级别ChildPugh肝硬化患者TLR4、MyD88、NF-κB水平比较 (±s)
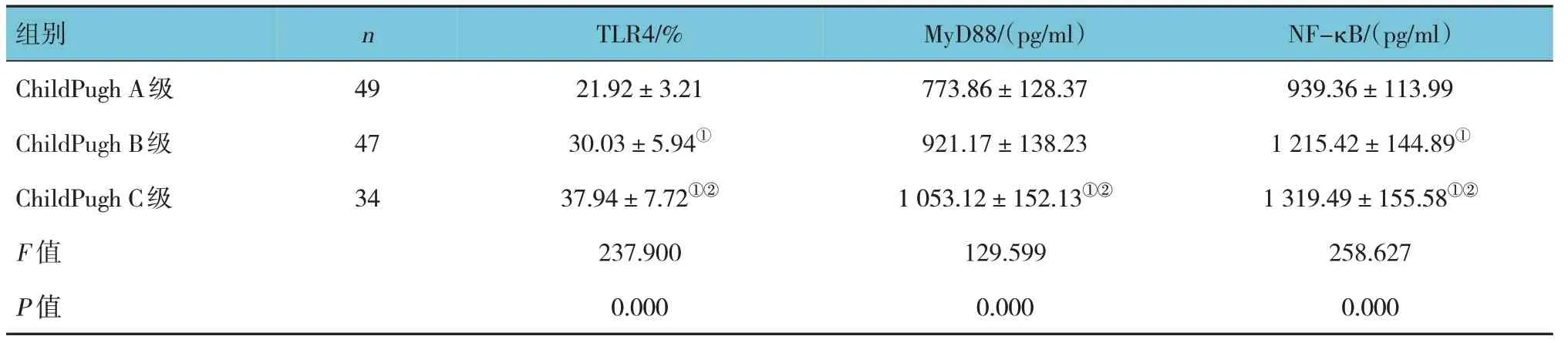
表3 不同级别ChildPugh肝硬化患者TLR4、MyD88、NF-κB水平比较 (±s)
注:①与ChildPugh A级比较,P<0.05;②与ChildPugh B级比较,P<0.05。
组别ChildPugh A级ChildPugh B级ChildPugh C级F 值P 值n 49 47 34 TLR4/%21.92±3.21 30.03±5.94①37.94±7.72①②237.900 0.000 MyD88/(pg/ml)773.86±128.37 921.17±138.23 1 053.12±152.13①②129.599 0.000 NF-κB/(pg/ml)939.36±113.99 1 215.42±144.89①1 319.49±155.58①②258.627 0.000
2.4 不同程度肝硬化患者TLR4、MyD88、NF-κB水平比较
代偿期、失代偿期和原发性肝癌患者TLR4、MyD88 及NF-κB 水平比较,差异均有统计学意义(P<0.05),原发性肝癌患者各指标水平高于失代偿期患者(P<0.05),失代偿期患者各指标水平高于代偿期患者。见表4。
表4 不同程度肝硬化患者TLR4、MyD88、NF-κB水平比较 (±s)
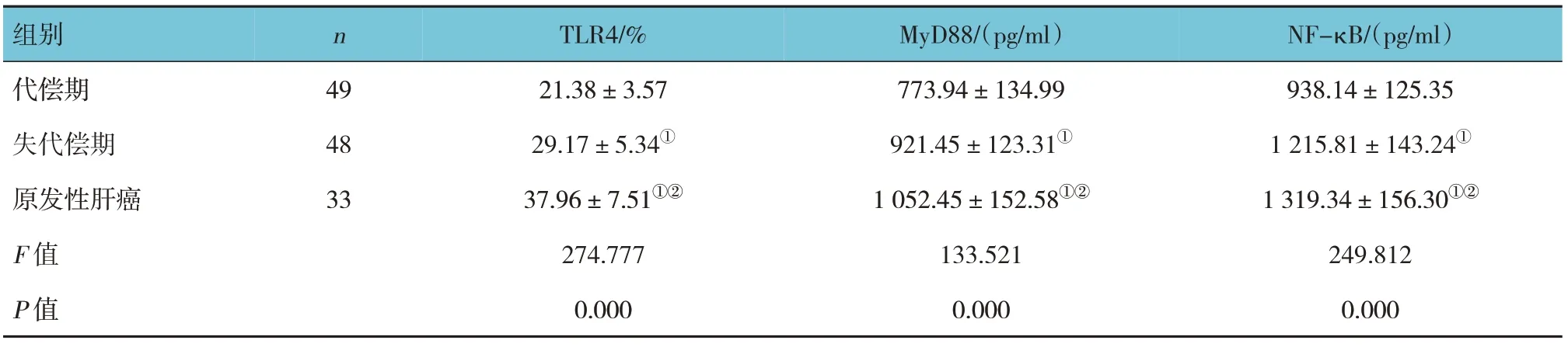
表4 不同程度肝硬化患者TLR4、MyD88、NF-κB水平比较 (±s)
注:①与代偿期比较,P<0.05;②与失代偿期比较,P<0.05。
组别代偿期失代偿期原发性肝癌F 值P 值n 49 48 33 TLR4/%21.38±3.57 29.17±5.34①37.96±7.51①②274.777 0.000 MyD88/(pg/ml)773.94±134.99 921.45±123.31①1 052.45±152.58①②133.521 0.000 NF-κB/(pg/ml)938.14±125.35 1 215.81±143.24①1 319.34±156.30①②249.812 0.000
2.5 肝硬化患者TLR4、MyD88、NF-κB 与Child Pugh分级、AST、ALT、及TBIL的相关性
相关性分析结果显示,TLR4、MyD88、NF-κB与Child Pugh 分级、ALT、AST 及TBIL 均呈正相关(P<0.05)。见表5。
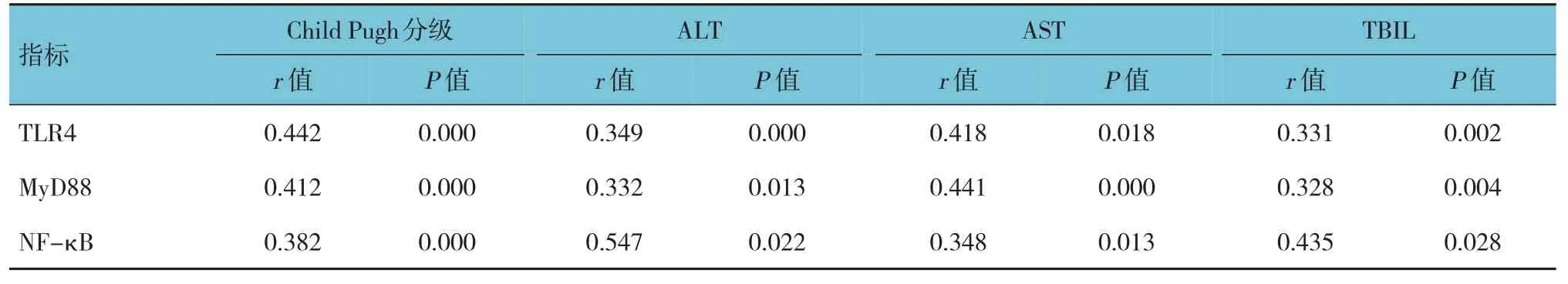
表5 肝硬化患者TLR4、MyD88、NF-κB与Child Pugh分级、AST、ALT及TBIL的相关性
2.6 血清各指标预测肝硬化致原发性肝癌的ROC曲线结果
绘制ROC 曲线,结果显示,当ALT 截断值为101.44 u/L时,AUC为0.738;AST截断值为136.74 u/L时,AUC 为0.706;TBIL 截断值为51.86 μmol/L 时,AUC 为0.746;TLR4 截断值为32.342%时,AUC 为0.896;MyD88截断值为931.402 pg/ml 时,AUC 为0.897;NF-κB 截断值为1 243.620 pg/ml 时,AUC 为0.875。见图1和表6。
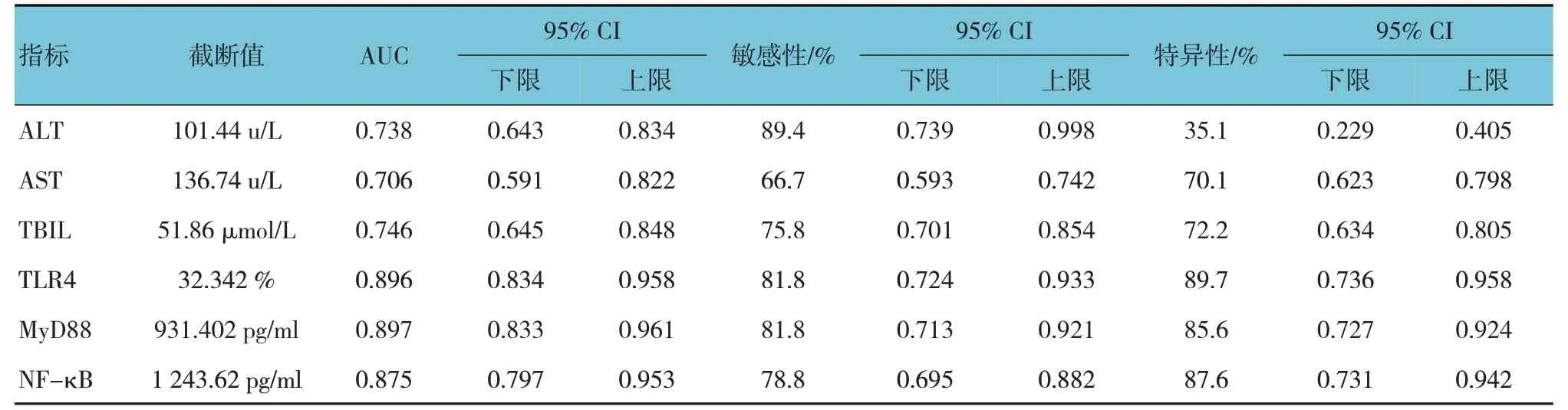
表6 血清各指标预测肝硬化转原发性肝癌的ROC曲线结果
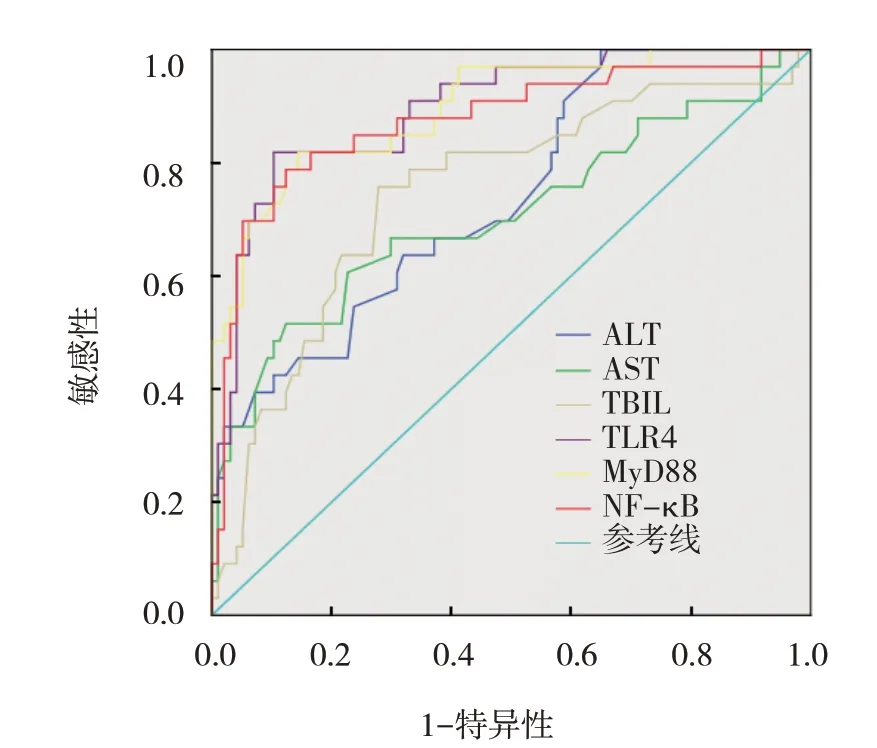
图1 血清各指标预测肝硬化致原发性肝癌的ROC曲线
3 讨论
近年来,随着社会发展,乙型肝炎病毒感染已呈全球流行趋势,且在我国为主要感染性疾病之一。由于乙型肝炎病毒可在患者体内长期复制,导致机体处于“循环坏死和再生修复”的恶性循环中,进而促使肝细胞的纤维化,最终发展为肝硬化,而处于此阶段的患者若未得到及时发现及治疗,肝细胞纤维化过程将进一步发展,并重复坏死和修复过程,导致患者发展为失代偿期肝硬化甚至原发性肝癌,而这一过程往往是不可逆的[14-16]。因此如何有效预防和阻止乙型肝炎病毒感染患者发展为肝硬化是医学工作者的关注重点。
研究发现,当机体受到病原体感染时,天然免疫系统可通过特殊的识别系统杀伤或杀死病原体,因此这一过程被认为机体的“第一道防线”。已有研究证实,Toll 样受体在天然免疫系统识别并杀死病原体过程中发挥重要作用[17-18]。Toll 样受体是一类天然免疫受体,并可对不同病原相关分子模式(PAMPs)进行识别、结合,从而进行信号转导,促进炎症介质的释放。Toll 样受体广泛存在于机体的多种免疫细胞(B 淋巴细胞、单核细胞、T 淋巴细胞、NK 细胞等)或组织(外周血白细胞、脾脏等)中,并与多种免疫系统疾病、炎症疾病或感染性疾病密切相关[19-20]。
TLR4 为Toll 样受体家族中的一员,其可识别多种PAMPs 从而发挥其免疫作用。肝硬化的发生发展育乙型肝炎病毒等病原体的感染密切相关,乙型肝炎病毒感染肝脏细胞后,会以PAMPs 的形式被识别。研究发现,TLR4、MyD88、NF-κB 信号通路在乙型肝炎病毒相关肝脏疾病中具有重要意义[21]。TLR4 通过介导MyD88 从而参与肝脏病理反应,患者机体中的损伤因子和脂多糖可促发TLR4信号,进而激活其下游信号MyD88,从而促进肝组织炎症因子、趋化因子的释放。MyD88 不仅是TLR4 的转接蛋白,也是NF-κB 的连接蛋白,当炎症信号通过TLR4 传递给MyD88 后,MyD88 促使IRAK4 的磷酸化,而磷酸化的IRAK4 进一步作用于TAB-1/TAB-2,促使TAK-1 的激活,活化的TAK-1作用于NF-κB,导致IκB 激酶的活化,IκB 激酶则促进IκB 磷酸化的激活,进而导致炎症细胞因子的释放,而释放的炎症因子又可促进NF-κB 的激活,从而形成恶性循环,导致肝细胞的持续受损[22]。本研究结果显示,相较于正常人群,肝硬化和乙型肝炎患者TLR4、MyD88、NF-κB 水平均呈过表达,且肝硬化各指标水平更高。研究进一步比较了肝硬化患者不同ChildPugh 分级或病情严重程度中TLR4、MyD88、NF-κB 的表达情况,结果显示,随着ChildPugh 分级的增加或病情的加重,患者TLR4、MyD88、NF-κB 水平均有所上升,且TLR4、MyD88、NF-κB 水平与ChildPugh 分级、ALT、AST及TBIL 均呈正相关,提示TLR4、MyD88、NF-κB信号通路与乙型肝炎病毒所致肝炎及肝硬化病理进程密切相关。
肝脏活检来对病情进行诊断和分期为目前临床检验的金标准[23]。但该技术也存在一定不足:一方面,患者取样区域往往受到病理医生的主观影响,这将导致检验结果可能存在偏差;另一方面,活检往往难以长期监测或评估慢性患者的病情及病程,因此无法为患者提供动态资料[24]。因此,近年来,通过生物标志物的检测来对肝硬化患者的诊断及评估预后已成为临床关注重点。本研究也探讨了上述指标在诊断肝硬化转原发性肝癌的临床价值。结果显示,ALT、AST 及TBIL 诊断肝硬化转肝癌中临床价值一般,而TLR4、MyD88、NF-κB在诊断肝硬化转肝癌中均具有一定临床价值(AUC>0.700),这也提示可将其作为评估预后的指标之一。
综上所述,TLR4、MyD88、NF-κB 信号通路与乙型肝炎病毒所致肝炎及肝硬化病理进程密切相关,且TLR4、MyD88、NF-κB 的检测在诊断肝硬化转原发性肝癌中具有一定临床价值。但本研究也存在样本量较小、未动态观察各指标变化情况等不足,因此仍需后续研究加以证实。
