MicroRNA-219a-5p和AFAP1L2对胰腺癌细胞的作用研究*
2021-12-04刘博戚诚赵爽常晓静赵晓东张立超刘学臣刘斌
刘博,戚诚,赵爽,常晓静,赵晓东,张立超,刘学臣,刘斌
(1.河北医科大学第二医院 普外四科,河北 石家庄050052;2.河北医科大学第三医院麻醉科,河北 石家庄050051;3.河北医科大学第二医院 放疗科,河北 石家庄050052;4.河北医科大学第二医院 普外九科,河北 石家庄050052;5.河北医科大学第二医院消化内科,河北 石家庄050052;6.河北大学附属医院 科研处,河北 保定071030)
胰腺癌在消化系统恶性肿瘤中预后是最差的,生存期短,5年生存率< 5%[1]。尽管放疗、化疗、靶向、手术等多模式治疗有所进展,近10年胰腺癌的5年生存率仍无明显提高,胰腺癌细胞的恶性增殖、过早发生转移及浸润是其生存期不能提高的主要原因之一[2-3]。转移性结直肠癌、肺癌、食管癌等伴随着靶向治疗的发展,5年生存率均得到一定程度的提高,而胰腺癌生存期却没有明显改善[4]。对胰腺癌早期筛查指标的探索,对进展期胰腺癌治疗靶点的发现,仍然是提高胰腺癌存活率的主要研究方向[5]。肌动蛋白丝相关蛋白1 相似蛋白2(AFAP1L2)是接头蛋白的一种,在恶性肿瘤(胃癌、食管癌、肺癌等)中高表达。本研究前期实验发现,AFAP1L2 与胰腺癌的转移、侵袭等恶性行为具有相关性,在胰腺癌中是促癌基因[6],对胰腺癌细胞侵袭及转移具有促进作用[7]。miRNA 是一种内源性小非编码RNA,在转录后参与细胞增殖、分化、生长等生物学行为,大部分负向调控下游基因[8]。胰腺癌miR-219 对胰腺癌细胞的恶性行为具有负向调控作用,但其机制并不清楚。本研究前期通过生物信息学预测显示,microRNA-219a-5p(miR-219a-5p)与AFAP1L2 3'-UTR 具有碱基互补配对,两者可能具有靶向调控关系。本研究检测miR-219a-5p 与AFAP1L2 3'-UTR 在胰腺癌细胞株中的表达,并观察两者对胰腺癌细胞增殖的作用,对两者可能具有的靶向调控关系进行验证,为胰腺癌预测基因的发现及治疗靶点的预测提供离体实验依据。
1 材料与方法
1.1 材料
正常胰腺导管上皮细胞(HPDE)及人胰腺癌细胞株(PANC-1、BXPC-3、SW1990、Capan-1)由中国科学院上海细胞库提供,由河北医科大学第二医院中心实验室培养及传代。AFAP1L2 山羊多克隆抗体及流式细胞周期和凋亡检测试剂盒购自美国Santa Cruz 公司。BCA 定量试剂盒、ECL 发光试剂盒、DAB 显色试剂盒、CCK-8 检测试剂盒购自大连宝生生物技术有限公司。miR-219a-5p mimics(拟似剂)及miR-219a-5p inhibitor(抑制剂)购自日本TakaRa 公司。逆转录及扩增试剂盒、miRNA 提取分离试剂盒、Lipofectamine 2000 及RPIM 1640 购自美国Sigma 公司。AFAP1L2 过表达质粒(pCMVEGFP-AFAP1L2 质粒)、空载EGFP-质粒、引物、野生型引物(wt)及突变型(mut)萤光素酶报告载体由北京生工生物工程有限公司设计合成。AFAP1L2 正向引物:5'-CCGGACGTAACGACGCATCCG-3',反向引物:5'-GCCCAGTTCGUUGUGCCACG-3';miR-219a-5p正向引物:5'-GTTCTTGACAATTAAGACCC-3′,反向引物:5'-CATGATAAGTTCTGCGCTC-3';β-actin 正向引 物:5'-GCCGATCCGTAACGCTACGGCGC-3',反 向引物:5'-CCGGACGTTCGACGGCTCCG-3'。
1.2 研究方法
1.2.1 实时荧光定量聚合酶链反应(qRT-PCR)检测mRNA 表达对各组细胞进行裂解,收集后依照Trizol 操作说明书提取RNA,合成cDNA,对RNA纯度和完整性进行检测。进行microRNA 逆转录,在70℃温浴10 min 后立即给予冰浴,对逆转录引物及模板退火;PCR 反应体系的配置如下:qRT-PCR Master Mix 7.5 ml,2份SYBR Green,引物混合物0.6 ml,H2O 15 ml,cDNA 模板2 ml。进行循环,延伸反应条件如下:95℃温浴2 min,94℃温浴10 s,55℃温浴15 s,72℃温浴10 s,循环45 次;再次95℃温浴1 min,60℃温浴30 s,95℃温浴30 s。扩增曲线以2-ΔΔCt法进行分析,实验3次取平均值进行统计分析。
1.2.2 Western blotting 法检测蛋白表达各组细胞用PBS 洗涤3 次,收集后离心,弃去上清液,对裂解后的各细胞株总蛋白进行抽提,常规BCA 法对蛋白浓度进行定量,然后对蛋白样本上样,120 V条件下以12%十二烷基磺酸钠-聚丙烯酰胺进行电泳分离,20 min 后改为90 V 分离90 min,转于PVDF膜,TBST 缓冲液(含5%脱脂奶粉)封闭1.5 h。加Ⅰ抗室温孵育过夜,TBST 3 次洗膜加Ⅱ抗,37℃孵育1 h,凝胶显像仪显像(化学发光法)。β-actin 为内参,Quantity One 计量灰度值。
1.2.3 转染胰腺癌细胞步骤收集对数生长期胰腺癌细胞进行消化,使其成为单细胞悬液,24 孔板内按20×104个细胞/孔进行接种,对融合度>70%胰腺癌细胞株以Lipofectamine 2000 操作说明书要求进行转染,用含10%胎牛血清细胞培养基对转染完成的细胞进行培养,48 h时后评价转染效率,继续完成下一步实验。
1.2.4 CCK-8 法检测细胞增殖收集空白对照组(NC 组)、pCMV-EGFP-AFAP1L2 组、siAFAP1L2 组对数生长期细胞,将浓度调至1×105个/ml,100 μl 细胞悬液/孔加入96 孔板,12 h 培养于孵育箱(条件:湿度5%,温度37℃)。48 h 温浴后加10 μl 的CCK-8液,继续培养4 h,在酶标仪490 nm 波长处检测光密度(OD)值,每孔进行3 次试验,取平均值进行统计分析。
1.2.5 流式细胞术检测胰腺癌细胞周期取胰腺癌细胞,转至EP管,PBS 1 ml进行洗涤,然后加1 ml 70%的乙醇,以上均需预冷条件操作,于4℃进行24 h固定,1 200 r/min 离心4 min。弃上清,PBS 洗涤。然后用PBS 对各样本进行重悬,加入30 μl 0.5% PI、15 μl Rnase A(10 mg/ml),4℃下避光温浴40 min。流式细胞仪在波长488 nm 处行细胞周期检测。
1.2.6 流式细胞术检测细胞凋亡取各组胰腺癌细胞,按照Annexin V-FITC/PI 试剂盒说明书进行细胞凋亡检测,流式细胞仪设定条件:Alexa FITC 的最大发射波长509 nm,最大激发波长488 nm,PI-DNA复合物的最大激发波长535 nm,最大发射波长615 nm,采集细胞数10 000 个/样本,以Cell Quest 软件进行凋亡率分析。
1.2.7 萤光素酶法检测碱基互补配对miR-219a-5p与AFAP1L2 可能具有靶向调控关系,并确定核苷酸47~53 为3'-UTR 的结合位点,构建商业化wt-AFAP1L2-Pmir-REPORT 及 mut-AFAP1L2-Pmir-REPORT 荧光素酶报告载体,将构建的载体报告以X-treme Gene 与miR-219a-5p mimics 共转染到胰腺癌细胞,miR-219a-5p negative control(NC)组为对照。共转染后在培养箱内以37℃、5% CO2条件下孵育培养48 h,以双萤光素酶检测试剂盒对荧光素酶活性进行检测。 以wt/mut-AFAP1L2-Pmir-REPORT 与海肾荧光素酶表达载体活性比例为相对荧光素酶活性。
1.3 统计学方法
数据分析采用PASW Statistics 20.0 统计软件。计量资料以均数±标准差(±s)表示,比较用方差分析或t检验。P<0.05 为差异有统计学意义。
2 结果
2.1 miR-219a-5p、AFAP1L2 在胰腺癌细胞株及HPDE中R 表达
qRT-PCR 结果显示,在胰腺癌细胞株PANC-1、BXPC-3、SW1990、Capan-1 及HPDE 中miR-219a-5p mRNA 的相对表达量分别为(0.26±0.07)、(0.28±0.08)、(0.58±0.28)、(0.46±0.25)和(1.32±0.57),差异有统计学意义(F=11.462,P=0.000),在胰腺癌细胞株中表达较低。BXPC-3,SW1990 及Capan-1 分别与PANC-1 比较,差异无统计学意义(P>0.05);SW1990 及Capan-1 分别与BXPC-3 比较,差异无统计学意义(P>0.05);SW1990 与Capan-1 比较,差异无统计学意义(P>0.05)。见图1A。
qRT-PCR 及Western blotting 结果显示,在胰腺癌 细 胞 株PANC-1、BXPC-3、SW1990、Capan-1 及HPDE中AFAP1L2 mRNA相对表达量为(1.19±0.24)、(0.92±0.29)、(0.97±0.07)、(0.99±0.45)、(0.57±0.16),差异有统计学意义(F=10.931,P=0.000);AFAP1L2 蛋白相对表达量为(14.01±0.92)、(13.86±1.32)、(14.59±1.02)、(12.97±0.78)、(8.42±0.91),差异有统计学意义(F=9.401,P=0.000)。AFAP1L2 蛋白及mRNA 在胰腺癌细胞株和HPDE 细胞中表达比较,差异有统计学意义(P<0.05),胰腺癌细胞株中表达较高(P<0.05);BXPC-3,SW1990 及Capan-1 分别与PANC-1 比较,差异无统计学意义(P>0.05);SW1990 及Capan-1 分 别 与BXPC-3 比较,差异无统计学意义(P>0.05);SW1990 与Capan-1 比较,差异无统计学意义(P>0.05)。见图1B、C。
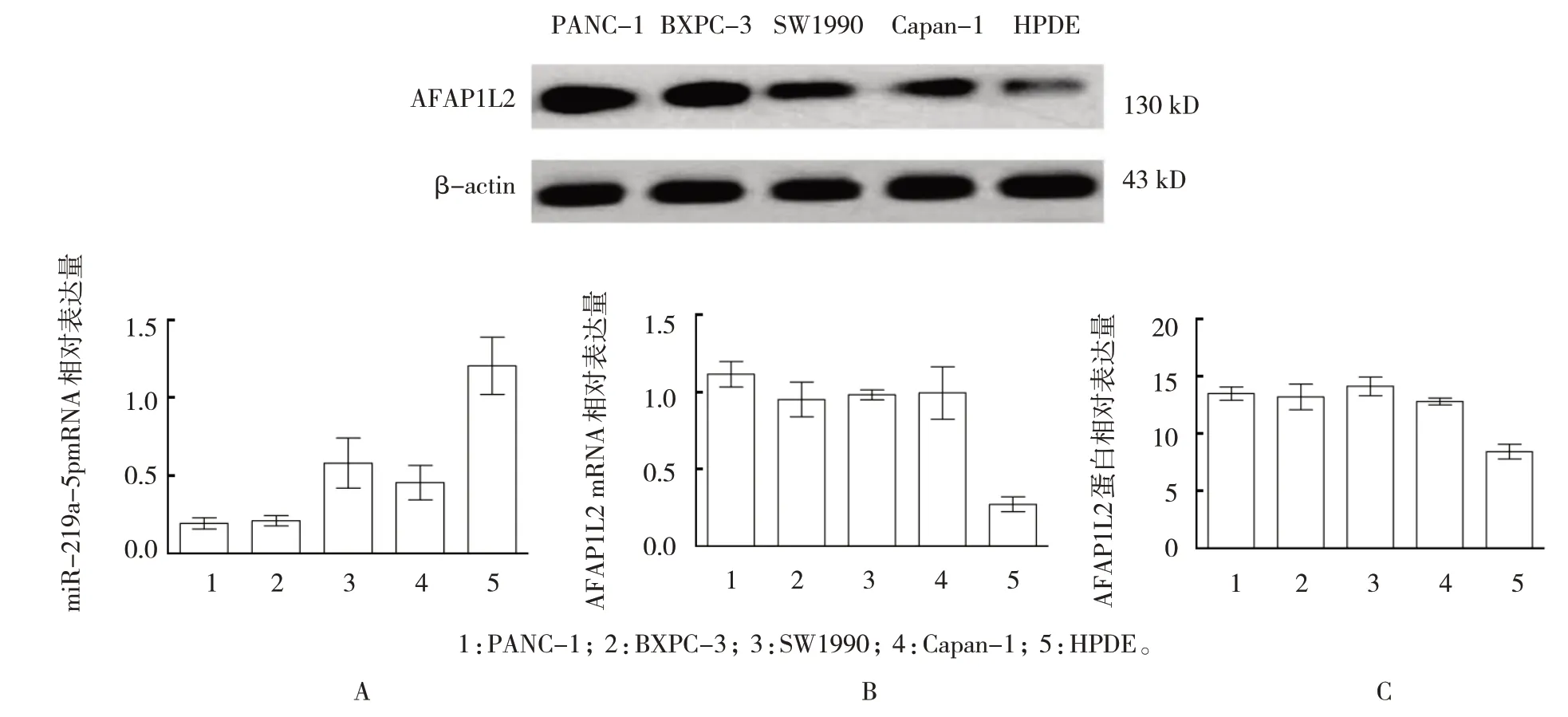
图1 miR-219a-5p、AFAP1L2在胰腺癌细胞株与HPDE中的表达
2.2 AFAP1L2表达影响胰腺癌细胞增殖
CCK-8 法结果显示,Capan-1 细胞培养48 h,空白 对 照 组(NC 组)、pCMV-EGFP-AFAP1L2 组、siAFAP1L2 组OD 值分别为(0.387±0.007)、(0.749±0.302)和(0.146±0.081),差异有统计学意义(F=4.724,P=0.007)。pCMV-EGFP-AFAP1L2 组OD 值高于NC 组和siAFAP1L2 组(P<0.05),NC 组OD 值高于siAFAP1L2 组(P<0.05)。见图2A。
SW1990 细胞培养48 h,NC 组、pCMV-EGFPAFAP1L2 组、siAFAP1L2 组OD 值分别为(0.410±0.082)、(0.673±0.128)和(0.213±0.103),差异有统计学意义(F=7.159,P=0.000)。pCMV-EGFP-AFAP1L2组OD 值高于NC 组和siAFAP1L2 组(P<0.05),NC 组OD值高于siAFAP1L2组(P<0.05)。见图2B。
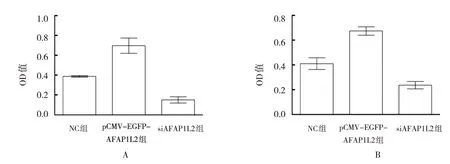
图2 AFAP1L2对Capan-1及SW1990细胞增殖的影响
2.3 miR-219a-5p影响胰腺癌细胞增殖
CCK-8 法结果显示,Capan-1细胞培养48 h,miR-NC 组、miR-219a-5p mimics 组、miR-219a-5p inhibitor 组OD 值分别为(0.272±0.031)、(0.105±0.022)和(0.569±0.068),差异有统计学意义(F=4.017,P=0.009)。miR-219a-5p mimics 组OD 值低于miR-NC 组,miR-219a-5p inhibitor 组高于miR-NC 组(P<0.05)。见图3A。
SW1990 细胞培养48 h,miR-NC 组、miR-219a-5p mimics 组、miR-219a-5p inhibitor 组OD值分别为(0.405±0.035)、(0.255±0.062)和(0.667±0.074),差异有统计学意义(F=3.363,P=0.012)。miR-219a-5p mimics 组OD 值低于miR-NC 组,miR-219a-5pinhibitor组OD 值高于miR-NC 组。见图3B。
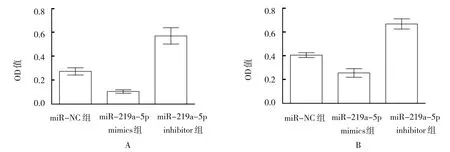
图3 miR-219a-5p对Capan-1及SW1990细胞增殖的影响
2.4 各组细胞周期比较
流式细胞术检测细胞周期结果显示,miR-NC组、miR-219a-5p mimics 组、miR-219a-5p inhibitor 组在G1 期、G2 期及S 期的比例比较,差异有统计学意义(P<0.05)。miR-219a-5p mimics 组在G1 期、G2 期及S期的比例分别与miR-NC组比较,差异有统计学意义(P<0.05),miR-219a-5p mimics 组G1 期、G2期比例较miR-NC组减少,S 期比例较miR-NC组升高。miR-219a-5p inhibitor 组在G1 期及G2 期比例较miR-219a-5p mimics 组升高,在S 期比例降低。见表1。
表1 各组细胞周期比较 (%,±s)
注:①与miR-NC 组比较,P<0.05;②与miR-219a-5p inhibitor组,P<0.05。
组别miR-NC组miR-219a-5p mimics组miR-219a-5p inhibitor组F 值P 值G1期80.15±0.94 68.75±1.35①②83.29±0.82 3.340 0.005 G2期9.57±1.29 4.93±1.48①②8.58±0.97 2.920 0.007 S期11.52±1.76 29.28±1.79①②9.47±0.89 11.530 0.001
2.5 各组细胞凋亡率比较
细胞凋亡结果显示,miR-NC 组、miR-219a-5p mimics 组、miR-219a-5p inhibitor组凋亡率分别为(31.02±4.87)%、(16.52±3.19)%、(52.75±6.92)%,3 组比较,差异有统计学意义(F=3.972,P=0.016)。miR-219a-5p mimics 组凋亡率低于miR-NC 组(P<0.05),miR-219a-5p inhibitor 组凋亡率高于miR-NC组(P<0.05)。miR-219a-5p mimics 组凋亡率低于miR-219a-5p inhibitor 组(P<0.05)。
2.6 miR-219a-5p与AFAP1L2 3'-UTR具有碱基互补配对
通过生物信息学软件进行预测分析,确定miR-219a-5p 与AFAP1L2 可能具有靶向调控关系,并确定核苷酸47~53 为3'-UTR 的结合位点。见图4。
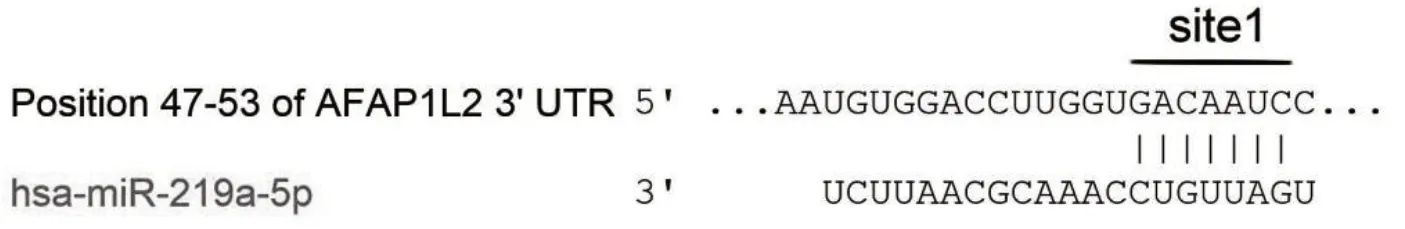
图4 miR-219a-5p与AFAP1L2 3'-UTR碱基互补配对
2.7 miR-219a-5p对AFAP1L2具有调控作用
miR-219a-5p mimics 转 染Capan-1 细胞,与miR-NC 组比较,miR-219a-5p mimics 组AFAP1L2 mRNA 及蛋白表达均下降(P<0.05)(见图5B、图6)。给予iR-219a-5p inhibitor 转染Capan-1 细胞,与miR-NC组比较,miR-219a-5p inhibitor 组AFAP1L2 mRNA 及蛋白表达均上升(P<0.05)(见图7B、图8)。表明miR-219a-5p负向调控AFAP1L2表达。
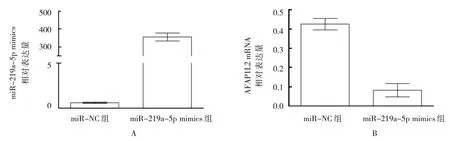
图5 miR-219a-5p mimics转染对AFAP1L2 mRNA表达的影响
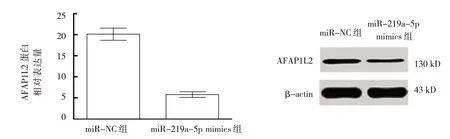
图6 miR-219a-5p mimics转染Capan-1细胞对AFAP1L2蛋白的影响
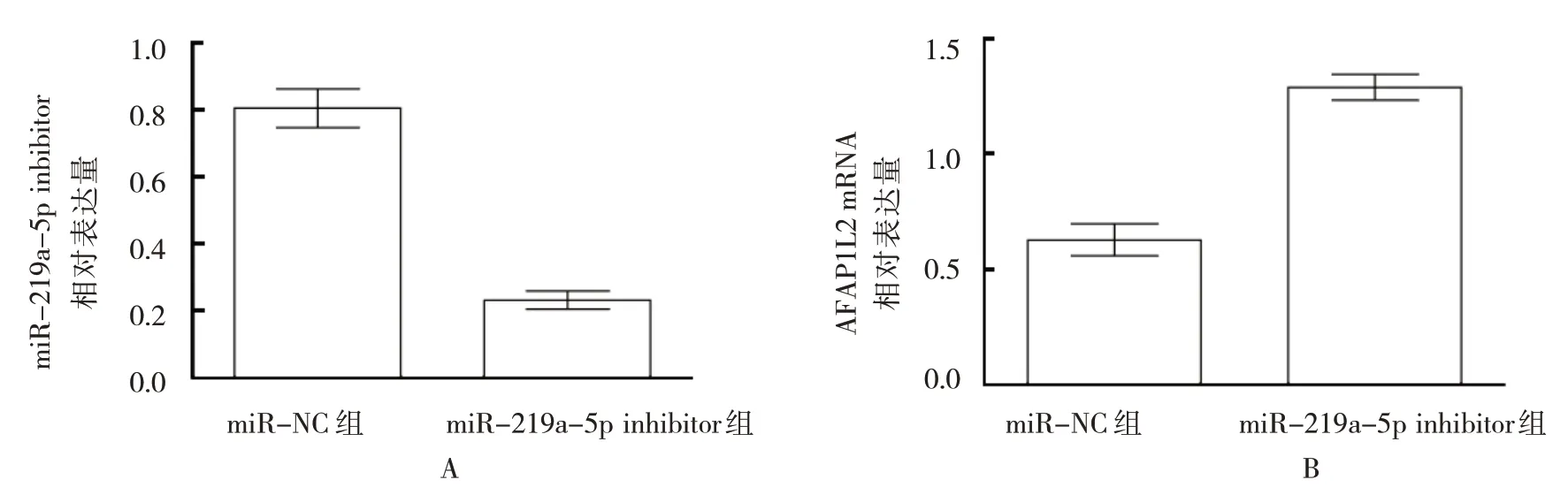
图7 miR-219a-5p inhibitor与AFAP1L2 mRNA相对表达量比较
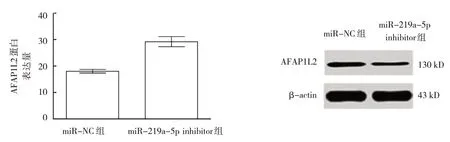
图8 miR-219a-5p inhibitor转染Capan-1细胞对AFAP1L2蛋白表达的影响
2.8 miR-219a-5p与AFAP1L2碱基互补配对
构 建 wt-AFAP1L2-pMIR-REPORT 及 mut-AFAP1L2-pMIR-REPORT 荧光报告载体,将野生型与突变型AFAP1L2 萤光报告载体与miR-219a-5p mimics 共转染到Capan-1 细胞,萤光素酶活性检测结果显示,AFAP1L2 野生组miR-NC 及miR-219a-5p mimics 荧光素酶活性分别为(0.69±0.09)和(0.24±0.03),差异有统计学意义(P<0.05),转染wt-AFAP1L2-pMIR-REPORT 的3'-UTR 端荧光素酶活性下降;AFAP1L2 突变组miR-NC 及miR-219a-5p mimics 荧光素酶活性分别为(0.64±0.11)和(0.61±0.16),差异无统计学意义(P>0.05),转染mut-AFAP1L2-pMIR-REPORT 的3'-UTR 端荧光素酶活性无变化。见图9。
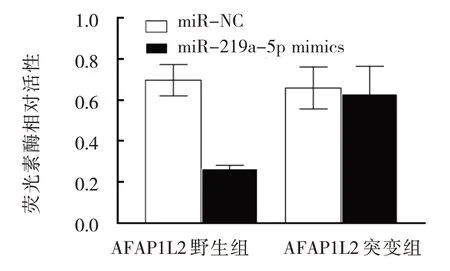
图9 萤光素酶活性比较
3 讨论
细胞增殖被一系列的检查点蛋白和细胞调控蛋白包括细胞周期蛋白和细胞周期依赖激酶(CDKS)保护和调控,细胞增殖调控通路的失衡会导致癌变及癌症的发展[9-12]。miRNA 失调会通过靶向作用于细胞周期调节因子影响细胞周期,调控细胞生长速度,导致细胞周期停滞,并调控Caspase 水平,凋亡细胞增加,抑制细胞生长[12-13]。有研究显示,miR-219a-5p 通过靶向作用于MRTFa提控乳腺癌细胞的迁移和表皮间质化,在肝癌中,miR-219a-5p 通过靶向作用于GPC3 抑制肝癌细胞增殖[14-15]。肌动蛋白丝相关蛋白(AFAP)家族是包括AFAP 1、AFAP1L1 和AFAP1L2/XB 130 在内的适配器蛋白重要成员,AFAP1L2 肌动蛋白结合蛋白和CSRC 激活蛋白,AFAP1L2 可以促进肿瘤的发展。有研究表明,AFAP1L2 可以调节细胞的生长、迁移和侵袭,可能通过cAMP-CSRC-磷酸肌醇3 激酶/Akt 途径发挥作用[16-18]。在恶性肿瘤中,miRNA 可以对下游信号通路进行调控,从而介导恶性肿瘤细胞的增殖、细胞周期、凋亡及侵袭等恶性行为[19-21]。本研究在前期工作基础上通过生物信息学软件进行预测分析,miR-219a-5p 与AFAP1L2 可能具有靶向调控关系,并确定3'-UTR 的结合位点。
本研究首先检测胰腺癌细胞及HPDE 细胞中miR-219a-5p 和AFAP1L2 的表达,发现miR-219a-5p在胰腺癌细胞株中的表达低于HPDE 细胞,AFAP1L2 mRNA 及蛋白在胰腺癌细胞株中的表达高于HPDE 细胞。细胞增殖试验显示,AFAP1L2 对胰腺癌细胞增殖具有正向调控作用。miR-219a-5p 表达对胰腺癌细胞增殖具有负向调控作用,对AFAP1L2 及miR-219a-5p 表达水平的调控间接验证两者对胰腺癌细胞增殖具有相反作用。另有研究显示,miR-219a-5p 与肿瘤直径、组织学分化程度及肝癌患者总生存时间具有相关性,miR-219a-5p抑制肝癌细胞增殖,并促进其从G1 期向S 期转化[15]。本研究也显示,在胰腺癌细胞中上调miR-219a-5p表达,可诱导细胞S 期阻滞,导致细胞凋亡增加。本研究为进一步研究miR-219a-5p 及AFAP1L2 在胰腺癌细胞增殖调控中的机制,检测了miR-219a-5p表达上调或下调后AFAP1L2 mRNA 及蛋白水平的变化,结果显示,miR-219a-5p 负向调控AFAP1L2 表达,为进一步验证两者是否具有直接的调控关系,进行萤光素酶活性检测试验,结果显示miR-219a-5p与AFAP1L2 的3'-URT互补结合,miR-219a-5p 与AFAP1L2 存在直接的靶向调控关系。本研究对miR-219a-5p 及AFAP1L2 在胰腺癌细胞增殖调控中机制的研究结果显示,miR-219a-5p 通过调控AFAP1L2 表达负向介导胰腺癌细胞增殖。HUANG等[15]对83 例肝癌组织中miR-219a-5p 表达进行检测,结果显示,miR-219a-5p 高表达的患者肿瘤体积小,组织分化程度高,患者总生存率长,并通过负向调控GPC3 表达抑制肝癌细胞增殖。LAHDAOUI 等[22]研究显示,miR-219 的3'-UTR 与MUC4 互补结合,具有靶向调控关系,通过对MUC4 的直接调控,激活Akt 及Erk 信号通路,影响胰腺癌细胞迁移及增殖,是抑癌基因。ZHAO 等[23]观察AFAP1 RNA 对胃癌的预测价值,结果显示,AFAP-RNA 与胃癌生存期呈负相关,对胃癌细胞增殖具有促进作用。WANG 等[24]认为,在肺癌中,AFAP1L1 下调会激活Caspase-3 和P38 表达,抑制PRAS 40 表达,对肺癌细胞增殖具有促进作用,加速细胞周期的进程,阻止细胞凋亡。目前在肿瘤研究中没有miR-219a-5p 对AFAP1L2 的调控作用研究。MÜLLER 等[25]对胰腺癌中多个miRNA 进行筛查,并对靶点进行观察及预测,进一步评价miRNA对胰腺癌诊断、预后预测及治疗靶点选择的意义。本研究结论为miR-219a-5p 通过靶向调控AFAP1L2表达负向介导胰腺癌细胞增殖及凋亡。随着研究的深入,miR-219a-5p 及AFAP1L2 可能成为未来胰腺癌诊断的肿瘤标志物及预测预后的靶基因。
