IgA肾病患者外周血中性粒细胞与淋巴细胞比值的临床意义*
2021-12-04高静歌翟亚玲姚星辰陈雅卓张惠雅王新念程根阳
高静歌,翟亚玲,姚星辰,陈雅卓,张惠雅,王新念,程根阳
[郑州大学第一附属医院(郑州大学肾脏病研究所)肾内科, 河南 郑州450052]
IgA 肾病(IgAN)是目前中国乃至全世界范围内发病率最高的原发性肾小球疾病[1-2],主要病理特征是免疫荧光显示IgA 或以IgA 为主的免疫复合物在肾小球系膜区的沉积,表现为系膜增生性病变[3-4]。30%~40% IgAN 患者会在发病后20~30年进入终末期肾病,需要接受肾脏替代治疗,给家庭及社会带来巨大的负担[4]。IgAN 的发病机制是复杂的,可能涉及几个不同的途径,其存在一个复杂的相互作用的网络,在这个网络中,感染可能起触发作用[5]。
中性粒细胞- 淋巴细胞比值(neutrophillymphocyte ratio, NLR)是近年来研究较多的反应机体免疫和慢性炎症状态的标志物,因其易于检测而备受关注。已在恶性肿瘤、慢性肾病、糖尿病肾病、肾癌、血液透析患者中得到广泛研究,被证实与病情进展及预后密切相关,同时被认为是鉴别诊断和预测疾病预后的有用指标[6-10]。但其在IgAN 中的研究较少。因此本研究的目的是探讨NLR 水平在IgAN 中的临床意义,从而为IgAN 的管理和治疗提供理论依据。
1 资料与方法
1.1 研究对象
选取2014年12月1日—2018年6月1日就诊于郑州大学第一附属医院肾内科并经肾活检确诊的原发性IgAN 患者397 例。其中,男性219 例,女性178 例;平均年龄34.24 岁;高血压175 例(44.1%),平均随访时间为(15.35±10.98)个月,NLR 的中位数为2.01。对于IgAN 患者,诊断是基于免疫荧光检测在肾小球系膜中有IgA 颗粒的沉积,以及通过超微结构检查在系膜中有电子致密物质的沉积[11]。纳入标准:①肾活检组织病理检查确诊为原发性IgAN;②肾脏穿刺活检时的估算肾小球滤过率(eGFR)>15 ml/(min·1.73 m2)。排除标准:①继发于过敏性紫癜、系统性红斑狼疮及慢性肝病等;②已使用糖皮质激素或其他免疫抑制剂;③肾活检标本光镜下肾小球数< 8。本研究经郑州大学第一附属医院医学伦理委员会批准(2019-KY-016)。
1.2 分组
1.2.1 IgAN患者分组以外周血NLR 水平的中位数2.01 为界,分为NLR 低水平组(< 2.01)198 例和NLR 高水平组(≥2.01)199 例。
1.2.2 以治疗效果分组根据IgAN 患者尿蛋白转归情况将其分为3 组。①完全缓解组:治疗3 个月后24 h 尿蛋白总量≤0.5 g/24 h 或T/Cr≤0.2 g;ALB≥35 g/L;血清肌酐(Scr)≤115 μmol/L;②部分缓解组:治疗3 个月后24 h 尿蛋白总量≤3.5 g/24 h,或较基线值下降≥50% (或T/Cr 较基线值下降≥50%);ALB≥30 g/L;Scr≤115 μmol/L,或上升不超过基线值的25%;③无效组:治疗3 个月后24 h 尿蛋白总量>3.5 g/24 h(或T/Cr 较基线值下降< 50%);ALB < 30 g/L;Scr > 115 μmol/L,或上升超过基线值的25%。
1.3 研究方法
1.3.1 临床资料收集收集患者人口学资料及实验室检查结果,主要包括性别构成、年龄、血压、中性粒细胞绝对值、淋巴细胞绝对值、Scr、血尿酸(UA)、血尿素氮(BUN)、白蛋白(Alb)、总胆固醇(TC)、甘油三酯(TG)、24 h 尿蛋白总量、血补体C3、血补体C4 等。
1.3.2 肾组织病理检查计算球性硬化小球、节段性硬化小球、纤维性新月体和细胞/细胞纤维性新月体的占比;判断血管损伤程度(0 表示未见明显病变;1 表示单纯血管管壁增厚;2 表示除血管管壁增厚,还合并其他病变,如纤维素样坏死、玻璃样病变等)。由一位初级肾脏病理医师独立使用新牛津分型(MESCT)进行病理评分,再由一位高级肾脏病理医师审核,意见不同者,以高级肾脏病理医师为准[11]。牛津分型M:系膜细胞增生(M0/M1);E:内皮细胞增生(E0/E1);S:节段性硬化或黏连(S0/S1);T:肾小管萎缩或肾间质纤维化(T0/T1/T2),T0:0%~25%出现肾小管萎缩或肾间质纤维化,T1:25%~50%出现肾小管萎缩或肾间质纤维化,T2:> 50%出现肾小管萎缩或肾间质纤维化;C:新月体病变(C0/C1/C2),C0:无新月体,C1:小球出现新月体,C2:≥25%小球出现新月体。
1.3.3 预后分析回顾性收集随访3 个月及以上患者的资料。复合终点事件的定义如下:以先发生者为准,进入终末期肾脏疾病[12]、或死亡、或开始肾脏替代治疗(血液透析,腹膜透析或肾移植);Scr较基线值翻倍;eGFR 较基线值降低50%以上。
1.4 统计学方法
数据分析采用SPSS 17.0 统计软件和GraphPad Prism 5.0 软件。计量资料以均数±标准差(±s)或中位数和四分位数[M(P25,P75)]表示,比较用t检验或秩和检验;计数资料以例(%)表示,比较用χ2检验;Kaplan-Meier 法绘制生存曲线,比较用Logrank χ2检验;影响因素的分析用单因素分析或多因素Cox 回归模型。P<0.05 为差异有统计学意义。
2 结果
2.1 NLR高水平组与NLR低水平组患者的临床指标比较
两组患者的BUN、Scr、尿酸(UA)及24 h 尿蛋白总量水平比较,经秩和检验,差异有统计学意义(P<0.05),NLR 高水平组的BUN、Scr、UA 及24 h 尿蛋白总量水平高于NLR 低水平组。两组患者合并高血压的比例比较,经χ2检验,差异有统计学意义(P<0.05),NLR 高水平组高于NLR 低水平组。两组患者的性别构成、年龄、Alb、TC、TG、补体C3 和补体C4 水平比较,差异均无统计学意义(P>0.05)。两组患者的随访时间比较,差异无统计学意义(P>0.05)。见表1。
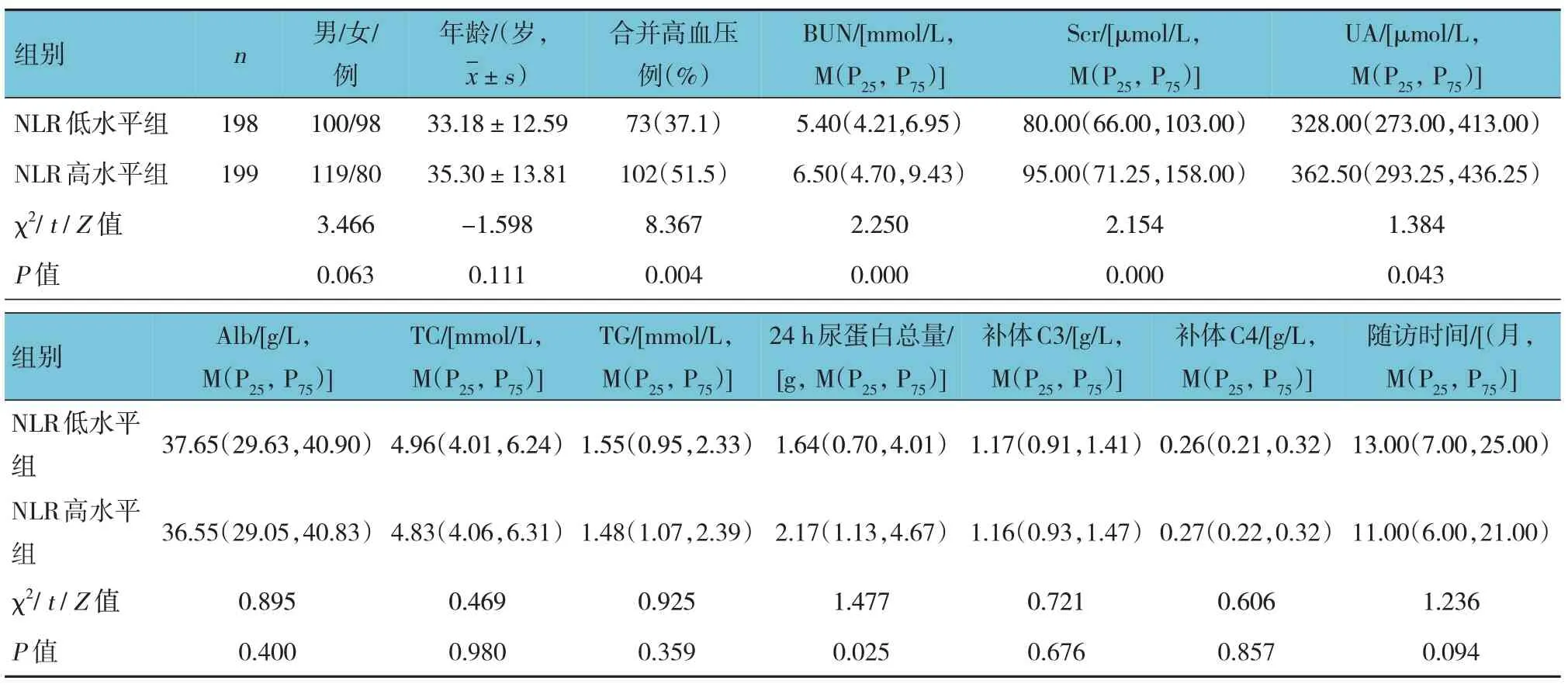
表1 不同NLR水平IgAN患者临床指标比较
2.2 NLR高水平组与NLR低水平组患者的病理特征比较
两组患者内皮细胞增生、肾小管出现萎缩或肾间质纤维化、肾间质小动脉损伤程度比较,经χ2检验,差异有统计学意义(P<0.05),NLR 高水平组高于NLR 低水平组。两组患者纤维性新月体占比比较,经秩和检验,差异有统计学意义(P<0.05),NLR 高水平组高于NLR 低水平组。见表2。
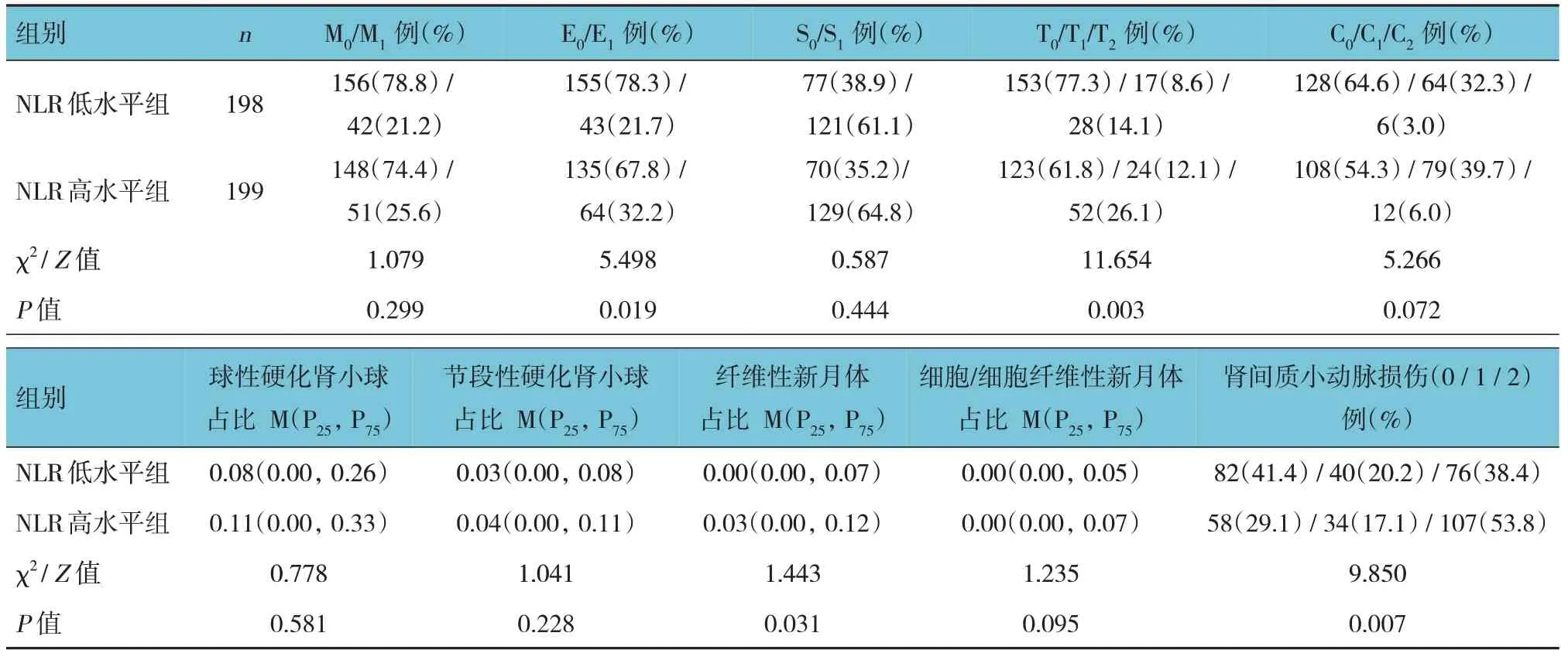
表2 不同NLR水平IgAN患者病理特征比较
2.3 NLR高水平组与NLR低水平组患者治疗效果的比较
NLR 高水平组与NLR 低水平组治疗效果比较,经χ2检验,差异有统计学意义(χ2=16.846,P=0.000),NLR高水平组的无效组构成和部分缓解组构成高于NLR 低水平组。见图1。
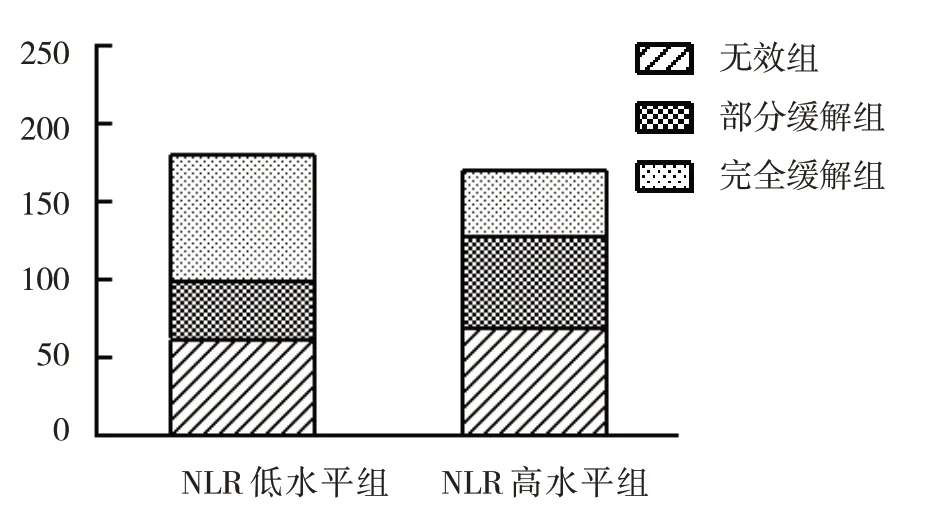
图1 不同NLR水平IgAN患者的疗效比较
2.4 NLR水平与IgAN患者预后的分析
NLR 高水平组与NLR 低水平组达到终点事件的比例比较,差异有统计学意义(χ2=9.365,P=0.002),NLR 高水平组达到终点事件的比例高于NLR 低水平组。Kaplan-Meier 生存分析表明:NLR高水平组肾脏总的生存率低于NLR 低水平组(χ2=11.923,P=0.001)(见图2)。Cox 比例风险模型显示NLR 高水平组患者发生终点事件的风险是NLR 低水平组的1.201 倍(95% CI:1.124,1.283,P<0.05);在模型1 基础校正年龄、性别后,NLR 高水平组患者发生终点事件的风险是NLR 低水平组的1.202 倍(95% CI:1.124,1.286,P<0.05);在模型2 基础上校正血压、血肌酐及尿蛋白后,NLR 高水平组患者发生终点事件的风险是NLR 低水平组的1.164 倍(95% CI:1.026,1.320,P<0.05);在模型3 的基础上校正系膜细胞增生、内皮细胞增生、节段性硬化或黏连、肾小管萎缩或肾间质纤维化、新月体后的结果显示:NLR 不是影响IgAN 患者预后的独立危险因素(95% CI:0.964,1.280,P=0.146)。见表3。
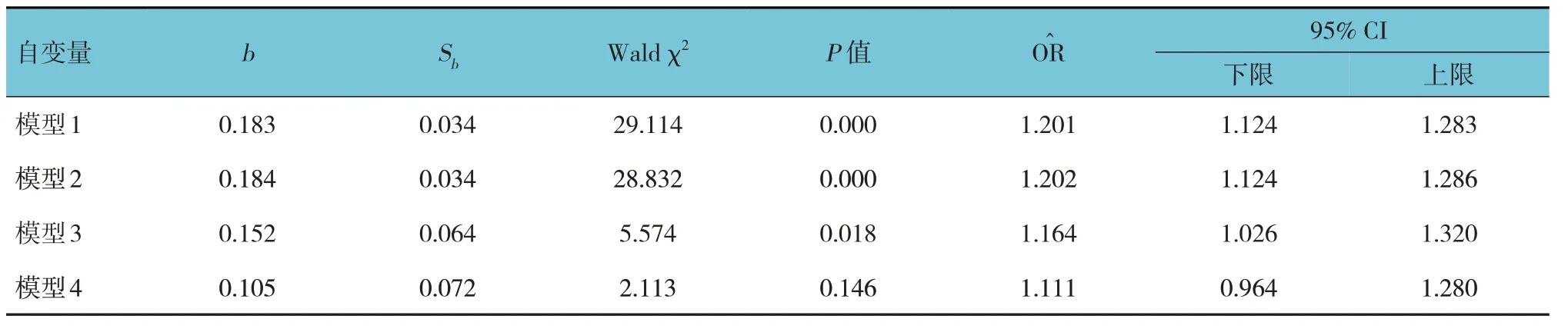
表3 NLR对IgAN患者预后影响的Cox回归分析参数
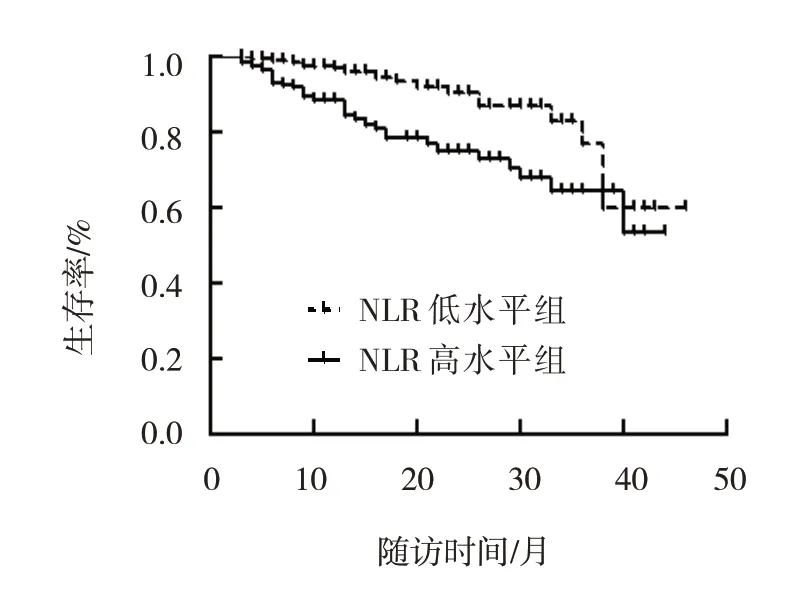
图2 肾脏存活率的Kaplan-Meier生存曲线
3 讨论
中性粒细胞是宿主防御的重要介质,可产生许多炎症介质和细胞因子,并连接自身免疫性疾病的先天和适应性免疫反应,在急性炎症之后持续存在,从而引发和延续慢性炎症[13]。而淋巴细胞作为免疫细胞,参与机体主要的免疫活动。其亚群及数量的变化会引起机体免疫功能的紊乱,继而发生一系列的病理变化。NLR 同时整合了中性粒细胞及淋巴细胞两种不同的白细胞亚型,代表炎症反应的激活与机体应激反应途径之间的平衡。NLR 已与其他炎症标志物联合应用于自身和非自身免疫性疾病的炎症检测[8-9,13-15],以前的研究表明其是一个很好的炎症指标[9,14-15]。系统性红斑狼疮(SLE)患者的NLR 水平高于正常对照组[14],并且可以反映SLE患者的炎症反应和疾病活动。NLR 异常也与糖尿病肾病、慢性肾脏病、ANCA 相关性血管炎等疾病的发生发展有关[6-7,9,16]。本研究发现,在IgAN患者中,NLR 高水平组的BUN、Scr、UA 和24 h 尿蛋白总量高于NLR 低水平组,NLR 与IgAN 疾病严重程度相关,这与以前在其他疾病中的结果相似。
目前已经认识到遗传、表观遗传和环境因素之间的相互作用可能有助于疾病的发展。根据“多击发病模型”[17-18],含有IgA 1 的免疫复合物一旦被沉积,就会刺激系膜增殖和局部产生细胞因子,如IL-6 和TGF-β[18]。这些分子通过刺激白细胞促进炎症反应,并促进肾小球和肾小管间质纤维化。此外,补体系统的激活也可增强肾小球炎症反应[17-19]。在IgAN 中,严重血尿常与急性呼吸道或胃肠道感染相关,表明感染在该疾病的发病机制中起着重要作用。布地奈德是一种肠道靶向激素,可以将皮质类固醇释放到回盲部区域,结果显示可改善IgAN 患者的蛋白尿,证明黏膜炎症与IgAN[20]之间存在关系。这表明无论是在全身还是局部,IgAN 患者均处于炎症状态,炎症会加重IgAN 患者的临床病理表现。同时,治疗炎症会改善患者的临床表现(如蛋白尿)。这可以解释为什么NLR 高水平组的IgAN患者具有更严重的临床表现,也可以解释为什么经治疗后,NLR 高水平组患者无效组和部分缓解组的构成高于NLR 低水平组。据估计,20%~40%的IgAN 患者在确诊后的20年内会发展为终末期肾病[4]。许多回顾性研究指出导致肾脏疾病进展的几个临床危险因素,如活检时基线eGFR 下降、血清白蛋白和血红蛋白含量低、蛋白尿严重、血压升高等[3,17,21-22]。也有研究指出,3 种可重复的肾组织学特征与肾功能下降率和肾存活终点均独立相关[17],即弥漫性系膜细胞增生、节段性肾小球硬化或黏连和肾小管萎缩/间质纤维化。肾小管萎缩/间质纤维化累及皮质>50%患者的预后比累及皮质26%~50%患者的差。本研究NLR 高水平组的IgAN 患者肾小管萎缩/肾间质纤维化和小动脉损伤程度比NLR 低水平组严重;纤维性新月体占比也较高。可以预测NLR 高水平组的IgAN 患者更有可能发展为ESRD,这也与Kaplan-Meier 生存分析显示NLR 高水平组肾脏总的生存率较NLR 低水平组降低的结果一致。
值得一提的是,在校正病理因素后,NLR 不是影响IgAN 患者进入终点事件的独立危险因素。有学者指出[17],内皮细胞增生与免疫抑制治疗的反应有关。另有研究报道[23-24],结合MEST 评分和活检时的临床数据可提高预测准确性,以确定预后不良风险最高的患者。这表明牛津分型是预测IgAN 预后非常有力的指标。在最后一步对牛津分型进行校正后,NLR 失去了作为影响IgAN 预后的独立危险因素的作用。该结果不同于其他疾病,例如T2DM、DN 或SLE[7,14,25],NLR 可以独立预测这些疾病的预后或疾病活动,可能是因为IgAN 的发病机制与其他疾病不同。与其他一些炎症因子(例如CRP、IL-6)比较,NLR 计算简单,成本更低。与单个白细胞参数比较,NLR 相对稳定,不容易受到脱水/过量水化、血液样本稀释和血液规格的影响,是重要的临床工具,同时被证实可反映IgAN 患者的炎症反应和疾病严重程度,对临床实践有重要帮助。
值得注意的是,本研究有一定的局限性。首先,所有患者都来自同一个中心。其次,本研究是一项回顾性研究,需要更大的队列和更长的随访时间来验证结果。总之,本研究结果提示NLR升高与IgAN 患者肾功能及组织学损害密切相关,可以用作反映IgAN 疾病严重程度的标志物。NLR不是影响IgAN 预后的独立危险因素。
