聚γ-谷氨酸分子结构变化在氯化钾降低发酵液黏度中的作用
2021-12-03李凌甫陈桂光梁智群
李凌甫,蒋 莉,刘 瑶,丁 苏,陈桂光,梁智群,曾 伟
(广西大学生命科学与技术学院,亚热带农业生物资源保护与利用国家重点实验室,广西微生物与酶工程技术研究中心,广西 南宁 530004)
聚γ-谷氨酸(poly-γ-glutamic acid,PGA)是一种由D-谷氨酸和(或)L-谷氨酸通过α-氨基和γ-羧基以酰胺键链接而成的阴离子型高分子聚合物[1]。PGA特殊的聚酰胺结构和主链上大量的游离羧基赋予其独特的生化特性,如水溶性、可降解性、无毒、无免疫原性及羧基可作为活性位点进行修饰等性质[2]。因此,PGA及其衍生物被广泛用于食品、化妆品、医药和农业等领域[3]。在食品领域,PGA可以作为冷冻保护剂、增稠剂、祛苦剂等[4]。例如,白登荣等[5]利用PGA改善鸡肉糜凝胶的性质;李天密等[6]利用PGA改善壳聚糖/姜黄素可食性复合膜的厚度和水溶性。
PGA生产方法有化学合成法和微生物发酵法,其中化学合成法存在合成路线长、副产物多、收率低、产物分子质量低等问题,而微生物发酵法生产过程易控、周期短、产率高、产量稳定、后处理工艺简单、便于大规模生产,因此PGA生产主要利用微生物发酵法。微生物发酵生产PGA的主要菌株为谷氨酸依赖型的芽孢杆菌属细菌,采用合成培养基,其中碳氮源和谷氨酸是必需组分,起始pH值一般维持在6.5~7.5之间,温度30~40 ℃,发酵周期36~96 h,PGA产量与适宜的碳氮比、底物添加量和无机盐密切相关[7]。采用补料分批发酵工艺,PGA发酵产量较高的可达30~50 g/L[8]。但在发酵过程中由于PGA的高分子和聚电解质特性会引起发酵液黏度增大,尤其是在发酵后期,底物、溶氧和热量的传递受到严重限制,从而制约了PGA产量和底物转化率的进一步提高[1]。本课题组前期发现KCl对PGA发酵液黏度具有显著调节作用,当添加15 g/L KCl至培养基时,尽管菌体生长受到一定抑制,但发酵液黏度显著降低了82.6%,PGA产量提高了39.5%[9]。
PGA分子结构(分子质量、立体构型和构象)与其水溶液的黏度极具相关性,且随环境因素如温度、溶液pH值、离子强度、PGA质量浓度等变化而变化,表现出结构多样性[10]。推测PGA分子结构的变化在KCl降低PGA发酵液黏度的过程中可能起重要作用。因此,KCl对PGA分子结构的影响值得深入探究。本实验利用1 株谷氨酸依赖型菌株枯草芽孢杆菌(Bacillus subtilis)GXA-28为研究对象,通过在其发酵培养基中添加15 g/L KCl研究该菌株合成的PGA分子结构变化情况及其对发酵液黏度的影响。
1 材料与方法
1.1 材料与试剂
实验所用菌株为本实验室自主筛选的B.subtilisGXA-28,菌株保藏编号CCTCC M 2012347。
葡萄糖、KH2PO4、MgSO4·7H2O、KCl 天津博迪化工有限公司;酵母膏 京奥博星生物技术有限公司;谷氨酸钠 广西南宁荷花味精有限公司;聚环氧乙烷日本TOSOH公司;无水乙醇 西陇化工有限公司。
1.2 仪器与设备
LC-20AT高效液相色谱系统(配有示差检测器和二极管阵列检测器) 日本Shimadzu公司;NicoletiS10傅里叶变换红外光谱仪 美国Thermo Fisher Scientific公司;STA449F3同步热分析仪 德国Netzsch公司;MOS-450圆二色谱仪 法国Bio-Logic公司;LSI-3DLS激光光散射仪 瑞士Lsinstruments公司;冷冻干燥仪 美国Labconco公司;R/S-CC旋转流变仪 德国Brookfield公司。
1.3 方法
1.3.1 培养基和培养方法
1.3.1.1 培养基
种子培养基:葡萄糖10 g/L,酵母膏5 g/L,谷氨酸钠5 g/L,KH2PO40.5 g/L,MgSO4·7H2O 0.1 g/L,pH 7.2±0.1;115 ℃灭菌30 min。
发酵培养基:葡萄糖20 g/L,酵母膏2.5 g/L,谷氨酸钠20 g/L,KH2PO40.5 g/L,MgSO4·7H2O 0.1 g/L,pH 7.2±0.1;115 ℃灭菌30 min。对照组发酵培养基不添加KCl,实验组发酵培养基加入15 g/L KCl。
1.3.1.2 培养方法
种子培养:吸取1.5 mL保藏于-20 ℃的甘油菌种,接种于装有30 mL种子培养基的250 mL三角瓶中,200 r/min、45 ℃恒温振荡培养8 h。
发酵培养:按2%(V/V)接种量将种子液接种于装有50 mL发酵培养基的250 mL三角瓶中,200 r/min、45 ℃恒温振荡培养24 h。
1.3.2 PGA纯化
发酵液经去离子水稀释5 倍后,4 ℃、13 400×g离心20 min除去菌体,上清液与4 倍体积无水乙醇混合,9 000×g离心5 min收集沉淀,真空干燥;再加入适当体积去离子水复溶,13 400×g离心10 min除去不溶物;用截留分子质量10 kDa的透析袋,4 ℃过夜透析,真空冷冻干燥即得纯化样品,纯化样品溶于去离子水中pH值为7.0[11]。
1.3.3 分子质量分析
取PGA纯化样品(10 mg,干质量)溶于10 mL去离子水中,4 ℃、13 400×g离心10 min去除不溶物,经0.45 μm滤膜过滤备用。采用LC-20AT高效液相色谱系统分析PGA分子质量:色谱柱为TSK-GELG6000PWXLColumn(7.8 mm×300 mm,5 μm),流动相为去离子水,流速1.0 mL/min,柱温30 ℃,进样量20 μL,示差检测器。用聚环氧乙烷作分子质量标准曲线[12]。
1.3.4D/L-谷氨酸比例分析
取PGA纯化样品(500 mg,干质量)于水解管中,加入10 mL 6 mol/L HCl溶液,抽真空,105 ℃酸解8 h。冷却后,用6 mol/L NaOH溶液调节pH 7.0,定容至100 mL,经0.45 μm滤膜过滤备用。采用LC-20AT高效液相色谱系统分析PGA的D/L-谷氨酸组成:色谱柱为CHIRALPAK MA(+),流动相为2 mmol/L CuSO4溶液,流速0.5 mL/min,柱温25 ℃,进样量10 μL,二极管阵列检测器[13]。
1.3.5 静态光散射分析
将PGA纯化样品溶解于经0.22 μm膜过滤的去离子水中,PGA质量浓度范围为1~10-6g/L,静置6 h备用。使用LSI-3DLS激光光散射仪进行静态光散射分析。该仪器装备22 mW He-Ne激光光源,测试波长632.8 nm,测试角度范围30°~120°,间隔为15°,每个角度重复测量4 次,测试温度25 ℃。重均分子质量、旋转半径和第二维利系数由Zimm plot软件计算得到[14]。
1.3.6 圆二色谱分析
采用圆二色谱通过监测酰胺键发生电子跃迁的紫外区域(180~250 nm)进行二级结构分析。取PGA纯化样品溶解于去离子水中作为待测样品,PGA质量浓度为1 g/L,0.22 μm膜过滤,pH 7.0。使用MOS-450圆二色谱仪进行分析,扫描范围190~250 nm,石英比色皿宽1 mm,温度45 ℃。圆二色谱图用去卷积软件CDNN2.1进行二级结构分析[15]。
1.3.7 红外光谱分析
红外光谱分析PGA分子构象。取PGA纯化样品与干燥KBr粉末(质量比1∶100)混合后,研磨压片,利用NicoletiS10傅里叶变换红外光谱仪在4 000~400 cm-1范围内扫描分析PGA,扫描次数32 次[16]。
1.3.8 差示扫描量热和热重分析
PGA的熔点和热降解温度由STA449F3同步热分析仪分析。PGA纯化样品放置于氧化铝坩埚上,升温速率10 ℃/min,温度范围25~800 ℃,氮气速率20 mL/min。熔点选取吸热峰峰值[14]。
1.3.9 PGA溶液剪切黏度分析
将PGA纯化样品完全溶解于去离子水中,PGA质量浓度为0.5 g/100 mL,测定温度为25 ℃,利用R/S-CC旋转流变仪测定静置0 h和6 h后的PGA水溶液的剪切黏度,剪切速率范围为3~35 s-1[16]。
2 结果与分析
2.1 PGA分子质量分析
如表1所示,当培养基中KCl添加量从0 g/L增加至15 g/L时,B.subtilisGXA-28合成PGA的重均分子质量和数均分子质量均有所降低,其中重均分子质量从(3 590±10)kDa下降至(3 090±10)kDa,数均分子质量从(1 620±26)kDa下降至(1 210±40)kDa,但多聚分散性从2.22提高至2.55。多聚分散性的提高是因为在添加15 g/L KCl培养基中小分子质量的PGA数量增加。在培养基中添加外源物质调控PGA分子质量的现象在其他菌株中也有类似报道,当培养基中FeCl3质量浓度从0 g/L增加至1.2 g/L时,Bacillus licheniformisATCC 9945a合成的PGA分子质量从(1 310±140)kDa下降至(318±30)kDa[17]。PGA分子质量对其黏度有重要作用,分子质量越大则黏度越高[13,18-19]。但是,在本实验中PGA分子质量仅下降13.9%,在PGA产量提高39.5%的情况下,发酵液黏度却降低了82.6%,说明PGA分子质量降低只是引起发酵液黏度下降的一个原因。

表1 KCl对PGA分子质量的影响Table 1 Effect of KCl on the molecular mass of PGA
2.2 PGA分子中D/L-谷氨酸比例分析
如表2所示,当培养基中KCl添加量从0 g/L增加至15 g/L,PGA分子中D-谷氨酸比例从(47.66±0.10)%提高至(53.77±0.02)%,L-谷氨酸比例从(52.34±0.10)%下降至(46.23±0.03)%。除了K+之外,Mn2+已经在B.subtilisNX-2、B.licheniformisATCC 9945a、B.licheniformisWBL-3等多株细菌中被证明能够有效地改变PGA中D/L-谷氨酸的比例[20-22]。PGA分子中D/L-谷氨酸比例会影响其性质[23]。例如,PGA分子中只含有D-谷氨酸或L-谷氨酸时可溶于乙醇,但当含有相同含量D-谷氨酸和L-谷氨酸时则不溶于乙醇[24]。此外,PGA分子中D/L-谷氨酸比例还会导致其在构象上存在差异[10]。所以,D-谷氨酸比例的提高会引起PGA性质和构象的变化,而这些变化可能与PGA溶液黏度有关,但仍需进一步验证。
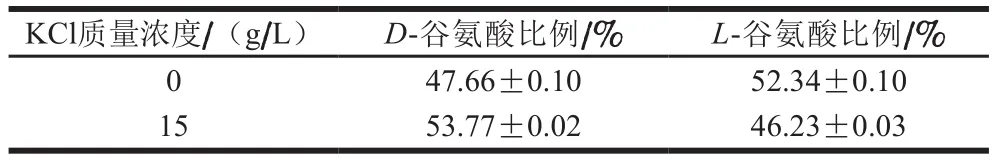
表2 KCl对PGA分子中D/L-谷氨酸比例的影响Table 2 Effect of KCl on the D/L-glutamate ratio of PGA
2.3 静态光散射分析
如表3所示,经过6 h静置后,不同KCl质量浓度下合成的PGA重均分子质量差别显著,并且远大于2.1节中分子质量。当培养基中KCl质量浓度从0 g/L增加至15 g/L时,在水溶液中的PGA重均分子质量从1.40×104kDa提高至5.22×107kDa。这是由于PGA分子会通过分子间相互作用使分子链纠缠形成聚集态、超螺旋和超折叠结构导致分子质量增加[16]。在相同PGA质量浓度下,聚集态、超螺旋和超折叠结构的PGA溶液黏度低于正常状态下的PGA黏度[25]。大幅提高的分子质量表明KCl的添加使B.subtilisGXA-28合成的PGA分子更容易形成聚集态[16]。这表明在培养基中添加15 g/L KCl合成的PGA水溶液黏度会更低。
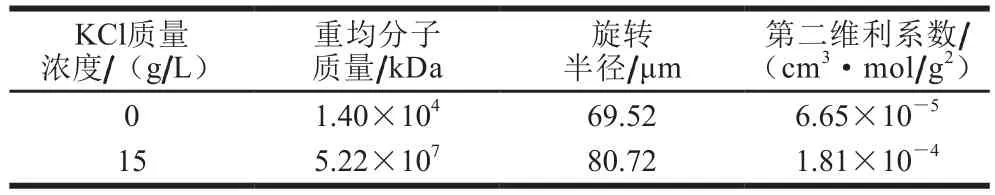
表3 KCl对PGA在水溶液中分子质量、旋转半径和第二维利系数的影响Table 3 Effect of KCl on the molecular mass, gyration radius and second virial coefficient of PGA in aqueous solution
不同KCl质量浓度下合成的PGA旋转半径也存在差别。未添加KCl时,PGA旋转半径为69.52 μm,而添加15 g/L KCl时PGA旋转半径增加至80.72 μm。旋转半径的增加远小于分子质量的增加,由此推测15 g/L KCl下合成的PGA在水溶液中可能形成了更加紧密的结构。无论添加KCl与否,PGA第二维利系数均为正数,说明B.subtilisGXA-28合成的PGA具有良好的水溶性。此外,添加15 g/L KCl合成的PGA的第二维利系数是未添加KCl的3 倍,这说明添加15 g/L KCl合成的PGA与水分子之间的分子作用更强。
2.4 红外光谱分析
如图1所示,不同KCl质量浓度下合成的PGA均在3 300~3 400 cm-1处有一个宽峰。未添加KCl时宽峰较为尖锐且特征峰的波数为3 374 cm-1;添加15 g/L KCl时特征峰峰形平缓宽大,特征峰波数3 314~3 374 cm-1。上述宽峰是由酰胺键中—NH基团振动伸缩引起的,宽峰中波数大(一般大于3 350 cm-1)的特征峰是非氢键酰胺—NH基团引起的,而波数小(一般小于3 350 cm-1)的峰则是氢键酰胺—NH基团,当两种—NH基团共存时特征峰会重叠而形成宽峰[26]。由此可知,培养基中未添加KCl时合成的PGA分子中以非氢键酰胺—NH基团为主;培养基中添加15 g/L KCl时,PGA分子内同时存在非氢键酰胺—NH和氢键酰胺—NH基团。这表明KCl的添加使PGA分子内氢键增强。PGA分子内氢键的强弱决定了PGA的构象,分子内氢键较强时PGA构象呈α-螺旋。因此,KCl的添加有可能使PGA构象发生了变化。
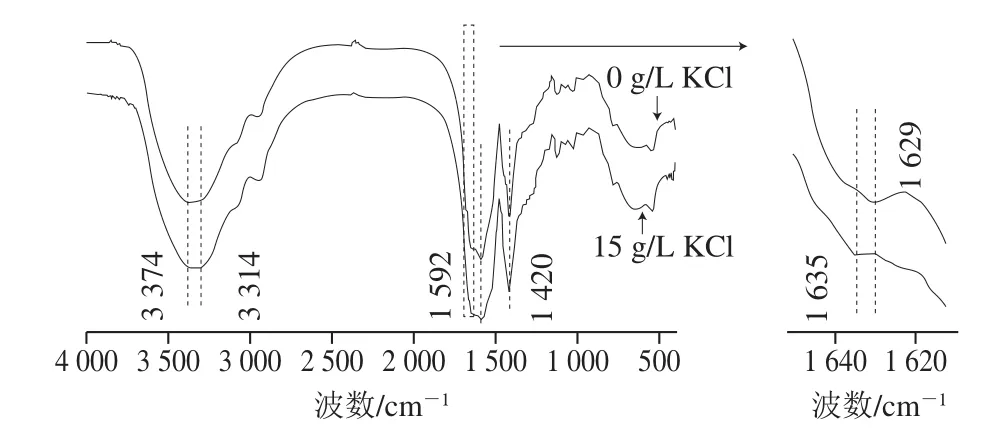
图1 不同KCl质量浓度下合成的PGA红外光谱图Fig.1 FTIR spectra of PGA synthesized with different KCl concentrations
不同KCl质量浓度下合成的PGA分子在1 592 cm-1和1 420 cm-1处均有很强的振动峰,这两个峰是—COOH基团去质子化后形成的—COO—引起的,1 592 cm-1处为不对称拉伸峰,而1 420 cm-1为对称拉伸峰。这与PGA分子在偏中性和碱性条件下在1 590 cm-1和1 410 cm-1处出现特征峰[27]基本一致。此外,KCl的添加使PGA分子在1 629 cm-1处的特征峰移动到了1 635 cm-1。1 630~1 650 cm-1处的特征峰通常用于分析二级结构(α-螺旋、β-折叠和无规卷曲等)的变化,1 635 cm-1处的特征峰表明PGA分子内存在α-螺旋结构[28]。特征峰的移动表明KCl的添加使PGA构象中形成了α-螺旋结构。综上所述,红外光谱表明KCl的添加会使PGA分子内氢键增强,从而形成α-螺旋结构。
2.5 圆二色谱分析
如图2所示,不同KCl质量浓度下合成的PGA分子均在212 nm存在负峰。在远紫外区时,β-折叠结构的多肽会在212 nm处形成负峰[15]。212 nm处的负峰表明不同KCl质量浓度下合成的PGA都存在β-折叠结构,且未添加KCl时合成的PGA分子以β-折叠结构为主。培养基中添加15 g/L KCl时合成的PGA在209 nm和215 nm处形成了负峰。远紫外区时,α-螺旋结构的多肽会在209 nm处形成负峰[25]。由此可知,KCl的添加使PGA分子从β-折叠结构转向了β-折叠与α-螺旋并存的结构。此外,215 nm处的负峰可能是由β-折叠结构转向其他结构时形成的过渡态结构而引起。圆二色谱结果表明,KCl的添加使PGA分子从β-折叠结构转向了β-折叠与α-螺旋并存的结构。圆二色谱分析结果与红外光谱结果基本一致。
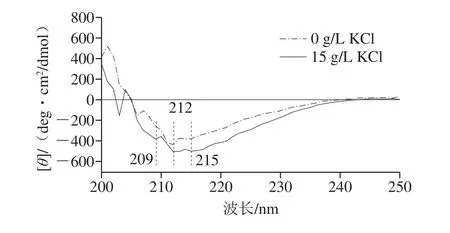
图2 不同KCl质量浓度下合成的PGA圆二色谱图Fig.2 CD spectra of PGA synthesized with different KCl concentrations
2.6 差示扫描量热和热重分析
如图3所示,第1个吸热峰是PGA纯化样品中的水蒸发吸热峰,质量占据了样品质量的20%;第2个吸热峰是PGA分子的吸热峰,而该吸热峰分成了2 个阶段,第1阶段的吸热峰面积较第2个阶段大。当培养基中KCl添加量从0 g/L增加至15 g/L时,PGA熔点从376.46 ℃提高至377.26 ℃,焓变从486.6 J/g提高至498.1 J/g(表4)。这表明随培养基中KCl添加量的增加,PGA熔点和焓变稍有提高。
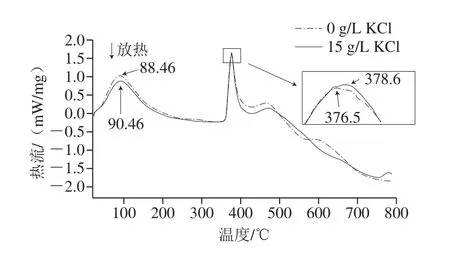
图3 不同KCl质量浓度下合成的PGA差示扫描量热图Fig.3 Differential scanning calorimetry curves of PGA synthesized with different KCl concentrations
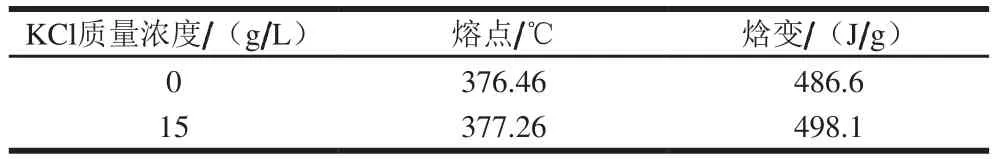
表4 KCl对PGA热力学性质的影响Table 4 Effect of KCl on thermodynamic properties of PGA
培养基中添加0 g/L和15 g/L KCl合成的PGA质量损失温度分别从365 ℃和368.5 ℃开始,直到800 ℃仍然存在质量损失现象(图4)。从质量损失温度开始,PGA的质量损失曲线分为3 个阶段,第1阶段是PGA在高温(质量损失开始温度到410 ℃左右)下进行热降解。当温度继续升高至410~500 ℃左右时,出现第2次质量损失情况,即为第2阶段的质量损失。第3阶段是PGA持续热降解形成焦谷氨酸(500~800 ℃)。经过质量损失后,PGA残余质量在去除水分占比后大约为25%,这与其他文献报道的PGA热降解后残余质量基本一致,残余物质是PGA在高温催化下形成的焦谷氨酸[29]。一般情况下,PGA的质量损失过程不存在类似的第2阶段质量损失变化,但本研究中PGA质量损失存在第2阶段的质量损失,这与其他报道结果存在差异[30]。差示扫描量热分析与热重分析结果表明KCl的添加使PGA熔点、焓变和热质量损失温度均略有提高。熔点、焓变和热质量损失温度会受到分子内作用力的影响,分子内作用力强时熔点、焓变和热质量损失温度会降低[14]。而PGA构象由β-折叠结构转向了α-螺旋时,分子内氢键增强,分子内作用力减弱[27]。由此可知,KCl的添加使PGA构象发生了变化。

图4 不同KCl质量浓度下合成的PGA热重图Fig.4 Thermogravimetry curves of PGA synthesized with different KCl concentrations
2.7 PGA溶液剪切黏度分析
如图5所示,不同时间下,PGA水溶液均体现出剪切变稀的特性。剪切变稀的特性说明PGA水溶液属于假塑性流体,其与其他报道一致[31]。不同KCl质量浓度下合成的PGA水溶液剪切黏度不同。当培养基中添加15 g/L KCl时,PGA剪切黏度从2.12 Pa·s下降至1.44 Pa·s,剪切黏度降低了32.08%(图5a)。此外,随静置时间的延长,PGA水溶液的剪切黏度明显降低。PGA水溶液静置6 h后,培养基中未添加KCl时合成的PGA水溶液剪切黏度为1.99 Pa·s,添加15 g/L KCl时的剪切黏度仅为1.14 Pa·s,相比于0 h的剪切黏度分别降低了6.14%和20.84%(图5b)。这表明培养基中KCl的添加使PGA水溶液剪切黏度随时间延长而降低的现象更明显。该结果与2.3节推测基本一致。
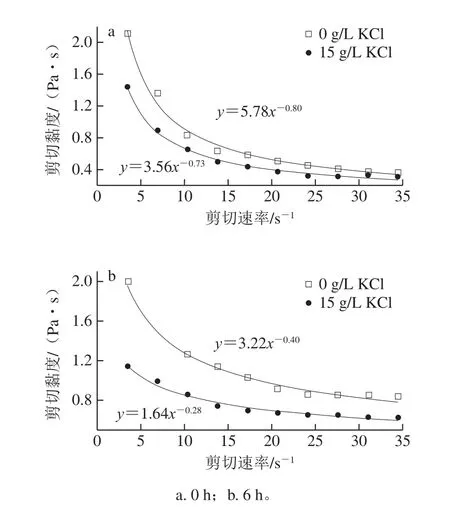
图5 不同KCl质量浓度下合成的PGA水溶液剪切黏度曲线Fig.5 Shear viscosity curves of PGA aqueous solutions synthesized with different KCl concentrations
3 结 论
利用凝胶渗透色谱、手性色谱、静态光散射、圆二色谱、红外色谱、热分析以及剪切黏度测定等方法,对添加KCl培养基中B.subtilis合成的PGA分子结构(分子质量、立体构型和构象)进行了系统表征。当培养基中添加15 g/L KCl时,PGA分子质量下降13.9%,PGA分子中D-谷氨酸比例增加6.11%,PGA表现出更好的水溶性,且更易发生聚集而形成聚集态,构象上β-折叠结构转向了β-折叠与α-螺旋并存的结构,剪切黏度降低了32.08%(0 h)。
PGA分子质量和PGA分子中D-谷氨酸比例会受到PGA合成酶系的影响,其中PGA分子质量主要受到PGA降解酶(如pgdS、ggt和cwlO等)的影响,PGA中D-谷氨酸比例则受到谷氨酸消旋酶或转运酶(如glr和dat等)的影响[3,17]。KCl的添加有可能引起了上述酶系表达量的变化,使PGA分子质量降低及PGA中D-谷氨酸比例提高。PGA分子质量的降低和PGA中D-谷氨酸比例的提高降低了PGA溶液黏度。
当溶液pH值高于PGA等电点时,PGA分子在溶液中的带负电荷,PGA分子之间排斥作用较强[7]。培养基中添加KCl时,部分K+会进入PGA分子中使PGA的负电荷降低,静电排斥力减弱,因而容易聚集[16]。而PGA溶液黏度会随聚集态程度的升高而降低,因此PGA易形成聚集态的特性会使PGA溶液黏度降低。
此外,PGA构象变化与KCl的添加密不可分。因为PGA构象受到分子内氢键的影响,H+会使PGA形成强烈的分子内氢键,从而导致PGA构象转向α-螺旋[27]。K+与H+相似,K+的添加也会使PGA构象向α-螺旋转变,但K+直径大于H+且K+的对于羧基的负电荷亲和力弱于H+[32]。因此KCl的添加仅使PGA构象由β-折叠转向β-折叠和α-螺旋并存的结构。PGA构象对PGA溶液黏度意义重大,构象为α-螺旋时PGA溶液黏度较低,β-折叠时黏度较高。因而,KCl的添加引起的构象转变将会使PGA溶液黏度降低。
综上所述,KCl的添加会使PGA分子结构发生变化,分子结构的变化会直接导致PGA水溶液黏度降低,从而引起PGA发酵液黏度的降低。KCl降低发酵液黏度时分子结构变化涉及分子质量、立体构型和构象,而其他降低PGA发酵液黏度的方法引起的分子结构变化往往是单方面的。如耐盐B.subtilis(chungkookjang)发酵生产PGA时可以通过添加NaCl使发酵液黏度降低,NaCl的添加引起发酵液黏度降低的原因是NaCl导致PGA分子质量的降低[13]。B.subtilisCGMCC 2108发酵生产PGA时,可以通过向培养基中添加CaCl2降低发酵液黏度,而导致发酵液黏度降低的原因是CaCl2使PGA构象发生了变化[31]。分子结构多方面变化协同作用导致PGA发酵液黏度降低给开发降黏策略提供了新的思路和基础。
