穿心莲内酯脂质聚合物纳米粒对脓毒血症大鼠肾损伤的保护作用研究
2021-12-03李婷婷王书梦
李婷婷,王书梦,项 艳
0 引言
脓毒血症是一种死亡率极高的全身性炎症反应疾病,严重威胁着患者的生命健康[1]。严重脓毒血症患者可出现多器官功能衰竭,而肾脏是最容易受损的脏器之一[2]。因此,缓解脓毒血症引起的肾脏损伤具有重要的临床意义。穿心莲内酯(Andrographolide,AG)是从中药穿心莲中提取分离得到的一种二萜内酯类化合物,具有抗炎、抗病毒、抗肿瘤等药理作用[3-5]。近年来研究显示,AG对脓毒血症大鼠肝损伤具有保护作用,该作用与抑制NF-κB信号通路有关[6]。但由于AG口服生物利用度较差,很难应用于临床。
近年来,纳米给药系统在医药领域得到了广泛发展,因其可提高药物的溶解度和生物利用率,解决了许多难溶性或难吸收药物的给药问题。脂质聚合物纳米粒(Lipid-polymer hybrid nanoparticles,LPNs)是纳米给药系统的一种,目前已应用于递送药物和诊断成像剂等领域[7]。为了解决AG的口服生物利用度,本研究通过纳米沉淀法制备载穿心莲内酯脂质聚合物纳米粒(AG-LPNs)并对其进行表征,通过建立脓毒血症大鼠模型,观察AG-LPNs对脓毒血症肾损伤的保护作用。
1 材料
1.1 动物 雄性清洁级SD大鼠60只,180~200 g,购自北京维通利华实验动物有限公司,[SCXK(京)2016-0001],动物饲养于清洁级动物房中,每笼3~4只,自由饮水、摄食,12 h光照/12 h黑暗,温度20~25℃,相对湿度40%~70%。
1.2 试剂 穿心莲内酯原料药(分子式:C20H30O5;含量>98%)和聚乳酸-羟基乙酸共聚物购自大连美仑生物科技有限公司;穿心莲内酯标准品购自中国药品生物制品检定所;大豆卵磷脂购自德国Lipoid公司;二硬脂酰基磷脂酰乙醇胺-聚乙二醇购自上海艾韦特医药科技有限公司;血肌酐(Scr)、血尿素氮(BUN)、中性粒细胞明胶酶相关载脂蛋白(NGAL)和肾损伤分子-1(KIM-1)检测试剂盒购自深圳迈瑞生物公司;乙腈购自德国Merck公司;无水乙醇购自国药集团上海化学试剂公司;RPMI裂解液,BCA蛋白定量试剂盒,TUNEL、HE染色试剂盒购自北京索莱宝公司。Bcl-2抗体、Bax抗体、Caspase-3抗体、GAPDH抗体、抗兔IgG-HRP二抗购自上海爱必信公司。
1.3 实验仪器 SIGMA 2-16K离心机(美国Sigma公司产品);Agilent1260高效液相色谱仪(美国Agilent公司产品);Nano ZS 90激光粒度仪(英国Malvern公司产品);R206型旋转蒸发仪(上海申生科技有限公司产品);JEM-2100场发射透射电子显微镜(日本电子株式会社产品);AI600凝胶成像仪(美国GE公司产品)。
2 方法
2.1 AG-LPNs的制备 采用纳米沉淀法制备AG-LPNs。将23 mg磷脂用250 μl无水乙醇溶解,分散到20 ml去离子水中,65 ℃水浴,300 r/min搅拌30 min,此为水相备用。将60 mg 聚乳酸-羟基乙酸共聚物和10 mg AG用10 ml乙腈溶解,作为有机相。将有机相与水相混合,100 r/min搅拌2 h。37 ℃旋转蒸发,除去乙腈。将得到的溶液4 000 r/min离心10 min,除去未包载的AG沉淀,得到AG-LPNs,冷藏备用。
包封率测定:将AG-LPNs分散液中加入乙腈,超声破乳,0.45 μm针式滤器过滤,取滤液经高效液相色谱测定AG含量。同时取AG-LPNs于超滤离心管中,3 000 r/min离心10 min,用高效液相色谱测定其AG含量。
粒径和电位测定:采用激光粒度仪测定AG-LPNs粒径和Zeta电位。
形态观察:取制备的AG-LPNs,去离子水稀释,将样品滴加到铜网上,自然干燥,利用透射电镜观察纳米粒的形态。
2.2 脓毒血症模型建立和分组给药 参考文献[6],采用盲肠结扎法制备脓毒血症大鼠模型。用异氟烷将大鼠麻醉并仰卧位固定于手术台面上,剪开腹部,暴露盲肠并结扎。假手术组进行手术,但不结扎。将模型大鼠随机分为模型组、AG组、AG-LPNs组。同时以只进行手术,但不结扎的大鼠作为假手术组。术后12 h开始灌胃给药。AG组和AG-LPNs组给予AG量50 mg/kg,假手术组和模型对照组给予等体积生理盐水,每12小时给药1次,连续给药3 d。
2.3 血液中Scr和BUN测定 取大鼠静脉血,室温下静置1 h,3 000 r/min离心10 min,取上清液,采用ELISA试剂盒进行检测,检测波长为450 nm,记录吸光度值,参考说明书制作标准曲线,计算样品Scr和BUN浓度。
2.4 尿液中NGAL和KIM-1的测定 收集大鼠尿液,尿液静置后1 500 r/min离心5 min,取上层液进行检测,计算NGAL和KIM-1浓度。
2.5 TUNEL染色检测肾脏细胞凋亡情况 将肾脏组织置于10%中性福尔马林中固定,而后修剪、脱水、透明、石蜡包埋,制作切片,加入细胞通透液处理8 min,冰浴孵育,按说明书进行TUNEL染色,滴加50 μl TUNEL染色液37 ℃湿盒内孵育1 h,PBS洗2遍,荧光显微镜下观察和拍照。
2.6 HE染色检测肾脏组织病理变化 将肾脏组织制成切片,经梯度二甲苯脱蜡,梯度酒精至水,自来水冲洗,切片分别以伊红和苏木素染色,自来水冲洗,酒精脱水,二甲苯透明,稍晾干后,中性树胶封片,显微镜观察并拍照。
2.7 蛋白印记实验检测肾脏组织Bcl-2、Bax及Caspase-3表达水平 肾脏组织经RPMI裂解液提取总蛋白,以BCA蛋白定量试剂盒对蛋白进行定量,然后制备蛋白样品,样品经PAGE电泳分离蛋白,后将分离的蛋白转印至PVDF膜上,5%脱脂牛奶封闭4 h,4 ℃孵育Bcl-2(1∶1 000)、Bax(1∶2 000)及caspase-3(1∶1 000)抗体过夜。TBST洗膜后孵育抗兔IgG-HRP二抗1 h。膜经TBST洗后淋ECL发光液,置于凝胶成像仪下成像。
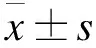
3 结果
3.1 AG-LPNs体外表征 如图1所示,AG-LPNs的平均动力学直径分别为(180±23) nm,Zeta电位为(-18±2.6) mV,其包封率和载药量分别为86%和12%。透射电镜下,AG-LPNs外观呈均一的球形,可见明显的核壳结构。
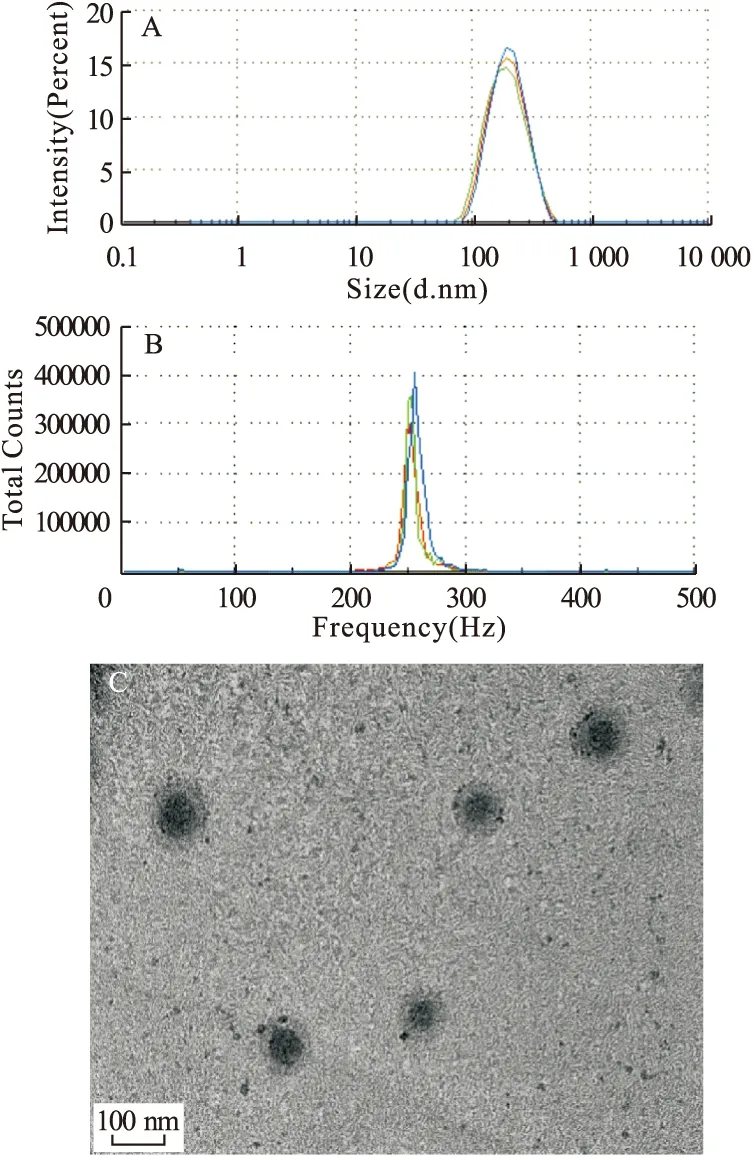
图1 AG-LPNs体外表征图注:A.AG-LPNs粒径,B.AG-LPNs电位,C.透射电镜下AG-LPNs形态
3.2 大鼠血清和尿液指标检测 如表1所示,与假手术组相比,模型组大鼠血清Scr和BUN升高,尿液中NGAL和KIM-1升高,差异有统计学意义(P<0.01);相较于模型组,AG组和AG-LPNs组Scr、BUN、NGAL、KIM-1均下降,差异有统计学意义(P<0.01);与AG组相比,AG-LPNs组Scr、BUN、NGAL、KIM-1下调更为显著,差异有统计学意义(P<0.01)。

表1 各组大鼠Scr、BUN、NGAL、KIM-1水平比较
3.3 大鼠肾脏细胞凋亡分析 如图2所示,与假手术组相比,模型组细胞凋亡指数显著升高(P<0.01);与模型组相比,AG组和AG-LPNs组细胞凋亡指数明显降低(P<0.01),其中AG-LPNs组细胞降低更为明显(P<0.01)。
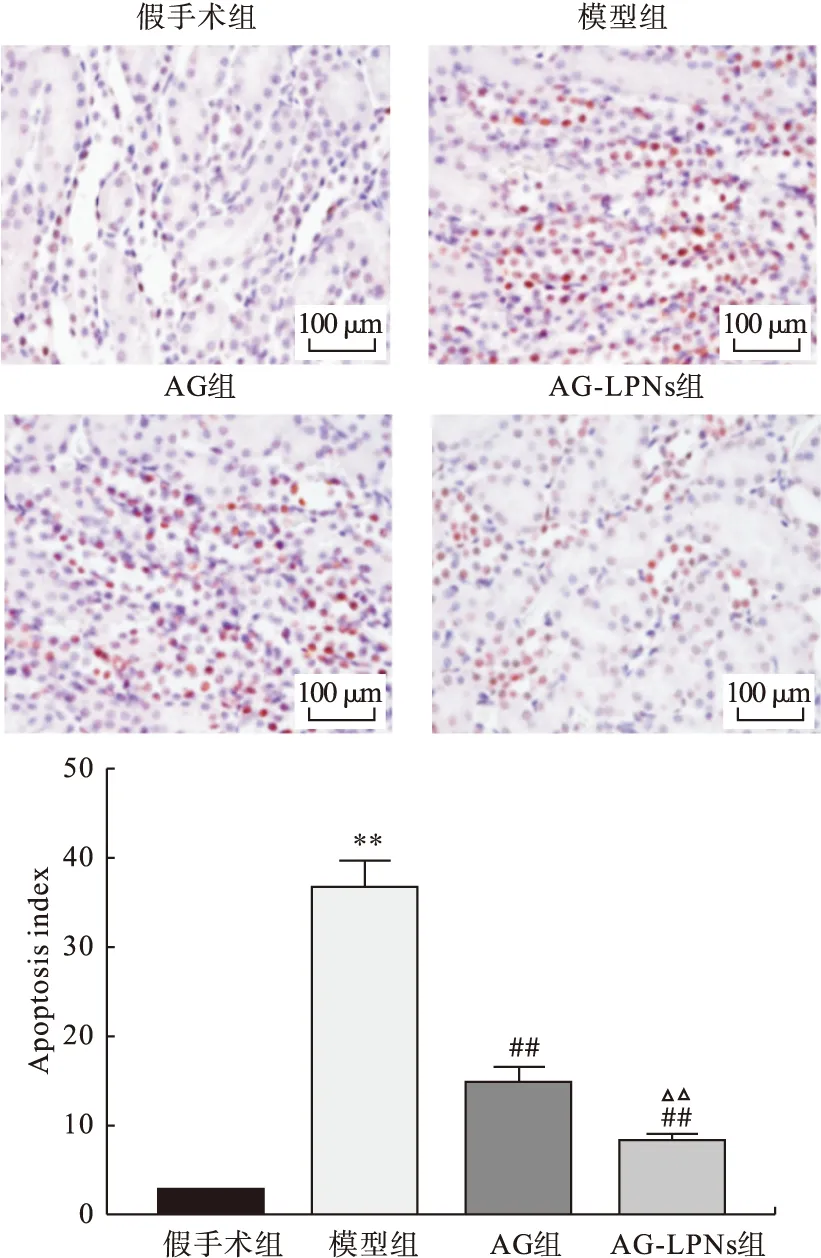
图2 各组大鼠肾脏组织细胞凋亡水平注:与假手术组相比,## P<0.01;与模型组相比,## P<0.01;与AG组相比,△△P<0.01
3.4 大鼠肾脏组织HE染色 如图3所示,与假手术组相比,模型组肾脏组织可见广泛肾小管扩张,肾小管上皮细胞空泡、变性、脱落,同时肾脏组织还可见明显的炎性细胞浸润和核质分离现象。AG和AG-LPNs组出现明显改善,其中AG-LPNs组改善更为明显。
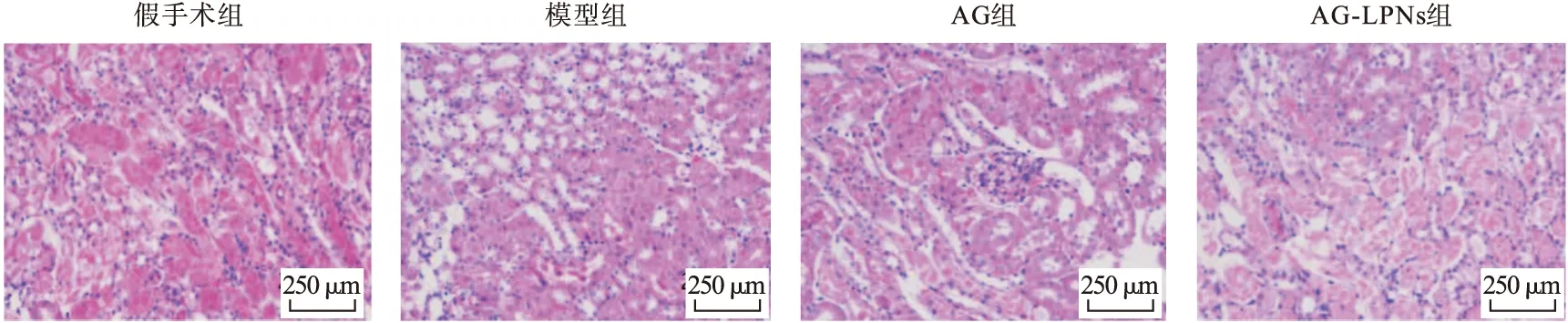
图3 各组大鼠肾脏组织HE染色
3.5 大鼠肾脏组织Bcl-2、Bax及Caspase-3表达水平 如图4所示,与假手术组相比,模型组肾脏组织Bax和Cleaved Caspase-3蛋白表达显著上调,Bcl-2蛋白表达明显下调(P<0.01)。与模型组相比,AG和AG-LPNs组Bax和Cleaved Caspase-3蛋白表达显著下调,Bcl-2蛋白表达明显上调(P<0.01)。与AG组相比,AG-LPNs组Bax和Cleaved Caspase-3蛋白表达显著下调,Bcl-2蛋白表达明显上调(P<0.01)

图4 各组大鼠肾脏组织Bcl-2、Bax及Caspase-3表达水平注:与假手术组相比,## P<0.01;与模型组相比,## P<0.01;与AG组相比,△△P<0.01
4 讨论
近年来,纳米技术在医学中的应用取得了进步,极大地改善了小分子药物、大分子生物药品及诊断显像剂等的临床应用效果[8]。纳米载体具有众多优势,如改善药物的整体药代动力学、增强药物的溶解性和生物利用度、增强药物的靶向性、规避固有生物学障碍、递送不同化学性质的药物等[9-10]。在众多纳米载体中,最突出的两种为脂质体和聚合物纳米粒[11]。脂质体具有良好的生物相容性,但其靶向分布欠佳[11-12]。而聚合物纳米粒能够有效控制药物释放,并在一定程度上提高药物稳定性,但其生物相容性较差[11-12]。因此,二者的应用都受到了一定的限制。LPNs具有壳核结构,兼有脂质体和聚合物纳米粒两者的优点[13],具有较好的发展前景。
AG作为天然化合物,在抗炎、抗病毒及抗肿瘤等方面发挥一定作用[3-5]。但AG的口服生物利用度不高,为了解决这一问题,本研究制备了AG-LPNs。结果显示,AG-LPNs外观呈均一的球形,可见明显的核壳结构。检测AG-LPNs直径、Zeta电位、包封率和载药量,确定其可满足实验要求。本研究进一步构建了脓毒血症模型大鼠,并发现模型大鼠血清Scr和BUN、尿液中NGAL和KIM-1明显升高。研究证实,血清Scr、BUN以及尿液NGAL、KIM-1升高与肾损伤相关[14]。组织学检测发现,模型组肾脏组织可见广泛肾小管扩张、肾小管上皮细胞空泡变性以及脱落,并有明显的炎性细胞浸润和核质分离现象。这提示本研究构建的脓毒血症大鼠伴随肾损伤。本研究发现,AG和AG-LPNs治疗均可降低模型大鼠血清Scr和BUN,以及尿液中NGAL和KIM-1水平,且AG-LPNs效果更为显著。组织学分析结果显示,AG和AG-LPNs均明显改善了脓毒血症大鼠肾脏组织细胞的病理变化,同样AG-LPNs效果更佳。提示以LPNs载AG可增强后者对肾损伤的保护作用。TUNEL染色观察肾脏组织凋亡情况发现,模型大鼠肾脏组织细胞凋亡增多,而AG和AG-LPNs可降低细胞凋亡水平,并且AG-LPNs的作用更具优势。在分子水平上,本研究发现,模型大鼠肾脏组织Bax和Cleaved Caspase-3蛋白表达上调,以及Bcl-2蛋白表达下调,而AG和AG-LPNs可抑制模型大鼠肾脏组织上述3种蛋白表达变化,并且AG-LPNs的抑制作用更强。Bax和Bcl-2分别是促凋亡和抗凋亡蛋白中的代表成员;而Caspase-3作为凋亡的执行者,其剪切体Cleaved Caspase-3增多与凋亡明显相关[15-16]。提示AG-LPNs可调节Bax、Bcl-2及Cleaved Caspase-3蛋白表达,从而抑制脓毒血症肾损伤大鼠肾细胞凋亡。
与传统脂质体和聚合物纳米粒相比,LPNs在药物包封、控制药物释放及增强药物摄取方面显示出明显优势[16]。这些可能是本研究AG-LPNs对脓毒血症大鼠肾损伤具有较好保护作用的原因。但AG-LPNs在体内的吸收转运过程和作用机制仍需进一步研究。综上所述,与AG相比,AG-LPNs对脓毒血症大鼠肾损伤保护方面具有明显优势,这一优势可能与AG-LPNs较强的抗凋亡作用有关。
