小檗碱对奥氮平诱导胰岛素抵抗大鼠炎症因子及TLR4/NF-κB炎症信号通路的影响
2021-12-03兰建萍刘守青谢欣娥
兰建萍,刘守青,谢欣娥,王 俊
0 引言
奥氮平(Olanzapine,OLA)是临床抗精神分裂症的首选药物之一[1],但是易引起代谢紊乱,如体重增加、葡萄糖耐受不良、胰岛素抵抗(Insulin resistance,IR)等[2]。IR发生或加重与胰岛素受体底物信号的损害有关[3]。Toll样受体-4(Toll-like receptors-4,TLR-4)是模式识别受体家族的一员,其通过激活炎症通路(如激活核因子κB,Nuclear factor kappa B,NF-κB)来调节免疫反应[4]。因此,抑制胰岛素靶组织(肌肉、肝脏和脂肪组织)中TLR-4/NF-κB信号通路有望成为预防长期服用奥氮平引起代谢紊乱的新靶点[5]。小檗碱(Berberine,BBR)是一种常见的异喹啉类生物碱,可被用于治疗一些慢性代谢紊乱性疾病,并且在多种疾病模型中,TLR-4/NF-κB通路被证实是BBR发挥生理学作用的重要机制之一[6-8]。故本文旨在基于TLR-4/NF-κB通路,探讨BBR对OLA诱导的胰岛素抵抗的改善作用。
1 对象与方法
1.1 实验动物 36只6周龄SPF级的雄性SD大鼠(220±10)g购于湖南省中医药研究院实验室,许可证号:SCXK(湘)2016-0002。将动物饲养在浙江省中医药大学实验动物房内,实验动物许可证号:SYXK(浙)2019-0024。所有操作均符合动物伦理学要求。饲养环境:(22±2)℃,12 h光/暗交替,单笼饲养。
1.2 主要仪器与试剂 ABI 7500 型Real-time PCR仪购自美国Thermofisher公司;One Touch Ultra稳豪系列血糖仪购自美国LifeScan Inc公司,试纸批号287695。奥氮平(货号:LRAA9505,含量>99%),小檗碱(货号:67K1454)购自美国Sigma公司;胰岛素(E-EL-R2466c)、肿瘤坏死因子α(Tumor necrosis factor alpha,TNF-α)(E-EL-R0019c)、白细胞介素-1β(Interleukin 1beta,IL-1β)(E-EL-R0012c)及IL-6(E-EL-R0015c)ELISA试剂盒均购自武汉伊莱瑞特公司。初级单克隆抗体包括TLR4、p-NF-κB p65、NF-κB p65、NF-κB抑制蛋白(NF-κB inhibitor α,IκBα)、p-IκBα及β-actin和二级抗体均购自于赛信通(上海)生物试剂有限公司;
1.3 实验分组及处理 在实验开始前,动物在实验室条件下适应饲养1周。称量大鼠体重,按照随机数字表法分为对照组、OLA组和OLA+BBR组,每组各12只。OLA组大鼠每日腹腔注射OLA 8 mg/kg,OLA+BBR组大鼠给予OLA(腹腔注射)8 mg/kg+BBR(灌胃)200 mg/kg,对照组大鼠腹腔注射等量的无菌生理盐水,连续给药8周。应用稳态模型法(HOMA model)计算胰岛素抵抗指数(Homeostasis model assessment insulin resistance,HOMA-IR),OLA组HOMA-IR与对照组有统计学差异表明建模成功。
1.4 观察指标及检测方法
1.4.1 空腹血糖、体重及IR指数测定 常规记录大鼠体重。最后1次给药结束后,禁食14 h,从尾尖切口采集血液标本约0.5 ml,置于EP管中抗凝后,3 500 r/min离心20 min(半径22 cm)。用血糖仪测定空腹血糖(Fasting blood glucose,FBG)水平。并采用胰岛素ELISA试剂盒测定各组大鼠血清空腹胰岛素(Fasting insulin,Fins)水平,计算HOMA-IR。HOMA-IR = FBG (mmol/L) ×Fins(μg/L) /22.5。
1.4.2 组织样本获取 最后1次采血结束后,取大鼠肝脏和附睾白色脂肪组织(Epididymal white adipose tissues,eWAT)切开分成2部分:一半用液氮冻存后保存在-80 ℃下,直至用于Western blot分析;另一半用4%多聚甲醛在0.1 mmol/L磷酸盐缓冲液(pH7.4)中浸泡固定。石蜡包埋,进行HE染色。
1.4.3 ELISA法检测血清和组织TNF-α、IL-1β、IL-6水平 取肝脏和eWAT组织,经液氮碾磨,用RIPA裂解液提取组织中的蛋白。收集大鼠血清,采用BCA试剂盒对样本蛋白进行定量,ELISA法检测血清和组织中TNF-α、IL-1β及IL-6水平。
1.4.4 Western blot法检测肝脏和eWAT组织相关蛋白 取肝脏和eWAT组织蛋白。经BCA定量后,采用Western blot技术,电泳,转膜,5%脱脂奶粉封闭2 h。按抗体说明书进行配比,分别用TLR4抗体(1∶200)、p-NF-κB p65抗体(1∶500)、NF-κB p65抗体(1∶250)、IκBα抗体(1∶500)、p-IκBα抗体(1∶500)4℃孵育过夜。次日,TBST洗膜3次,每次10 min。加入带HRP标记的二抗室温孵育1 h,TBST洗膜3次,每次10 min。曝光仪曝光。
1.4.5 病理组织分析 利用标准方案对肝脏和eWATs进行苏木精-伊红(Hematoxylin-eosin,HE)染色,并进行石蜡包埋。将组织切片(4 μm)在光学显微镜下观察。
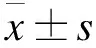
2 结果
2.1 BBR对OLA诱导的IR大鼠模型体重、血糖和IR的影响 实验过程中未出现动物死亡。实验结束时,OLA组大鼠体重、血清FBG、Fins和HOMA-IR均高于对照组,差异有统计学意义(P<0.05);而OLA+BBR组大鼠血清FBG、Fins和HOMA-IR低于OLA组,差异有统计学意义(P<0.05),见表1。

表1 实验结束时各组大鼠FBG、Fins、IR比较
2.2 BBR对OLA诱导的IR大鼠模型血清和组织中炎症因子水平的影响 实验结束时,OLA组大鼠血清和eWAT组织中TNF-α、IL-1β、IL-6均高于对照组(P<0.05);而OLA+BBR组大鼠血清和eWAT组织中TNF-α、IL-1β、IL-6水平低于OLA组,差异有统计学意义(P<0.05),见图1。
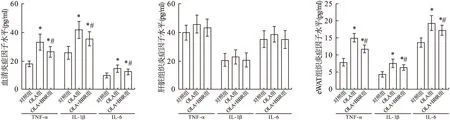
图1 实验结束时各组大鼠血清和组织中TNF-α、IL-1β、IL-6水平比较注:与对照组相比,*P<0.05;与OLA组相比,#P<0.05
2.3 BBR对OLA诱导的IR大鼠肝脏和eWAT组织病理改变的影响 显微镜下显示,与对照组大鼠相比,OLA组以弥漫性肝大泡性脂肪变性为主要特征,胞浆内可见大小不等的圆形空泡,脂肪细胞体积增大且形态大小不一,并且可见部分泡沫细胞浸润,中性粒细胞浸润数量增多。而OLA+BBR组肝脏和eWAT组织上述病理学改变较OLA组减轻,且中性粒细胞数量减少,未见明显纤维化改变,见图2。

图2 各组大鼠肝脏和eWAT组织HE染色(100×)注:黄色箭头表示胞浆内出现大小不等的圆形空泡
2.4 BBR对OLA诱导的IR大鼠肝脏组织和eWAT组织中TLR4/NF-kB炎症信号通路相关蛋白表达的影响 经Western blot法检测,OLA组肝脏组织和eWAT组织中TLR4/β-actin、p-NF-κB p65/NF-κB p65、p-IκBα/IκBα蛋白表达比值均高于对照组,差异有统计学意义(P<0.05);而OLA+BBR组肝脏组织和eWAT组织中TLR4/β-actin、p-NF-κB p65/NF-κB p65、p-IκBα/IκBα蛋白表达比值均低于对照组,差异有统计学意义(P<0.05),见图3。

图3 Western blot法检测各组蛋白表达注:与对照组相比,*P<0.05;与OLA组相比,#P<0.05
3 讨论
长期服用非典型抗精神病药物OLA所致胰岛素抵抗可能导致药物不依从,增加胰岛素抵抗、糖尿病和心血管疾病的风险等,是目前临床上亟待解决的重要问题[9]。BBR是在黄连、黄柏等药材中含量较高的异喹啉生物碱,能够显著抑制高脂饮食诱导的肥胖小鼠模型体重增加和血糖血脂及炎症因子水平升高,同时上调脂联素浓度、下调瘦素水平、改善胰岛素抵抗等[10]。黄平等[11]通过纳入105例OLA致体重增加的精神分裂症患者作为研究对象,证实黄连与肉桂配伍可改善长期服用奥氮平引起的糖脂代谢紊乱;此外,刘守青等[12]则利用长期服用OLA构建的大鼠胰岛素抵抗模型证实,黄连联合枸杞子可显著降低胰岛素抵抗相关蛋白脂肪酸转运酶、蛋白质酪氨酸磷酸酶-1B、香叶基香叶基焦磷酸合成酶、G蛋白偶联受体激酶2、三酰甘油脂肪酶的表达水平,进而改善大鼠的胰岛素抵抗,为临床预防或降低OLA不良反应提供了一定的参考依据。但是目前很少有学者讨论BBR单独用药对OLA诱导的胰岛素抵抗大鼠模型的影响。本文结果初步证实,BBR通过抑制轻度炎症反应进而明显减轻OLA诱导的胰岛素抵抗,其机制之一可能与阻止TLR-4/NF-κB炎症信号通路的激活有关。
BBR具有多种生物活性,例如通过抑制 TLR-4/NF-κB通路[13-15],减轻链脲佐菌素诱导的大鼠肾损伤、炎症反应以及高糖诱导的足细胞凋亡[16];改变肥胖大鼠模型肠道微生物组成并增加肝糖原合成量,进而降低FBG、三酰甘油、低密度脂蛋白胆固醇和胰岛素抵抗等[7,17]。此外Zhao等[18]发现,BBR还可抑制LPS诱导的TLR-4/NF-κB炎症信号通路激活,导致胰岛素受体和胰岛素受体底物-1在肝脏中的表达增加,进而减轻非酒精性脂肪肝引起的肝脏脂肪变性,说明抑制TLR-4/NF-κB信号通路激活可能也是BBR改善胰岛素抵抗的重要分子机制之一。在临床实际中,OLA引起的体重增加可能导致药物依从性差,并增加胰岛素抵抗、糖尿病和心血管疾病的风险。本研究通过大鼠模型证实,连续灌胃8周,BBR(200 mg/kg)可显著降低OLA诱导的IR大鼠模型血清FBG水平和HOMA-IR,并减缓大鼠体重增加速度,且对于肝脏组织和eWAT组织脂肪变性有一定的预防作用。
近年来,炎症在多种因素介导的胰岛素抵抗发病机制中的作用越来越受到重视[19-20]。促炎性细胞因子与胰岛素抵抗的风险增加呈正相关性[21]。在本研究中,OLA可显著增加血清、肝脏组织和eWAT组织中TNF-α、IL-1β、IL-6水平,而OLA+BBR组大鼠TNF-α、IL-1β、IL-6水平则低于OLA组,说明BBR有一定的抗炎作用,这可能是其有助于抑制大鼠IR的重要原因。TLR-4是TLRs家族中的一员,它通过激活炎症途径来调节免疫反应[22]。与相关配体CD14、MD2等结合之后,通过IκB激酶(IκB kinase,IKK)-NF-κB复合物和丝裂原活化激酶(Mitogen activated kinase,MAPK)途径促进下游信号传递,进而负性调节胰岛素受体信号[23]。另外,García-Bueno等[24]在精神分裂症患者体内发现TLR4促炎通路处于激活状态。同时,长期使用OLA会进一步上调TLR-4表达[25],随着时间的推移,这种上调会削弱胰岛素的作用,进而导致胰岛素靶组织(肌肉、肝脏和脂肪组织等)和免疫细胞(单核细胞和巨噬细胞)中TLR-4表达增加和下游信号传导增强,引起胰岛素抵抗。因此,TLR-4/NF-κB炎症信号通路可能是治疗OLA诱导的胰岛素抵抗的有效分子靶点[26-27]。本研究结果表明,BBR能有效抑制OLA导致的TLR4/NF-κB信号通路激活。这也与Zhu等[28]在糖尿病肾病大鼠模型中发现的小檗碱通过抑制TLR4/NF-κB途径改善糖尿病肾病的结论相佐证。
总之,本研究首次应用BBR对OLA诱导的IR大鼠模型进行干预治疗,取得了良好的药效学结果,证实BBR可明显减缓IR大鼠的体重增加速度和炎症反应,可能有助于改善胰岛素抵抗,其作用机制与抑制TLR4/NF-κB炎症信号通路激活有关。但是本研究也存在一定的局限性,一方面该结论无法证实BBR与OLA是否存在药物之间的相互作用;另一方面BBR对于OLA诱导的胰岛素抵抗的改善作用是否还受到其他通路或机制的影响尚不得知,这将是本课题组下一步工作的研究重点。
