丁辛醇工业废水对生物酸化的抑制特性
2021-12-03付龙飞沈志强周岳溪
付龙飞,沈志强,李 杰,周岳溪
(1. 兰州交通大学 环境与市政工程学院,甘肃 兰州 730000;2. 中国环境科学研究院 环境基准与风险评估国家重点实验室,北京 100012;3. 中国环境科学研究院 环境污染控制工程技术研究中心,北京 100012)
丁辛醇(BOA)是重要的有机化工原料和化学助剂原料[1]。BOA工业生产废水排放量大、污染物浓度高、成分复杂,是难降解有机废水的典型代表[2]。目前BOA废水的处理方法主要有酸化萃取法、空气催化氧化法、吸附沉降法和减压蒸发浓缩法等[3]。徐金球等[4]采用酸化萃取法处理BOA缩合废水,COD去除率达86%。姜力夫等[5]采用固定床空气催化氧化法处理BOA缩合废水,COD去除率达75%。兰州研究院环保所的研究人员采用光化学氧化-混凝法处理辛醇废水,COD去除率达70%[6]。上述方法虽能取得不错的处理效果,但成本高、能耗大、易产生二次污染。因此,越来越多的研究者开始探索预处理和深度处理的可能性[7]。
水解酸化技术常被用作难降解废水的预处理工艺[8-9]。水解酸化可分为水解阶段和生物酸化阶段。水解的作用是将多环芳烃、长链烃等大分子有机物和特殊物质分解为小分子有机物;生物酸化的作用是进一步将小分子有机物转化为微生物可直接降解利用的挥发性脂肪酸 (VFA)[10-11]。因此,生物酸化阶段是保证后续处理工艺稳定运行的关键。有学者采用水解酸化工艺在微好氧条件下处理废水,提高了生物降解能力[12-14],但大多都是针对特定废水进行水解酸化效果评价、参数优化以及工艺改进的研究,对于水解酸化过程中微生物的变化并没有进行深入探究,关于生物酸化处理BOA废水的研究更是鲜有报道。
本研究以葡萄糖为共基质,厌氧颗粒污泥为受试生物,考察了加入BOA废水对其COD和TOC的去除,VFA产量,脱氢酶(DHO)、乙酸激酶(ACK)、乙酰辅酶A (ACA)、丁酸激酶(BK)等酶活性和胞外聚合物(EPS)含量的影响,解析了BOA废水对生物酸化抑制过程的原理,以期为BOA废水的处理提供指导。
1 实验部分
1.1 废水水质
实验用水取自某石化工业园区BOA生产装置,pH 13.2±0.2,COD (36454±329)mg/L,TOC(12384±16) mg/L,SS (42.6±0.5)mg/L,TDS (3366.5±22.5)mg/L。主要特征污染物有丁酸、正丁醇、异丁醇、丁醛、2-乙基-2-己烯醛、2-乙基-1,3-己二醇和2-乙基己醇等。
1.2 污泥性能
接种的厌氧颗粒污泥取自某实际运行的厌氧反应装置,以葡萄糖为碳源、NH4HCO3为氮源、K2HPO4为磷源(nC∶nN∶nP=200∶5∶1),在膨胀颗粒污泥床(EGSB)反应器中驯化3个月以上,待其运行稳定后,取驯化后的厌氧颗粒污泥(AnGS)开展BOA废水的抑制性实验,其SS (29.97±2.39)mg/L,VSS (27.26±0.88)mg/L。
1.3 实验方法
取7个经清洗干燥高温灭菌的锥形瓶,依次编号S0~S6,先分别加入20 mL VFA营养盐溶液(见表1)和10 mL葡萄糖溶液(质量浓度100 g/L),再分别向S1~S6加入不同体积的BOA废水,使6个锥形瓶中BOA废水浓度(以COD计,下同)分别为6800,9600,12300,15100,21600,28500 mg/L,不加废水的S0作为空白样,。用35%(体积分数)CO2+65% NO2混合气体吹扫2 min赶走锥形瓶上部空气,同时向锥形瓶中各加入20 mL AnGS,再向各锥形瓶中补充去离子水至200 mL,调整体系初始pH至6.5±0.1,立即用带有50 mL气体收集器的橡胶塞密封,最后将锥形瓶放在25 ℃的恒温水浴锅中[15]。于0,6,12,24,48,72,96 h分别取S0~S6体系中混合液5 mL,立即进行泥水分离,测定上清液的COD、TOC和VFA产量;污泥用来提取EPS,并测定EPS中酶的活性。
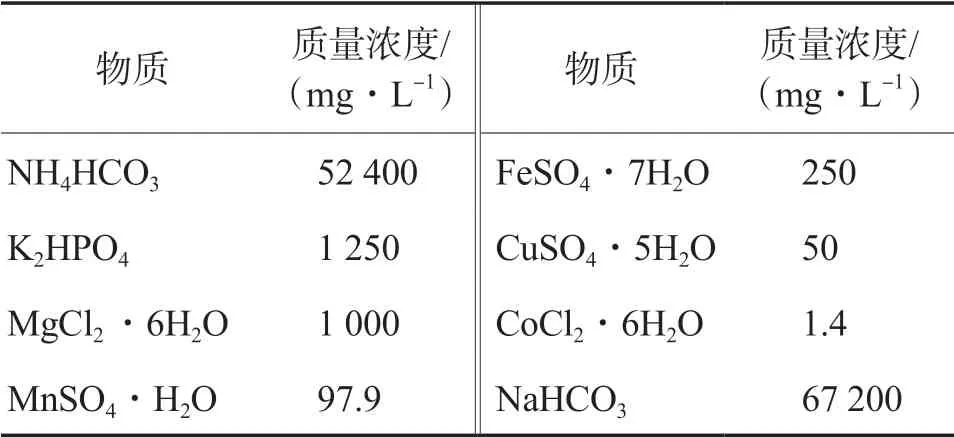
表1 VFA营养盐溶液的组成
VFA中主要组分有乙酸(Ac)、丙酸(Pr)、丁酸(Bu)、异丁酸(Iso-Bu)、戊酸(Va)和异戊酸(Iso-Va)等,将所有VFA组分酸的含量乘以各自的转化因子(Ac 1.07,Pr 1.51,Bu 1.82,Iso-Bu 1.82,Va 2.04,Iso-Va 2.04)转化为理论的COD有效表征[16],并通过厌氧颗粒污泥的比产酸活性(SAA,mg/(g·d))来评估其抑制率(I,%),计算式如下。
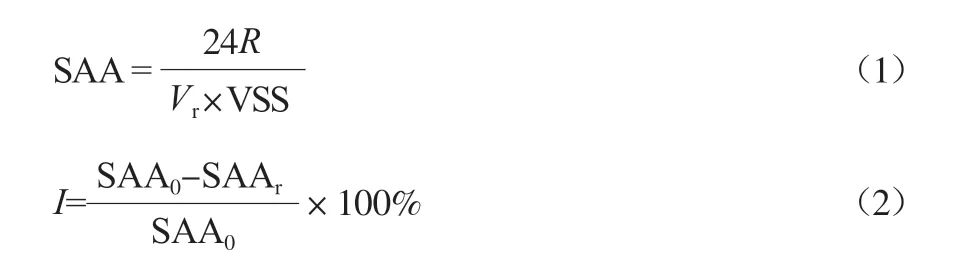
式中:R为最大产酸速率,mg/h;Vr为反应物体积,L;VSS为挥发性悬浮物质量浓度,g/L;SAA0和SAAr分别为空白对照组和实验组的SAA。
1.4 分析表征方法
采用COD快速测定仪(DR1010型,美国哈希公司)测定COD;采用总有机碳分析仪(TOC-L型,日本岛津公司)测定TOC;采用重量法测定SS[17];采用文献[18]中的方法测定VSS和TDS;采用气相色谱仪(7890A型,美国安捷伦公司)测定VFA含量;采用ELISA酶试剂盒(上海酶联生物科技公司)测定酶活性[19];采用热提取法提取EPS[20-21]。
2 结果与讨论
2.1 COD、TOC及其去除率的变化
各体系中COD和TOC随时间的变化情况见图1,COD和TOC去除率的变化情况见图2。由图1和图2可见:各体系中不加BOA废水时起始COD为6100 mg/L,TOC为1990 mg/L;不加BOA废水的体系中,反应96 h后COD去除率为23.8%;BOA废水浓度为6800 mg/L的体系中COD去除率升高至25.5%;继续增加BOA废水浓度,体系的COD去除率明显下降,均低于不加BOA废水时的情况。体系中TOC去除率的变化趋势与COD相同。

图1 各体系中COD(a)和TOC(b)随时间的变化情况

图2 各体系中COD和TOC去除率的变化情况
当体系中加入的BOA废水浓度较低时可促进体系中COD和TOC的去除,这是因为低浓度的BOA废水中毒性物质含量较低,对厌氧颗粒污泥中微生物的抑制作用相对较小;另外,废水中易被降解的小分子化合物(酸类、醇类和酯类)为微生物提供了充足的能源,刺激了微生物的活性,提高了COD和TOC的去除率。随着BOA废水浓度的增加,COD和TOC去除率逐渐降低,因为高浓度BOA废水中含有较多的毒性物质,一是严重抑制了厌氧颗粒污泥中产甲烷劣势菌群的活性;二是抑制了水解酸化优势菌群的活性,使高分子有机物不能被转化成产甲烷菌群易降解并直接利用的小分子有机物。
2.2 VFA及其组分酸产量的变化
2.2.1 VFA产量的变化
BOA废水浓度对VFA产量和I的影响见图3。由图3a可见:各体系在96 h时VFA产量(以VSS计,下同)基本趋于稳定,不再有明显增加,产酸过程基本完成,此外随着BOA废水浓度升高,VFA产量逐渐下降,这是因为BOA废水浓度越高,毒性物质的含量越高,对微生物的抑制和毒害作用越大,导致一部分微生物失活或死亡,从而影响了VFA的产量。
依据图3a并结合式(1)和式(2)计算出不同BOA 废水浓度下的SAA和I,发现随着BOA 废水浓度的逐渐增加,SAA越来越小,I越来越大;当BOA废水浓度为28500 mg/L时I达到88%。依据BOA废水浓度与I的关系,以BOA废水浓度的对数为横坐标,I为纵坐标,采用Bolzman拟合曲线进行拟合,结果见图3b。BOA废水的半效应浓度(EC50,以COD计)为12607 mg/L,根据拟合曲线可知不同浓度BOA废水对生物产酸的抑制程度。

图3 BOA废水浓度对VFA产量(a)和I(b)的影响
2.2.2 组分酸产量的变化
BOA废水浓度对VFA各组分酸产量(以VSS计)的影响见图4。由图4可见:随着BOA废水浓度提高,Ac、Pr、Iso-Bu和Bu产量均明显减少;不加BOA废水的体系中Ac、Pr、Iso-Bu和Bu均在96 h时产量最大,分别为248.2,224.2,59.8,142.5 mg/g;BOA废水浓度为28500 mg/L的体系中,Ac产量在72 h达到最大(54.7 mg/g),而Pr、Iso-Bu和Bu产量在96 h达到峰值,依次为31.6,21.3,17.5 mg/g,此时Ac、Pr、Iso-Bu和Bu仅为不加BOA废水体系的22.0%、14.1%、35.6%和12.3%。可见BOA废水对Ac、Pr、Iso-Bu和Bu的产量抑制程度大小顺序为Bu>Pr>Ac>Iso-Bu。另外,产酸过程中主导酸为Ac,其次为Pr,所以主要的发酵类型为丙酸型发酵。
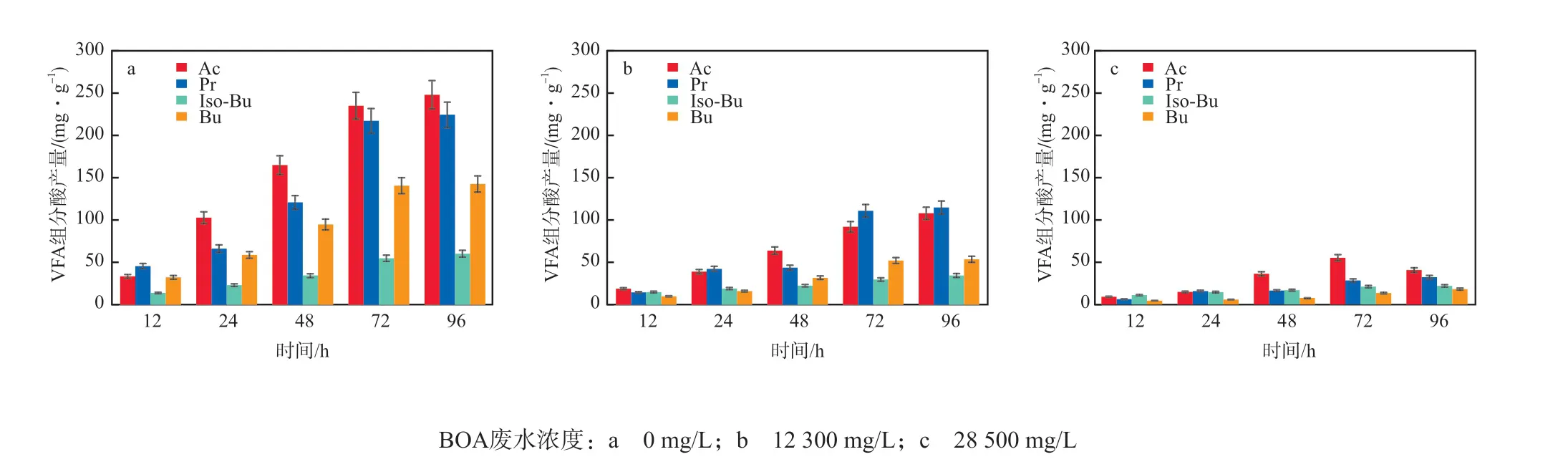
图4 BOA废水浓度对VFA各组分酸产量的影响
2.3 酶活性的变化
BOA废水浓度对DHO、ACK、ACA和BK酶活性的影响见图5。由图5可见,随着BOA废水浓度的升高,4种酶的活性均逐渐降低。高浓度的BOA废水对DHO、ACK、ACA和BK活性抑制显著的原因可能是:第一,BOA废水抑制了厌氧颗粒污泥中微生物的活性,导致酶产量降低;第二,BOA废水中某种特殊的有机物可以使酶发生变性,一部分酶失活。另外,酶活性在反应48 h最高,然后呈现下降趋势,与产酸速率(斜率)的变化趋势基本一致,说明酶活性是影响生物产酸过程中VFA产量变化的重要原因。
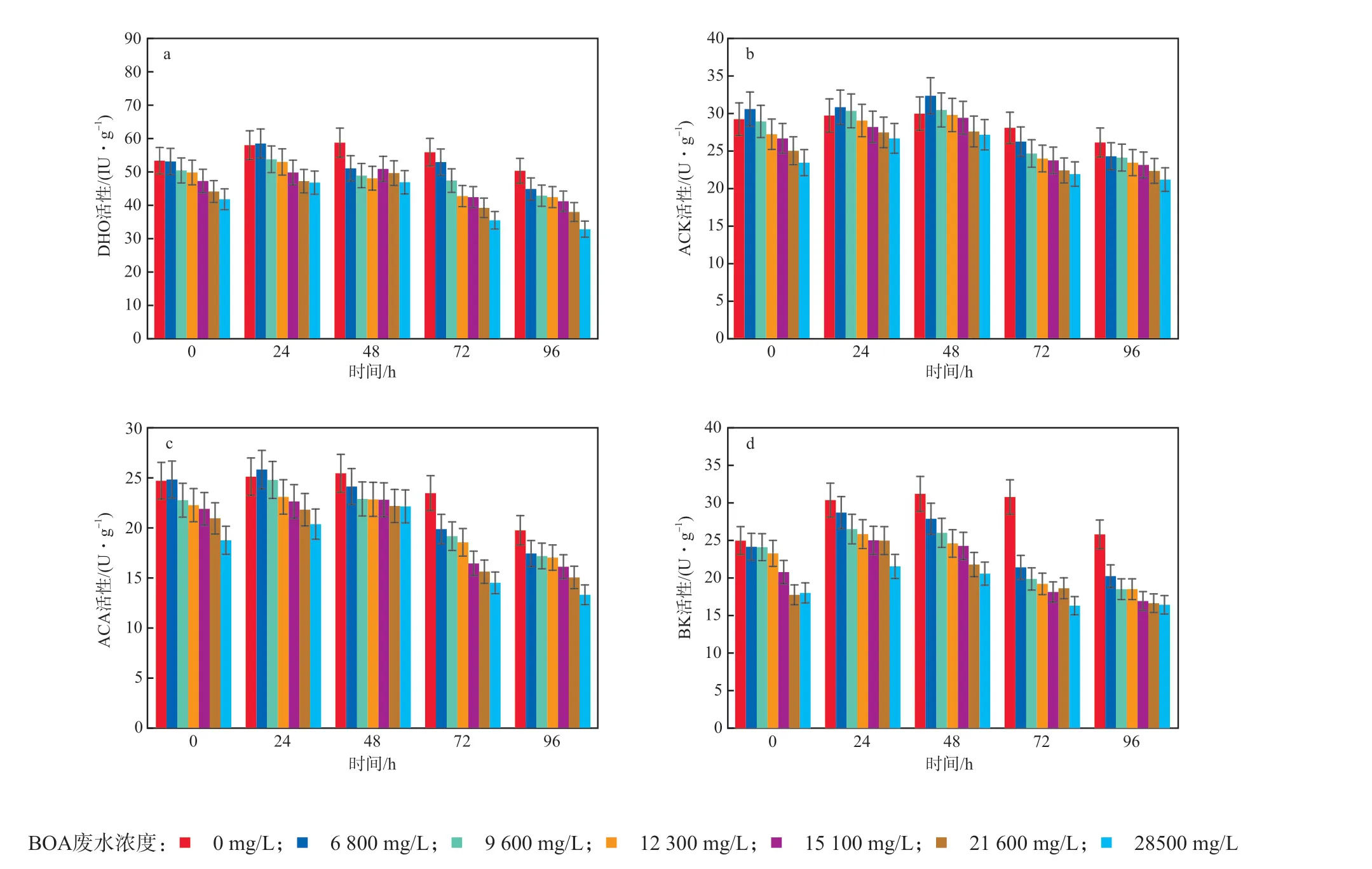
图5 BOA废水浓度对DHO(a)、ACK(b)、ACA(c)和BK(d)酶活性的影响
2.4 EPS含量的变化
EPS一般具有双层结构,内层由紧密结合的EPS (TB-EPS)组成,具有一定的形状,与细胞表面紧密稳定结合;外层由松散结合的EPS (LBEPS)组成,为边缘不明显的松散黏液层[22]。
BOA废水浓度对LB-EPS和TB-EPS含量(以VSS计)的影响见图6。
由图6a可见:当BOA废水浓度≤6800 mg/L时,LB-EPS含量在48 h达到最大;当废水浓度≥9600 mg/L时,LB-EPS含量在24 h达到最大;当BOA废水浓度为28500 mg/L时,其最大LBEPS含量为163.6 mg/g,是不加BOA废水时的2.0倍。由图6b可见:在不同废水浓度条件下TB-EPS含量均在24 h达到最大;BOA废水浓度为28500 mg/L时,其最大TB-EPS含量为155.0 mg/g,是不加BOA废水时的1.4倍。可以看出LB-EPS和TB-EPS含量均随着BOA废水浓度的增加而升高,这是因为BOA废水浓度越高对微生物的抑制程度越大,微生物为了抵御有毒有害物质的侵害,分泌了更多的LB-EPS和TB-EPS形成保护层。另外,LB-EPS和TB-EPS含量在0~96 h内先升高后降低,可能由于24 h前微生物受到了不同程度的抑制;48 h后,低浓度BOA废水的抑制性较小,微生物不断适应外界的生存环境,分泌的LB-EPS和TB-EPS含量减少;而高浓度BOA废水使大量微生物失活,也导致LB-EPS与TB-EPS含量下降。

图6 BOA废水浓度对LB-EPS(a)和TB-EPS(b)含量的影响
3 结论
a)当加入BOA废水浓度(以COD计)≤6800 mg/L时可以促进COD和TOC的去除;随着BOA废水浓度的增加,COD和TOC去除率逐渐降低。
b)随着BOA 废水浓度升高,VFA产量逐渐下降,SAA逐渐减小,I逐渐增大,BOA废水的EC50为12607 mg/L。BOA废水对Ac、Pr、Iso-Bu和Bu的产量抑制程度大小顺序为Bu>Pr>Ac>Iso-Bu,产酸过程中主导酸为Ac,其次为Pr,主要的发酵类型为丙酸型发酵。
c)高浓度的BOA废水对DHO、ACK、ACA和BK的酶活性抑制显著,酶活性是影响生物产酸过程中VFA产量变化的重要原因。
d)随着BOA废水浓度升高,LB-EPS和TBEPS含量均增加,LB-EPS和TB-EPS含量在实验时间内均呈现先升后降的趋势。
e) BOA废水的加入对产酸优势菌群的功能造成了影响,抑制了产酸酶的活性,阻碍了产酸过程中VFA的累积,导致COD和TOC的去除率下降,同时微生物分泌大量的EPS抵御外界毒性物质保护自身免受侵害。
