食品加工环境胁迫因素对单核细胞增生李斯特菌生物膜形成的影响研究进展
2021-12-02孙琳珺刘阳泰林玉海董庆利
王 园,孙琳珺,程 颖,王 翔,刘阳泰,林玉海,董庆利,*
(1.上海理工大学医疗器械与食品学院,上海 200093;2.上海中侨职业技术大学食品药品学院,上海 201514;3.荷美尔食品公司,上海 200436)
单核细胞增生李斯特菌(Listeria monocytogenes)(以下简称单增李斯特菌)是一种兼性厌氧、无芽孢的革兰氏阳性短杆菌,广泛分布于自然环境中,被世界卫生组织列为20世纪90年代食品中四大致病菌之一[1]。食物是单增李斯特菌传播的主要载体,肉类、蛋类、禽类、海产品、乳制品、蔬菜等都是单增李斯特菌污染较高的食物[2]。摄入被单增李斯特菌污染的食物可使人患李斯特菌病,甚至引起疾病暴发,致死率高达20%~30%[3]。
生物膜是细菌在生长过程中为了适应生存环境,分泌黏性胞外聚合物吸附于物质表面,并增殖而形成的具有一定结构的细胞群体[4]。据调查,约80%的细菌感染均与生物膜的形成有关[5],60%的食源性食物中毒暴发事件是由食源性致病菌生物膜引起[6]。单增李斯特菌可黏附在各种接触物表面上并形成生物膜,从而导致产品的持续污染。
细菌生物膜形成是一个动态演变过程,生物膜形成能力会因许多因素而变化。在食品加工储藏过程中,微生物所处的环境复杂多变,诸多因素均会对生物膜的形成产生影响,生物膜的成熟也可能因环境条件而异[7],例如短期的营养缺乏可增强单增李斯特菌的菌体黏附,而长期营养缺乏时则会阻碍生物膜成熟[8]。当胰蛋白胨大豆肉汤(tryptone soy broth,TSB)培养基中NaCl含量增加时,单增李斯特菌生物量显著增加[9]。单增李斯特菌在恶劣环境中能长时间生存(持久性)也可能与生物膜的形成有关,形成生物膜可能是对胁迫环境的适应性反应[10]。实际上,在食品加工及储藏过程中,冷藏、高盐度、干燥、酸处理以及消毒剂等处理使微生物长期处于胁迫环境下。环境胁迫是指在自然界或食品加工和保藏过程中,环境条件对微生物的生长和存在产生了一定程度的威胁和制约[11]。值得注意的是,经各种处理后,生物膜仍可在设备表面残留,并在环境适宜时脱落出细菌菌体,成为潜在污染源,进一步造成交叉污染,引发严重的食品安全问题。环境条件对生物膜的影响极其复杂,不同的环境因子组合下形成的生物膜差异较大。此外,细菌暴露于胁迫条件下,可能提高其对其他胁迫条件的抗性[12]。生物膜的形成使细菌菌体对环境压力的抵抗能力大大增强,常规方法难以清除生物膜,残留的生物膜可发展形成新的生物膜,生物膜形成处成为交叉污染的中心,进而对食品安全产生极大威胁。因此十分有必要研究不利条件下单增李斯特菌在设备表面附着和生物膜形成的情况。
本文针对不同胁迫条件对单增李斯特菌生物膜形成的影响进行全面综述,同时深入探讨胁迫环境下生物膜的变化机制,并对未来的研究方向作出展望,有助于针对性地制定预防和控制生物膜的策略。
1 单增李斯特菌生物膜形成能力
不同分离源、不同谱系以及血清型的单增李斯特菌生物膜形成能力有所不同。根据遗传指纹图谱和致病潜力,单增李斯特菌可分为4 个不同的谱系。基于菌体/鞭毛抗原(O/H)血清学反应,单增李斯特菌被分为13 种血清型,其中血清型1/2a、1/2b、1/2c和4b经常分离于食品及患者标本中。血清型或谱系与生物膜形成能力之间的关联一直存在争议。已报道的我国食源性单增李斯特菌中,1/2c血清型居多,且不同压力条件下1/2c血清型生物膜形成能力强于其他血清型[13],这可能是1/2c血清型在我国分离率较高的原因。1/2a和/或1/2c菌株(谱系II)的生物膜形成能力强于4b菌株(谱系I)[14-15],然而Djordjevic等[16]研究发现谱系I菌株的生物膜形成能力强于谱系II。研究结果的差异性可能是由于菌株差异、研究条件以及培养介质不同。Kadam等[17]研究了143 株不同血清型、不同分离源的单增李斯特菌生物膜的形成情况,结果显示,血清型对生物膜的形成有显著影响,而菌株的分离源对生物膜的形成水平没有显著影响。目前,评估生物膜表型的种内多样性的研究集中于将表型与菌株的谱系、血清型或来源相关联,而这些评估方式可能无法反映生物膜形成的种内多样性。
基于特定基因型的研究,如多位点序列分型(multilocus sequence typing,MLST)定义的基因型,可能揭示出与生物膜表型更紧密的联系。近来,Maury等[18]发现低毒力型单增李斯特菌克隆CC121和CC9在亚致死浓度苯扎氯铵处理下的生物膜生成量更高;10 ℃下,CC26型菌株的生物膜形成能力明显高于其他CC型,低温能增强CC26菌株的生物膜形成能力,而CC7型的菌株在所有条件下均表现出较弱的生物膜形成能力[8],这意味着某些基因型在特定条件下具有适应性优势。MLST分型与生物膜形成能力和生物膜结构相关性仍需进一步研究。
单增李斯特菌的生物膜形成能力具有较强的菌株特异性。Weiler等[19]研究表明单增李斯特菌生物膜的形成和附着与血清型无关,而是具有菌株特异性。纯培养条件下,单增李斯特菌菌株之间生物膜形成能力差异很大[20],且形成生物膜的结构也因菌株而异。一些系统发育密切相关的菌株(包括相同基因型的分离株)之间生物膜形成能力存在较大差异,较小的遗传变异可能会影响生物膜表型。有些菌株能更有效地附着在表面,而随后不一定形成更多的生物膜,甚至相似来源的菌株也表现出不同的生物膜行为[21]。属于同一脉冲电泳型的分离株生物膜形成能力不同,这表明生物膜形成能力取决于菌株[22]。而同一株单增李斯特菌在不同条件下的生物膜形成量显著不同,表明菌株的表型变化可能取决于环境条件[23]。为更准确地开展生物膜形成的种内多样性研究,应充分掌握单增李斯特菌的种内变异性和环境因素对种内变异性影响的信息。
2 食品加工环境胁迫因子对单增李斯特菌生物膜形成的影响
单增李斯特菌生物膜的形成除受以上微生物内在因素的影响,还受食品加工储藏过程中冷藏、干燥、酸处理、消毒剂等环境因素的影响。
2.1 冷胁迫
冷胁迫包括0~12 ℃之间的冷胁迫和0 ℃以下的冷冻胁迫。4 ℃下单增李斯特菌可在3 h内附着在食物接触物表面[24],并在24 h后形成稀疏细胞簇组成的生物膜[25]。研究表明单增李斯特菌在玻璃表面的生物膜形成显著依赖于培养温度和时间,4 ℃下单增李斯特菌在不锈钢、玻璃表面均可形成生物膜,且随着培养时间的延长,生物膜数量逐渐增加[26]。Iñiguez-Moreno等[27]也得到了同样的研究结果,9 ℃下单增李斯特菌数量在生物膜形成的过程中呈线性增长,细胞间相互作用形成复杂且高度结构化的生物膜。然而,di Bonaventura等[25]研究表明,4、12 ℃下单增李斯特菌仅形成由稀疏细胞簇和少量胞外聚合物(extracellular polymeric substances,EPS)组成的基础生物膜结构,可能是低温下细菌存活率降低导致的。当前研究主要比较了常见温度范围4~37 ℃对单增李斯特菌生物膜形成的影响,尽管研究结果存在争议,但均表明单增李斯特菌可在低温下存活并形成生物膜。
单增李斯特菌是一种嗜冷菌,不仅能在0~4 ℃的低温环境下生存,甚至当温度低于0 ℃条件下仍可繁殖。研究表明冷应激会导致单增李斯特菌对食品接触表面的黏附力增强,增加了食品污染的几率[28]。Miladi等[29]研究发现,经过-20 ℃的冷冻胁迫后,单增李斯特菌的黏附能力增强,并能够产生黏液。单增李斯特菌生物膜存在的时间与其低温环境下的生长繁殖能力有关。低温下单增李斯特菌仍可形成生物膜黏附在各种表面,降低各种杀菌清洗手段的效率,其可在食品工业设备和环境中持续存在数月甚至数年。
2.2 营养胁迫
饥饿生存被定义为“微生物在产能底物缺乏时的生存过程”[30]。在加工处理食品的过程中,通常会按照特定的程序对食品原料或产品进行数次清洗、消毒,使微生物暴露于消毒剂、脱水及营养物质缺乏的条件下。
黏附是生物膜形成的第一步,Lee等[28]观察到无论培养温度如何,营养缺乏都会对单增李斯特菌的黏附产生积极影响,然而并未促进生物膜的成熟,营养水平对不同阶段生物膜的影响可能不同[30]。如细菌与基质之间的疏水性和界面力等理化特性会影响细胞附着,且营养胁迫可能会引发细胞表面特性改变,从而导致黏附力增加。营养缺乏可能刺激单增李斯特菌和沙门氏菌形成生物膜[31-32]。Folsom等[33]研究了营养水平对不同菌株生物膜形成能力的影响,11 种菌株在TSB培养基和稀释的TSB(diluted TSB,DTSB)培养基中具有相同的生物膜形成能力,14 种菌株在TSB培养基中比在DTSB培养基中形成更多的生物膜,5 种菌株在DTSB培养基中比在TSB培养基中形成更多生物膜,可见营养水平和菌株的交互作用对生物膜的形成有显著影响。营养缺乏胁迫时,常观察到细菌尺寸减小,同时细胞形状从杆状变为球状[30],这种形态上的收缩变圆可能增加细胞吸收营养的能力。实际上,细菌适应恶劣环境的一种常见方法是其形态发生改变。
2.3 酸胁迫
食品加工过程中常形成低pH值环境,如使用酸性洗液和酸性食品添加剂等。单增李斯特菌生物膜形成能力也受pH值的影响,其疏水性和表面黏附力随着环境pH值降低而增加[34]。然而Barbosa等[35]研究发现单增李斯特菌1592/2暴露于酸性亚致死条件后,其在37 ℃条件下形成生物膜的能力下降。不同来源单增李斯特菌在pH 4.2、5.5、6.5下均可形成生物膜,然而随着pH值的降低,生物膜的生成量逐渐减少[36]。研究表明短期弱酸胁迫可以增强肠炎沙门氏菌的附着力,而长期强酸胁迫能够显著降低细胞的附着力;与对照组相比,长期弱酸和强酸胁迫均显著抑制了肠炎沙门氏菌生物膜的形成[37]。王娴静等[38]的研究表明,酸性条件对大肠杆菌O157:H7的生物膜形成过程具有抑制作用。这一发现可通过细胞与环境pH值动态作用来解释,当环境pH值降低时导致膜质子泵活性增加,从而将H+从细胞质中排出,因此细胞内能量消耗主要是用于避免内部酸化,进而降低黏附和生物膜形成过程中涉及的生理过程的速率。
通过MOSA求解面向广义能耗的调度优化问题的初始解,包括采用随机方式选取子批量的加工批量、工艺路线、工序选择的加工机床、刀具和搬运设备,以及通过先到先服务(First Come First Served, FCFS)规则选取工序选择的夹具和安排子批量在机床上的加工顺序。根据上述方式生成调度方案的初始解R0,并通过广义能耗和完工时间目标函数计算柔性作业车间广义能耗F1(R0)和完工时间F2(R0)。
值得关注的是,当微生物暴露于酸性应激条件之后其对该胁迫条件或其他胁迫条件的抗性会提高,从而导致“交叉保护”。酸适应增强了单增李斯特菌对不锈钢表面的附着能力,同时还能提高附着细胞对极端酸处理[39]和次氯酸钠[40]的抵抗力。因此,在应用酸性去污剂清除单增李斯特菌黏附体时应考虑“胁迫强化”。
2.4 渗透胁迫
盐是使用最广泛的天然防腐剂,单增李斯特菌在许多食品中生存均必须克服由食盐产生的渗透胁迫。单增李斯特菌能适应周围环境中水分活度的变化,NaCl能诱导生物膜的形成。在不同温度[41]、不同培养基[42]条件下,当培养基中补充NaCl时,可促进生物膜的形成,并导致单增李斯特菌聚集程度急剧增加。Lee等[28]的研究结果表明在营养丰富或营养缺乏条件下增加盐浓度均能导致生物膜形成量显著增加,表明盐分添加和营养缺乏可促进生物的膜形成,且营养物质的缺乏会增强氯化钠对生物膜成熟的积极作用。而在Barbosa等[35]研究发现,5 株单增李斯特菌菌株在遭遇亚致死渗透压胁迫后,生物膜形成能力没有发生显著变化,研究结果的不同可能是由于所使用的NaCl浓度差别以及所选择的菌株差异性较大。
在高盐条件下,单增李斯特菌的生物膜中细胞呈长链状[43]。当单增李斯特菌培养液中NaCl质量分数高于5%时,观察到菌体细胞在较低水分活度胁迫下不能分裂,这些伸长的细胞实际上接近分裂状态,当转移到更有利的条件下,就会分裂成单个细胞并开始生长[44]。对于食品加工环境中的渗透胁迫,单增李斯特菌已进化出多种应对机制,包括拉伸激活或由拉伸激活介导细胞质溶质和水由细胞膜通道流出,可避免在渗透胁迫下大量水流入细胞质而引起的细胞裂解。
2.5 干燥胁迫
在食品工业中,在日常清洁消毒后常伴随风干处理,其目的是干燥食品表面,避免由于食品接触表面水凝结导致微生物凝聚而引起污染。单增李斯特菌在可在相对湿度43%的条件下存活长达3 个月[45],食盐、有机物质残留和相对湿度的增加可提高单增李斯特菌在干燥条件下的存活率。生物膜可经受一段时间的干燥并适应周围环境。
干燥对不同生长阶段单增李斯特菌生物膜的影响不同。成熟生物膜细胞与未成熟生物膜细胞相比在干燥环境中的存活率显著提高,且当生物膜发育至一定阶段后,进一步成熟导致的结构复杂性增加并不会提高单增李斯特菌的存活率[43]。此外,单增李斯特菌的抗干燥性受遗传因素的影响。对分离自水、食品和血液的不同单增李斯特菌生物膜形成能力及其干燥抗性进行研究时,依据干燥后菌株生物膜的活菌数减少量,将菌株分为干燥敏感型菌株、中等敏感型菌株以及耐干燥菌株[46]。生物膜细胞干燥抗性的提高可能是通过细胞代谢、细胞膜组成改变、生物膜基质的保护作用实现。
2.6 消毒剂胁迫
在食品加工环境中,不同的消毒剂,例如季铵化合物、过氧化氢、过氧乙酸和次氯酸钠广泛用于食品接触表面清洁。生物膜对消毒剂抗性的评估是当下研究者广泛关注的热点。
另一方面,消毒剂对细菌生物膜作用效果受其他环境因素的影响(表1)。Moorman等[50]研究了应激处理后英诺克李斯特菌对季铵盐消毒剂敏感性的变化,结果表明酸胁迫和饥饿胁迫提高了该菌的存活率,而热胁迫和冷胁迫降低了其存活率。饥饿的单增李斯特菌对季铵盐类消毒剂的敏感性降低[51]。饥饿胁迫使细胞膜的流动性和渗透性降低,增加了表面疏水性。细胞疏水性等表面特性与细胞黏附特性及生物膜的形成有密切关系。生物膜态的细胞对杀菌剂的响应不仅与胞外多糖和周围营养物质的机械保护作用有关,同时与生物膜细胞对胁迫适应性等内在生理因素有关。Belessi等[52]发现低温下形成的单增李斯特菌生物膜对过氧乙酸更敏感,Barroso等[53]也发现了类似的结果。然而Pang Xinyi等[54]发现单增李斯特菌在4 ℃下培养14 d时产生的生物膜对消毒剂的抗性与15 ℃下无显著差异,上述研究结果的差异可能是不同温度下附着的细胞数量不同所引起的。然而目前消毒剂的功效通常取决于对理想条件下培养的浮游微生物的杀灭效果。因此,食品生产者在制定清洁消毒方案时,不仅需要构建消毒剂对浮游细菌和相关生物膜清除的综合控制方案,还应充分考虑环境因素设定清洁、消毒标准。
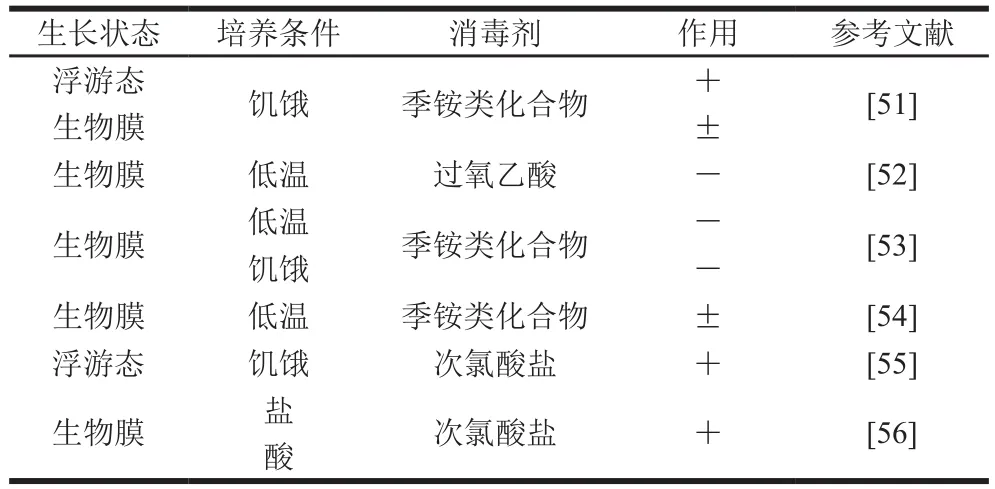
表1 不同条件下消毒剂对单增李斯特菌的作用效果Table 1 Effect of disinfectants on Listeria monocytogenes under different conditions
3 环境胁迫条件对单增李斯特菌生物膜形成影响的机制
细菌生物膜的抗胁迫机制不同于游离态细菌的抗胁迫机制。研究生物膜的形成机制须与其环境因子密切联系起来,不同环境条件下生物膜形成的机制与途径不相同[57]。单增李斯特菌生物膜的形成是一个复杂的过程,为了适应外界环境变化,单增李斯特菌可通过膜流动性改变、转录调控、群体感应系统调控、鞭毛及胞外分泌物合成等途径使其在不利条件下仍可存活。当微生物应对不良或压力条件时,多种遗传和生理机制改变。
3.1 膜流动性相关的适应机制
当微生物暴露于各种环境压力时,包括细胞膜流动性、细胞疏水性在内的细胞表面特性会发生改变。细胞膜流动性在营养运输、细胞形态、抵御外部不利环境侵害等多种细胞生理功能中发挥重要作用。此外,细胞膜流动性与其适应各种环境压力密切相关[58],细胞膜脂质双层流动性主要通过调节膜脂肪酸组成来改变。在不利环境下,革兰氏阴性菌主要通过调节不饱和脂肪酸与饱和脂肪酸的比例、环丙烷脂肪酸合成或通过顺/反异构化来改变其膜流动性;革兰氏阳性菌通过改变脂肪酰基链长度或形成支链脂肪酸(branched chain fatty acid,BCFAs)、改变不饱和/饱和脂肪酸比例来改变其膜流动性[59]。在不利条件下微生物能够通过膜流动性相关的适应性策略继续生存。
单增李斯特菌细胞膜由不常见的脂肪酸组成,尤其支链脂肪酸的比例较高[60]。当单增李斯特菌在低于10 ℃下生长时,细胞中的反异-支链脂肪酸(anteiso-BCFAs)尤其是anteiso-C15:0含量增加,从而保证适当的膜流动性[61]。同样,在碱性条件下,主要是由于BCFAs含量增加导致膜流动性提高,从而有助于菌体存活。相反,在酸性条件下,BCFAs含量下降,膜流动性降低,从而产生对酸胁迫的抗性[62]。而当病原体反复暴露于亚致死水平的消毒剂时,膜脂肪酸中饱和脂肪酸含量增加,使膜的流动性下降,导致单增李斯特菌在消毒剂存在时得以生长[63],尽管流动性降低会减少初始表面附着量,但在后期仍有较多生物膜形成。最新研究表明,生物膜内细胞的脂肪酸含量与浮游细胞的脂肪酸含量不同,生物膜细胞中饱和脂肪酸含量比浮游细胞高,而BCFAs含量明显低于浮游细胞,从而导致更高的相变温度、堆积密度和双层稳定性[64]。生物膜的这些生理变化使其能适应各种应激条件,从而提高细菌存活率和对抗菌药物的抵抗力。
3.2 生物膜相关蛋白表达的调控机制
分泌蛋白作为连接细胞与周围环境的功能决定因子,可参与单增李斯特菌在非生物和生物表面的定植过程。Combrouse等[65]定量分析了单增李斯特菌生物膜胞外成分,发现胞外物质中蛋白质的含量最高。采用蛋白酶处理生物膜能够抑制生物膜的发育或诱导细胞的扩散[66-67],表明蛋白质在生物膜发育和维持中具有重要作用。
生物膜内部蛋白——内化素A(internalin A,InlA)和生物膜相关蛋白L(biofilm-associated protein L,BapL)都是细胞外基质的一部分[68]。InlA是细胞壁结合蛋白,也是参与宿主细胞黏附和侵袭的主要成分之一。一些单增李斯特菌菌株分泌截短的非功能形式的InlA。与表达全长InlA的菌株相比,表达截短InlA的菌株生物膜形成能力显著增强[68]。这种截短的分子完全释放在细胞外介质中,可能成为生物膜基质的一部分。生物膜相关蛋白Bap在金黄色葡萄球菌的生物膜形成中具有重要作用,BapL是一种细胞壁锚定蛋白,与Bap相似,可促进一些单增李斯特菌菌株的黏附,参与其生物膜形成过程[69]。BapL可促进某些单增李斯特菌的附着,但其在生物膜形成过程中的作用尚未明确。最近又发现了一类内部蛋白——内化素L(internalin L,InlL)参与了单增李斯特菌EGD-e的初始细菌黏附和固着发育[70]。考虑到生物膜形成受多因素影响,当对编码结构蛋白的单个基因进行突变时,通常可引起一定的表型变化,因此,在对单增李斯特菌中负责调节生物膜形成的基因决定簇的特性分析仍然是一个关键的挑战。
3.3 基于基因调控表达的机制
单增李斯特菌的环境适应能力依赖于其具有的环境适应因子和环境适应调节因子[71]。表2总结了单增李斯特菌生物膜形成过程中相关功能基因。

表2 单增李斯特菌生物膜形成过程中相关功能基因/蛋白Table 2 Functional genes/proteins related to the formation of Listeria monocytogenes biofilm
在单增李斯特菌中已鉴定出许多对应激反应和毒力基因调控很重要的转录调节因子,如SigB、HrcA、PrfA等。已有研究表明在单增李斯特菌中,SigB介导特定基因的表达,使其能在低pH值、氧化、乙醇、高渗透压、高温、低温等环境胁迫压力下生存[81]。Becker等[82]研究表明转录因子SigB参与了单增李斯特菌在低温环境下的适应过程。研究表明在相同的培养条件下,sigB缺失菌株生物膜的形成能力低于EGD株,添加0.3%胆汁酸盐可以在一定程度上促进EGD株生物被膜形成,而使sigB缺失菌株生物被膜形成能力略有降低[72]。应激反应基因ltrC也参与了单增李斯特菌在低温下的生长和适应过程,ltrC受SigB调控,其在1/2a血清型的单增李斯特菌中转录水平高于ΔsigB突变株[73]。低温等胁迫因素可诱导SigB产生活性。SigB在单增李斯特菌环境适应和生物膜形成过程中具有重要作用。
SigB正调控II类应激反应基因,而HrcA负调控I类应激反应基因[83]。hrcA及dnaK对于单增李斯特菌静态生物膜形成以及消毒剂抗性具有重要作用[74],与野生型菌株相比,ΔhrcA突变株生物膜形成量增加,提示此突变体中I类热休克反应的激活对静态生物膜的形成有利。
此外,细菌的毒力和环境适应能力密切相关。SigB对众多的毒力因子具有调节作用,并且与重要的毒力调节因子PrfA关系密切[84]。研究表明ΔprfA突变菌株的生物膜形成能力变弱[75],表明毒力调节因子PrfA对单增李斯特菌生物膜的形成具有促进作用。prfA及受其控制的其他毒力基因,如hly、mpl、plcA、plcB和actA等在37 ℃条件下转录更加高效[76]。然而,prfA也可在低温下转录,转录因子PrfA可以根据生长温度在活性和非活性之间切换[85]。溶血素基因hly是单增李斯特菌所必需的毒力基因,其在7 ℃和37 ℃下培养的不同血清型单增李斯特菌中均可很好地转录[86]。sigB和prfA会根据环境条件进行转录,其活性受pH值、温度和细菌生长条件的影响。
鞭毛对单增李斯特菌的初始黏附具有重要作用。参与单增李斯特菌附着的主要基因包括鞭毛合成和运动相关的基因flaA、fliP、fliG、flgE、motA、motB和mogR[87]。一旦细菌细胞附着后,生物膜的进一步成熟需要依靠细菌细胞之间的群体感应效应。有两部分系统参与细菌的群体感应和生物膜形成的调控[88],一部分为多效响应调节因子DegU,可以调节单增李斯特菌生物膜的形成。单增李斯特菌鞭毛合成及细菌运动性都受到DegU的调控,DegU可以使细菌在高温下黏附于塑料表面生长繁殖并形成生物膜[78],此外,DegU与单增李斯特菌致病性、耐药性以及持久性有关;另一部分为依赖Agr调节的群体感应系统,其在单增李斯特菌生物膜的发展过程中也起关键作用[89]。Agr操纵子可以调控毒力因子的表达,正向调控单增李斯特菌生物被膜的形成,并参与早期生物膜形成的黏附过程。与野生菌株相比,ΔagrA和ΔagrD突变菌株在聚苯乙烯表面上形成生物被膜的能力明显降低[79]。Agr可以直接调控单增李斯特菌生物膜形成,还可通过调控单增李斯特菌毒力因子的表达间接调控生物膜的形成。
EPS包括蛋白质、多糖及核酸等物质,是生物膜的主要组成成分,在生物膜形成过程中EPS参与细菌的黏附过程,其形成量和性质与生物膜结构有重要的关系[90]。磷壁酸是李斯特菌生物膜基质的主要成分。革兰氏阳性菌的dlt操纵子包括dltA、dltB、dltC、dltD4 个基因,它们催化D-丙氨酸残基并入细胞外脂磷壁酸[91]。研究表明dltA、dltB、dltC、dltD和phoPR突变体的生物膜形成能力降低,脂磷壁酸的D-丙氨酸化作用的丧失会改变细菌细胞表面电荷,减少单增李斯特菌的附着和生物膜形成[80]。环境中营养缺乏时,低浓度的无机磷酸盐信号可被双组分系统phoPR感应,从而调节生物膜形成。
综上所述,以往的研究多集中在与单增李斯特菌生物膜形成有关的已知功能的单个或多个基因上。然而,功能未知基因通常代表生物膜中30%~50%的差异表达基因[92],而与生物膜相关的全新功能基因的解析仍较少。Stanley等[93]研究发现生物膜和浮游培养物中55%以上差异表达基因仅在一个时间点表达。上述机制突出了参与生物膜细胞形成因素的多样性。总而言之,微生物在压力条件下能够激活多种遗传机制,使其可在不利环境中保持活力和致病性。
4 结 语
单增李斯特菌可在胁迫条件下形成生物膜黏附于物体表面,抵抗不利环境,从而引起食品持续污染。单增李斯特菌生物膜的形成受菌体自身和外界环境因素的双重影响。然而随着对胁迫反应逐渐深入了解,发现其具有复杂性,因此,研究各种条件下单增李斯特菌生物膜的形成和变化机制对于食品加工中微生物的安全控制具有重要意义,将来可从以下3 个方面开展。
第一,从整个系统的角度开展分析单增李斯特菌与共存微生物间相互作用对菌群动态及胁迫耐受性影响的研究。食品加工环境影响食品相关的微生物群落组成,在真实环境条件下,单增李斯特菌往往以多菌株状态形成混合生物膜,仅研究某一种菌在胁迫条件下的变化不能真实地反映其在食品加工环境中所处状态。
第二,在了解生物膜空间复杂性的同时,对生物膜内基因和蛋白质表达的动态维度研究有助于揭示生物膜形成及变化的真实规律。对功能未知基因以及转录组学和蛋白组学的动态变化进行研究将有助于破译生物膜形成的复杂机制。
第三,多重胁迫通常发生在食品加工和储藏过程中,例如低pH值和高盐浓度的处理组合,充分研究各种胁迫在时空上的综合效应,设计更为严格的综合控制方案将是未来控制单增李斯特菌污染的主要研究方向。此外,开发环境友好型抗菌方法,包括利用酶溶液、噬菌体或微生物分泌的抗菌化合物来进行微生物控制,仍然是一个有吸引力的挑战。对胁迫反应的研究有助于全面了解微生物生理活性以及开发新的抗微生物制剂和制定新的食品安全措施。
