对氯硝基苯高选择性还原催化剂的研究进展
2021-12-02尹泽群孙立波
尹泽群,张 杰,张 岩,宋 薇,孙立波
(烟台大学 化学化工学院 山东省黄金工程技术研究中心,山东 烟台 264005)
对氯苯胺(p-CAN)是一类重要的化工中间体,广泛应用于染料、医药、农药及其他精细化学品行业,是偶氮染料、色酚AS-LB的中间体,也是合成利民宁、非那西丁等药物的中间体[1]。p-CAN一般由对氯硝基苯(p-CNB)还原制得,常用的还原方法有:1)铁粉还原法,该方法工艺成熟、操作简单、副反应少,但铁粉耗用量大,污染环境,设备腐蚀严重,难以连续化生产,产物分离困难[2];2)电化学还原法,该方法工艺流程短、产物选择性高、污染小、反应条件温和,但工业化受到技术及能耗的限制难以实现[3];3)水合肼还原法,该方法选择性高、收率高、三废排放少,但水合肼价格昂贵,毒性大[4];4)硫化碱还原法,该方法所得产物易于分离、生产周期短、对设备的腐蚀性较小,但废水污染环境的问题较为突出,成本高且收率不高[5];5)催化加氢还原法,该方法废气、废液排放量少,产物与催化剂体系易分离,反应条件温和,能耗小,产品纯度好,催化剂可循环使用[6],符合绿色化工的发展趋势,受到人们的广泛关注[7]。Yang等[8]合成了一系列不同金/钯摩尔比的AuPd/m-SiO2纳米粒子,Pd/m-SiO2催化反应中p-CAN的选择性为42%、苯胺(AN)的选择性为55%,而金/钯摩尔比为1时,AN的选择性达94.7%,表明双金属催化剂的选择性是可调的。Zhang等[9]制备了Pd/C催化剂,在p-CNB加氢反应中,当Pd的粒径大于5 nm时,催化剂前80 min内活性很低,300 min后才有明显的反应;当Pd的粒径为0.9 nm、p-CNB转化率70%时,p-CAN的选择性保持在80%;随着转化率提高至100%,p-CAN的选择性降至75%,而AN的选择性从9%增加至25%。在p-CNB加氢制备p-CAN的反应中,脱氯是最严重的副反应,因此,研究活性高且选择性好的催化剂尤为重要。目前,p-CNB选择性加氢催化剂多数是以Ni,Pt,Au等为主要活性组分的负载型催化剂。
本文综述了不同纳米金属催化剂在p-CNB选择性加氢还原反应中的应用,分析了p-CNB的加氢反应历程,重点阐述了金属本身的性质及与载体间的相互作用对催化剂性能的影响。
1 p-CNB催化加氢历程
p-CNB催化加氢反应是一个复杂的过程,包括几个平行反应和一系列的连串反应,反应历程如图1所示。

图1 p-CNB催化加氢历程Fig.1 The hydrogenation pathway of p-chloronitrobenzene(p-CNB).
反应一般先生成对氯亚硝基苯,进一步加氢生成p-CAN,过度加氢则会脱氯生成AN;也可能单体偶合产生4,4'-二氯氧化偶氮苯、4,4'-二氯偶氮苯、4,4'-二氯氢化偶氮苯等副产物;p-CNB氢解失去卤原子产生硝基苯。硝基加氢和C—Cl键氢解是竞争关系,—NO2的相对活泼性使硝基优先吸附和氢化,但在强活性催化剂下,C—Cl键氢解难以避免。氢分子在催化剂活性位的吸附和活化影响—NO2和C—Cl的氢解,活性位的电子特性影响活化氢的电子状态,富电子的活化氢容易进攻—NO2,发生亲核取代,缺电子则容易进攻C—Cl键发生亲电取代反应[10]。
在p-CNB加氢过程中,当发生C—Cl键的氢解反应时,会有盐酸和AN生成,降低产物收率的同时生成的酸也会对设备造成腐蚀,还为产物的分离增加了难度。脱氯副反应是影响p-CAN收率的关键因素,要想实现p-CAN的高选择性必须抑制脱氯副反应的发生。
2 金属催化剂
2.1 Ni基催化剂
Ni催化剂成本低,在催化加氢、甲烷化、水煤气转换等反应具有良好的催化性能。Ni催化加氢制备p-CAN在工业上的应用较成熟,常见的是雷尼镍催化剂,但雷尼镍催化剂在空气中极易着火,无法保存,只能与铝形成合金,使用前用碱溶掉铝,活化后的雷尼镍具有易燃性,反应需在惰性气体环境中进行,操作过程存在燃烧、爆炸等安全隐患。一般认为,Ni粒子表面为催化反应的唯一场所,使Ni粒子表面有理想的几何形状和电子性能一直是Ni基催化剂面临的一项挑战[11]。Beswick等[12]制备了Ni/活性碳纤维(Ni/ACFs),Ni/ACFs比传统的雷尼镍活性高,经硝酸预处理后,不影响Ni0的分散,同时功能性含氧基团的增多提高了催化剂的活性。Huang等[13]制备了TiO2修饰的氧功能化的活性炭负载Ni催化剂Ni/TiO2@OAC,表征结果显示,TiO2的引入抑制了Ni纳米粒子的烧结,提高了催化剂的稳定性。XPS表征结果显示,Ti3+的给电子效应增加了Ni表面的电子密度,这种界面电子效应不利于C—Cl吸附,Niδ-可能诱导富电子氢的形成,生成的H-更倾向于对—NO2亲核进攻,此外,载体中—OH与芳胺中—NH2的相互作用会降低—NH2给电子的能力,因此,脱氯反应受到抑制。它在o-CNB,m-CNB,p-CNB加氢中都表现出优异的催化性能。学者研究发现,非晶态的NiB近程有序、远程无序的独特结构,使其存在较多的表面配位不饱和位点和较多的晶体缺陷,比相应的晶体催化剂有更高的活性和选择性[14]。梅华等[15]通过浸渍-还原法制备了NiB/Al2O3催化剂,研究了Ni负载量、反应温度、压力对p-CNB加氢反应性能的影响。实验结果表明,当催化剂中Ni负载量为20%(w)、348 K、1.2 MPa时,p-CNB的转化率达100%,p-CAN的选择性高于97%。非晶态NiB/Al2O3催化剂具有高催化活性是由于载体的引入,这不仅提高了催化剂的分散度,防止超细NiB聚集,且能够提高非晶态结构的热稳定性。Liu等[16]对比了Ni-B/γ-Al2O3(浸 渍 法)、Ni-B/Al2O3·xH2O(共沉淀法)、Ni-B/勃姆石(一种水软铝石Boehmite)(直接还原法)三种催化剂在p-CNB还原中的催化性能,探讨了载体对p-CNB催化加氢性能的影响。实验结果表明,Ni-B/Boehmite催化剂表现出良好的活性和选择性,这是由于该催化剂具有非晶态结构的超细颗粒,且Boehmite中结构水含量高,增强了催化剂的亲水性,不利于p-CAN在催化剂上的吸附,有效抑制了脱氯反应的进行。
在NiB合成过程中,起始原料中加入Co制得的NiCoB催化剂的加氢性能优于NiB[17]。Zhao等[18]研究了聚乙烯吡咯烷酮(PVP)改性对NiCoB催化剂性能的影响,他们认为,PVP含量低时,没有明显的作用,含量高时会阻碍反应物的吸附。反应机理见图2。
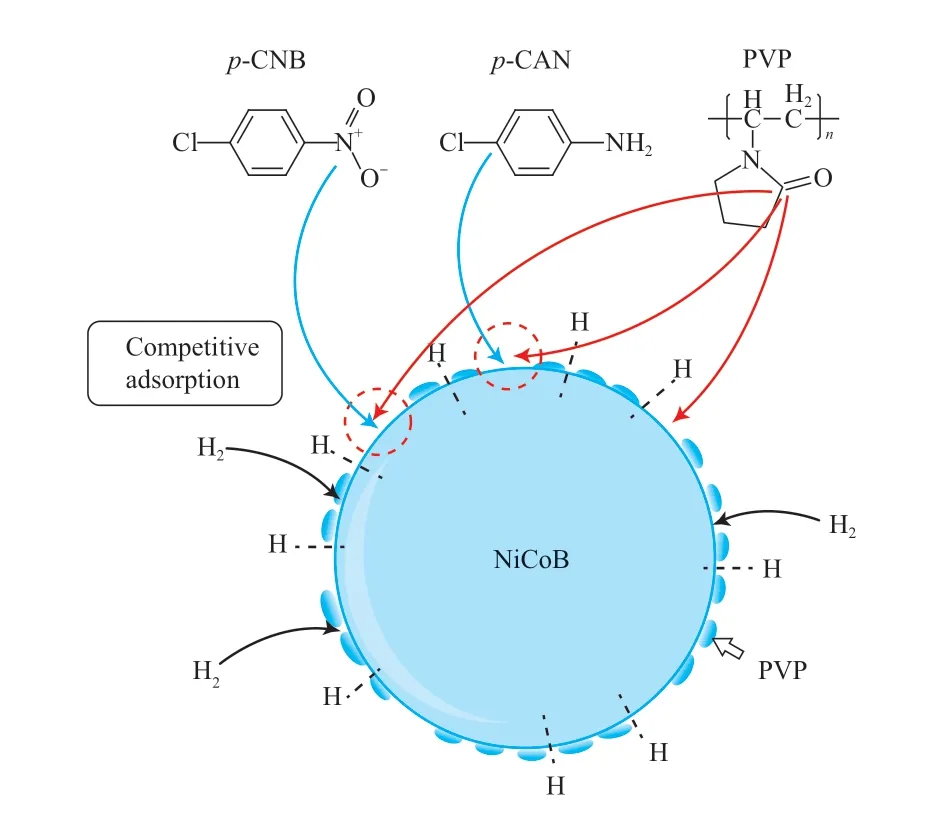
图2 加氢反应过程中的吸附机理[18]Fig.2 The proposed mechanism for the adsorption process in the hydrogenation reaction[18].
NiCoB纳米颗粒吸附PVP分子形成“覆盖层”,覆盖层的厚度会影响p-CNB分子的吸收和扩散,而PVP分子的数量会影响活性位点的数量。反应前反应物吸附在纳米NiCoB表面,与催化剂活性位点上形成的富电子氢相互作用。在NiB,NiCoB,CoB等金属硼化物中,元素态B做电子供体向Ni和Co提供部分电子,这种电子效应有利于富电子氢的形成及p-CNB的氢化。氢原子的亲核进攻是反应的速率控制步骤,由于PVP分子被吸附在纳米NiCoB粒子的表面,一些活性位点被PVP占据,导致催化剂的催化活性下降。PVP每个单体中都含有一个羰基,由于氧的诱导作用使羰基碳处于缺电子状态,有利于PVP吸附在NiCoB颗粒表面。Li等[19]制备了SiO2负载Ni0核和掺氮碳壳催化剂Ni@C-N/SiO2,不仅改善了金属的分散性,核壳结构的形成稳定了Ni0,同时N上的非结合电子转移到Ni0,使Ni0核上有更多带负电荷的氢,活性氢扩散到碳壳外表面更倾向与硝基反应,构建了双反应表面,打破了金属粒径-氢化学吸附的依赖关系,与Ni@C/SiO2相比,转化率和选择性都有所提高。
Ni基催化剂虽然成本低廉,且在p-CNB加氢反应中有较高的转化率,但选择性却较差,这主要是因为p-CAN的竞争吸附导致脱氯严重。经过后期不断地研究,独特结构非晶态Ni的出现,进一步提高了反应的原子经济性;负载型的氮掺杂碳为壳层的Ni核壳结构催化剂的制备,加快了反应速率,催化性能得到了较好的改善,在这一基础上设计Ni基催化剂是今后研究的可行方向。
2.2 Pt基催化剂
Pt,Pd,Au,Rh等贵金属催化剂具有良好的选择性,在p-CNB的加氢还原中,Au的选择性最高,但Pt可以最大限度的减少脱氯。在大多数情况下,高选择性总是以牺牲活性为代价的,可以通过对Pt进行合金化、调节金属/载体间的相互作用、添加促进剂或抑制剂来提高催化剂的活性[20]。组分的选择是开发有效催化剂的关键,应注意活性金属和促进剂之间的相互作用,这种相互作用对催化剂的活性、选择性和稳定性起着重要作用。Chen等[21]制备了Pt-Fe/AC催化剂,讨论了Fe在催化剂中可能的促进作用。实验结果表明,在303 K、1 MPa条件下,4%(w)Fe/AC催化p-CNB没有发生转化,0.3%(w)Pt/AC催化反应40 min,p-CNB转化率仅为37%,当0.3%(w)Pt/AC负载4%(w)Fe时,相同条件下p-CNB转化率提高至65%,选择性提高至94.2%。这可能是由于FexOy活化了N=O键使其易受氢进攻,Fe含量增加到6%(w)时转化率降至33%,可能是由于过量的FexOy覆盖了Pt表面。Zhu等[22]采用两步光沉积法合成了一系列的Pt@Cu/TiO2催化剂。实验结果表明,具有单层分散能力的Cu基催化剂表现出最佳的催化性能,这归因于暴露的Pt位点有效阻止了C—Cl键的断裂,促进氢的解离。Mahata等[23]研究了Cu对Pt/C催化p-CNB加氢性能的影响。实验结果表明,由于Pt和Cu之间强烈的相互作用,使得Pt表面部分被Cu覆盖,表面的Cu活化了N=O键并抑制了p-CAN的吸附,与Pt/AC相比,双金属催化剂在选择性和活性方面都表现出优异的性能。Li等[24]设计并制备了Pt纳米粒子沉积在超小的Cu粒子上修饰的活性炭(Cu/C-Pt)和Cu粒子修饰的Pt碳催化剂(Pt/C-Cu),探讨了Cu的几何效应和电子效应在p-CNB选择性加氢中的贡献。与Pt/C相比,Cu/C-Pt活性低但选择性高,在Pt/C-Cu上,p-CNB不能完全转化为p-CAN。相同含量的两种催化剂的分散度数据表明,Pt纳米粒子在Cu/C-Pt中的暴露面比Pt/C-Cu大得多,推断Cu对Pt纳米颗粒在Cu/C-Pt催化性能的影响主要是电子效应,而Pt/C-Cu中Cu对Pt的几何效应导致纳米Pt分散度低,使得p-CNB加氢活性降低。
近年来,N掺杂C材料因独特的性能也引起了人们的广泛关注。Zhu等[25]制备了碳氮作为覆盖层的负载型Pt催化剂,实验结果表明,Pt/Al2O3表面成功形成了碳氮涂层,碳氮涂层完全覆盖了Pt粒子,由于碳氮层与Pt粒子的密切接触,在催化剂表面形成了异质结。XPS表征结果显示,随碳氮包覆量的增加,催化剂中Pt 4d5/2的结合能逐渐红移,可能是由于它们之间的强相互作用使电子从富电子的N向Pt转移,Pt带负电荷,p-CAN中的—NH2倾向于将电子贡献给Cl,导致Cl与带负电荷的Pt位点间产生静电斥力,从而抑制C—Cl键的裂解。转化率100%时选择性也达到100%,循环使用五次后催化剂未失活, 碳氮包覆贵金属是催化p-CNB加氢的一种很有前途的催化剂。
基于特殊材料(氧化铁等)的Pt催化剂在温和条件下也表现出较高的选择性,但这些方法普遍存在一些不足,包括使用一些比较危险的有机溶剂为反应介质,因此,一些研究人员曾试图在纯净水中进行硝基氢化[26]。从绿色化学的角度来看,温和、丰富且廉价的溶剂十分符合绿色化学发展的要求。但成功的例子很少。Sreedhar等[27]制备了阿拉伯树胶稳定的Pt纳米粒子,将其用于硝基芳烃的选择性加氢过程中,以水为反应介质,p-CAN产率达88%。Fan等[28]制备了氨基功能化的Fe3O4稳定Pt纳米粒子,用于水介质中的硝基芳烃的选择性加氢。在303 K、H2气氛下,加氢合成卤胺产率大于99.9%,且稳定性好,易于分离。但具体反应机理有待进一步研究。反应中除了目标产物没有检测到其他副产物,而在醇中进行氢化时,由于催化剂表面的竞争吸附存在,随反应时间的延长,偶氮类化合物进一步加氢为目标产物,但仍存在AN、羟胺缩合的产物。氨基功能化的Fe3O4稳定Pt纳米粒子在水中催化p-CNB为p-CAN的可持续生产提供了一条更稳定、更环保的催化体系。
目前,Pt基催化剂的催化性能得到了很大的提升,p-CAN的产率达到了99.9%,但催化剂的循环稳定性仍需进一步提高。在温和介质中,选择适宜的助剂对催化剂进行改性及寻找合适的载体是有潜力的研究方向。
2.3 Au基催化剂
Au一直被认为是化学惰性金属,但Au在CO低温氧化[29]、乙炔加氢[30]、水煤气转换[31]、芳硝基化合物还原[32-35]等反应中表现出的高选择性吸引了大量研究者的注意。有研究表明,电子性质、粒径大小和形貌、内部结晶顺序、内外张力是Au纳米粒子催化活性的影响因素[36]。加氢活性的提高需要较小的Au粒子及较多的缺陷位点。氢解离需要表面酸碱对位点,即金属表面-界面区域的Au原子,也是目标反应的活性位点,由于Au与载体之间的相互作用必须很强,所以首选的载体是p型、n型金属氧化物半导体[37]。载体的氧化还原性能起关键作用,催化反应可以由Au/氧化物界面的半导体性质控制,致金属/载体之间的电子相互作用或者形成低配位的纳米Au团簇,增加了缺陷位点数量[38]。
Campos等[39]考察了Fe2O3负载Au纳米颗粒在p-CNB加氢中的催化性能。实验结果表明,尿素沉积沉淀法制备的0.5%(w)Au/Fe2O3在室温下的催化活性最佳,反应6 h后,p-CNB转化率大于70%,选择性大于98%。氢的吸附和解离局限于Au的边角位置,氢的吸附和解离是反应的限速步骤。通常认为,室温下粒径小于5 nm的Au是影响催化活性的关键因素,因为H2分子只能在低配位数的原子表面进行化学吸附,XPS表征结果显示,该方法制备的纳米颗粒具有较高的分散性,由XRD和TEM表征结果可知Au的粒径约为3.5 nm。在Au表面添加少量的Pt是提高Au催化p-CNB加氢活性的有效方法,同时p-CAN的选择性不降低,He等[40]制备了0.02%(w)Pt-0.05%(w)Au/TiO2,在333 K下p-CNB完全转化,且p-CAN的选择性达100%。Au颗粒的大小和分布对加氢活性有直接影响,但测试结果显示,Pt的加入并没有改变Au的粒径。研究发现,Au纳米粒子的氢化活性低是由于它本身的性质,H2在Au上的解离吸附是一个活化的过程,且被限制在与氧化物载体接触的Au纳米复合物粒子的边缘或拐角的位置。因此,Pt的加入提高了p-CNB的氢化活性。如图3所示,H2在Pt位点解离活化,而Au位点尤其是与载体接触的界面进行p-CNB的吸附活化,活化后的H原子通过溢流向附近的Au位点迁移,与吸附的底物快速反应。实验结果表明,总的反应速率是由H2的活化或H原子的供应决定的,Au纳米粒子在反应中始终保持良好的选择性,因此,选择性受Au位点上底物分子的吸附控制,特别是TiO2与Au纳米粒子接触的界面。

图3 Pt促进Au纳米粒子的催化加氢[40]Fig.3 Promotion mechanism of Pt on the hydrogenation catalysis of Au nanoparticals[40].
目前,对于p-CNB加氢的Au催化剂的研究主要集中在金属粒子的大小、添加其他金属助剂、载体的类型、金属载体相互作用上,而很少注意溶剂对反应的影响。液相及多相催化反应中的溶剂不仅为催化反应过程中固体反应物的溶解和热转化提供了反应环境,而且影响催化剂的催化活性和选择性。Hu等[41]从氢键贡献能力的角度研究了不同溶剂对p-CNB在Au/CeO2上液相加氢的溶剂效应,以乙醇、正丙醇、正丁醇、正戊醇为溶剂。实验结果表明,Au/CeO2上p-CNB反应的表观活化能和指前因子与氢键的贡献能力呈线性关系。随着碳数的增加,H2溶解度增加,但在乙醇中的加氢速率是戊醇中加氢速率的5倍,正丁醇和异丁醇的H2溶解度无法区分,但异丁醇中的加氢速率是正丁醇的2倍,因此,加氢速率与H2溶解度之间没有相关性。这很可能因为Au催化剂上氢的解离度和解离速率大大超过活化的p-CNB的加氢速率。他们还进一步研究了溶剂-反应物之间的相互作用,ATR-FTIR谱图中的硝基峰红移是溶剂与硝基相互作用的结果,氢键可以改变反应物在Au催化剂上的吸附能,从而影响加氢速率。
相比Ni基催化剂和Pt基催化剂,Au基催化剂对p-CAN具有更好的选择性,且循环稳定性良好,但p-CNB的转化率一直较低,制备Au粒径较小及具有较多的活性位点的Au基催化剂是目前面临的主要问题。随着研究的不断深入和反应的优化,Au基催化剂在p-CNB加氢反应中将会有巨大的潜力和广泛的应用前景。
3 结语
纳米金属催化剂在p-CNB选择性加氢反应中具有优良的表现。Ni催化剂应用于p-CNB加氢还原时,p-CAN的选择性和转化率都有待进一步提高,但因Ni催化剂价格低廉而被广泛应用于工业生产。Pt,Au基催化剂具有较高的选择性,反应条件温和,但转化率较低,寻找适宜的助剂或改性有利于进一步提高催化剂的性能。相对于单金属催化剂,改性的双金属催化剂在p-CNB转化率、p-CAN选择性、催化剂活性和稳定性方面取得了较好的效果,因此改性催化剂是一个很重要的研究方向。在探索制备高效催化剂的同时,应尽可能选择低毒、温和的原料和溶剂,更符合绿色化学的发展要求。
