大黄牡丹汤对脂多糖诱导肠上皮细胞焦亡及NLRP3/caspase-1通路的影响
2021-12-01贺海峰
贺海峰,华 鹏,崔 翔
(1.陕西省中医医院脾胃病二科,陕西 西安 720082 2.陕西省安康市中医医院消化内科,陕西 安康 725000)
脓毒症是严重烧伤、休克和外科手术后等患者常会出现的并发症,可由细菌引起。脓毒症可导致肠道功能损伤,进而引发内毒素移位,加重器官功能障碍,形成恶性循环[1]。脂多糖(lipopolysaccharide,LPS)是细菌内毒素的主要活性成分,在引发例如脓毒症这种全身炎症反应中起着重要作用[2]。因此,研究内毒素性肠损伤机制及其治疗措施,对于防治内毒素性器官功能障碍具有重要意义。细胞焦亡是一种细胞非典型死亡方式,与细胞凋亡的信号途径和死亡方式不同,它可通过炎性信号通路的Nod样受体热蛋白结构域相关蛋白3(Nucleotide binding oligomerization domain-like receptor family pyrin domain containing 3,NLRP3)活化含半胱氨酸的天冬氨酸蛋白水解酶1(caspase-1),切割消皮素D(gasdermin D,GSDMD)、促炎因子白细胞介素(Interleukin,IL)-1β和IL-18并释放,细胞发生炎性反应并膨胀破裂死亡[3]。大黄牡丹汤具有泻热消肿、破结散结的功效,可治疗急性盆腔炎等湿热瘀结类病症[4]。目前关于大黄牡丹汤对LPS诱导的肠上皮细胞焦亡以及NLRP3/caspase-1炎性信号通路的影响鲜有报道,本研究通过体外细胞实验对大黄牡丹汤对肠上皮细胞的保护作用及机制进行了初步探讨,为预防和治疗内毒素性肠损伤提供一定的理论及实验依据。
1 材料与方法
1.1材 料
1.1.1实验动物:32只250g~270g SPF级雄性SD大鼠购自湖南斯莱克景达实验动物有限公司,动物资格证号:SCXK(湘)2019-0004。实验在陕西中医药大学动物实验室进行,室温为20~25℃,相对湿度为50%~60%,通风良好。大鼠自由进食饮水,适应性饲养1周后进行实验。实验严格遵循3R原则给予实验动物人道的关怀照顾。
1.1.2主要试剂:大黄牡丹汤处方:3g牡丹皮、9g芒硝、9g桃仁、12g大黄、30g冬瓜仁。用6L蒸馏水煎煮,浓缩至1L时过滤去渣,加入芒硝再次煮沸,静置冷却后过滤取上清,药剂使用前加蒸馏水稀释至所需浓度。大鼠肠上皮细胞(货号:LHY3015);脂多糖(货号:L6386);DMEM培养基(Dulbecco's modified eagle medium,DMEM,货号:C11960500BT );噻唑蓝(thiazolyl blue,MTT,货号:PB180519)、二甲基亚砜(Dimethyl sulfoxide,DMSO,货号:133050)和0.25%胰蛋白酶溶液(货号:PB180223);Annexin V-FITC/PI细胞凋亡检测试剂盒、蛋白提取试剂盒和蛋白浓度测定试剂盒购自北京索莱宝科技有限公司;荧光二抗和荧光染料DAPI购自美国Life公司;IL-1β酶联免疫吸附测定(enzyme linked immunosorbent assay,ELISA)试剂盒、IL-18 ELISA试剂盒、NLRP3抗体、caspase-1抗体和GSDMD-C抗体购自艾博抗(上海)贸易有限公司。
1.1.3仪器:生物安全柜购自赛默飞世尔科技(中国)有限公司;CO2培养箱购自Forma公司;台式高速冷冻离心机购自德国Eppendorf公司;Facscalibur流式细胞仪购自美国BD公司;垂直板电泳槽、蛋白转膜仪、凝胶成像系统、酶标仪购自Bio-Rad公司,等。
1.2方 法
1.2.1将32只大鼠随机分为4组:空白组和大黄牡丹汤低、中、高剂量组,每组8只,用药剂量按照动物体表面积比率换算等剂量法,大黄牡丹汤低、中、高剂量组大鼠分别以2.52、5.04、7.56g/kg灌胃给药,空白组大鼠给予蒸馏水灌胃,灌胃10mL/kg,1次/d、连续7d。最后1次给药6h后,对各组大鼠进行腹主动脉穿刺取血,离心取上清并除菌灭活,储于-20℃备用。
1.2.2细胞分组及培养:将肠上皮细胞随机分为5组,每组各设置10个平行对照:对照组:给予肠上皮细胞空白血清培养12h;LPS组:向肠上皮细胞中加入LPS(最终浓度为50mg/mL[5])和空白血清,培养12h;大黄牡丹汤低、中、高剂量组:向肠上皮细胞中加入LPS和大黄牡丹汤含药血清,培养12h。
1.2.3MTT法检测肠上皮细胞活性:将肠上皮细胞以5×104个/mL的密度接种于96孔板中培养过夜,按照1.2.2中的分组进行处理。每孔加入20μL MTT溶液,继续孵育4h后,离心,弃去培养基,每孔加入150μL DMSO,避光并混匀,通过酶标仪测定每孔细胞的570nm吸光度(A)值。细胞活性(%)=(A1~5-A空白组)/(A1-A空白组)×100%,A空白组为150μL细胞培养基于570nm A值,用以排除本底A值对结果的影响。
1.2.4流式细胞术检测肠上皮细胞凋亡情况:将肠上皮细胞配制为1×106个/mL密度的单细胞悬液,2mL/孔接种于6孔板中,细胞培养箱中培养24h。按照1.2.2中的分组培养细胞,弃去上层培养基并加入胰蛋白酶对细胞进行消化,加入新的培养基终止消化后,离心收集细胞,无菌磷酸盐缓冲液(Phosphate Buffered Saline,PBS)洗涤细胞2次,随后用Annexin V-FITC/PI细胞凋亡检测试剂盒中的缓冲液重悬细胞,调整细胞密度为1×106个/mL。取各组100 μL重悬后的细胞分别加入流式管中,再向流式管中加入5 μL Annexin V-FITC抗体和5μL Annexin V-PI抗体,快速混匀后避光孵育15min,加入400μL缓冲液混匀后流式细胞仪中分析细胞凋亡情况,注意全程冰上操作。
1.2.5蛋白质免疫印迹技术(Western-blot,WB)检测NLRP3、caspase-1和GSDMD-C的表达水平:将肠上皮细胞以1×106个/mL的密度接种于6孔板中培养过夜,按照2.2中的分组进行处理。弃去培养基后用胰蛋白酶消化细胞,终止后离心,无菌PBS洗涤细胞2次,再次离心弃上清,加入细胞裂解液,按照试剂盒说明书提取细胞总蛋白。蛋白定量后取50g进行SDS-PAGE电泳,将凝胶上蛋白转移到聚偏(二)氟乙烯(Polyvinylidene difluoride,PVDF)膜上,在室温下用5%脱脂奶封闭1 h,加入稀释(1∶1000)的对应一抗,4 ℃摇床孵育过夜,弃去一抗溶液并洗涤PVDF膜,加入稀释(1∶2000)的二抗溶液,室温摇床1 h,洗膜3次,增强化学发光剂(Enhanced chemilum inescence,ECL)显色并用凝胶成像系统拍照。
1.2.6免疫荧光法检测细胞中NLRP3的表达:配制2×105个/mL密度的肠上皮细胞,2mL接种于24孔板中培养过夜,按照2.2中的分组进行处理。弃培养基后进行细胞固定,PBS洗涤3次,用5%牛血清白蛋白室温封闭1h,加入NLRP3抗体过夜,PBS洗涤后加入荧光二抗,室温孵育2h,洗涤后加入荧光染料DAPI孵育3min,PBS洗涤3次,封片后在荧光显微镜下观察并拍照。
1.2.7ELISA检测细胞上清中IL-1β和IL-18的含量:在96孔ELISA板中4℃过夜包被IL-1β抗体,弃去后用含吐温-20的PBS洗板3次,加入5%脱脂奶室温封闭1h。弃去封闭液后加入各组细胞上清液,室温孵育2h后洗板3次,加入100μL/孔的检测抗体,室温孵育1h后洗板3次,加入100μL/孔的二抗溶液,室温孵育30min后洗板5次,100μL/孔显色液孵育15min,加入50μL/孔终止液终止反应,测定每孔450nm处的吸光度值。
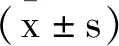
2 结 果
2.1大黄牡丹汤对LPS损伤肠上皮细胞活性、及凋亡率的影响:与对照组相比,LPS组细胞活性显著降低(P<0.05);与LPS组相比,大黄牡丹汤各组的细胞活性显著升高(P<0.05),各组细胞活性数据如表1所示。LPS组细胞凋亡率相比于对照组显著升高(P<0.05);大黄牡丹汤各组细胞凋亡率相比于LPS组显著降低(P<0.05),结果如表1、图1所示。

图1 大黄牡丹汤对LPS诱导的肠上皮细胞凋亡的影响

表1 大黄牡丹汤对LPS损伤肠上皮细胞活性及凋亡率的影响
2.2大黄牡丹汤对LPS损伤肠上皮细胞NLRP3、caspase-1和GSDMD-C蛋白表达水平的影响:与对照组相比,LPS组NLRP3、caspase-1和GSDMD-C蛋白表达水平显著升高(均P<0.05);与LPS组相比,大黄牡丹汤各组细胞NLRP3、caspase-1和GSDMD-C蛋白表达水平显著降低(均P<0.05),如表2、图2所示。免疫荧光结果显示,LPS诱导肠上皮细胞的NLRP3荧光强度相较于对照组显著增强(P<0.05),大黄牡丹汤各组细胞的NLRP3荧光强度相较于LPS组显著降低(P<0.05),见表2、图3。

图2 大黄牡丹汤对LPS损伤肠上皮细胞NLRP3、caspase-1和GSDMD-C蛋白表达水平的影响

图3 大黄牡丹汤对LPS损伤肠上皮细胞NLRP3蛋白荧光强度的影响

表2 大黄牡丹汤对LPS损伤肠上皮细胞NLRP3 caspase-1和GSDMD-C蛋白表达水平的影响
2.3大黄牡丹汤对LPS损伤肠上皮细胞IL-1β和IL-18含量的影响:与对照组相比,LPS组细胞上清中IL-1β和IL-18含量显著升高(P<0.05);与LPS组相比,大黄牡丹汤各组细胞上清中IL-1β和IL-18含量显著降低(P<0.05),见表3。

表3 大黄牡丹汤对LPS损伤肠上皮细胞IL-1β和IL-18含量的影响
3 讨 论
革兰氏阴性细菌感染可引起脓毒症,该症病情凶险,可导致全身性炎症反应和器官功能障碍[6]。脓毒症引起功能障碍的始发器官为肠道,细菌内毒素主要活性成分脂多糖可导致肠上皮细胞屏障功能丧失,不仅破坏肠道功能还可引发全身免疫系统激活,促进慢性病毒感染和代谢性疾病的发展[7]。因此,寻找安全有效的药物和治疗方法保护肠上皮细胞,对于减轻脓毒症症状非常重要。
Hersoug[8]等研究报道,肠道微生物群的脂多糖可刺激脂肪细胞,激活多个caspase蛋白,引起一种高度炎症性的程序性细胞死亡(即焦亡)。细胞焦亡是于2001年发现的一种新型细胞程序性死亡方式,有别于细胞凋亡和坏死,表现为:细胞膜出现孔洞,细胞破裂使内容物释放,引起炎症反应[9]。细胞焦亡为一种依赖于caspase-1活化的炎性细胞死亡方式,受到病原信号刺激的NLRP3可结合pro-caspase-1形成炎性复合体,促使其活化为caspase-1,caspase-1则促进促炎细胞因子IL-1β和IL-18的成熟和释放,另外caspase-1还能切割GSDMD,使其N端片段释放后结合细胞膜的磷脂类分子,致使细胞膜上出现孔洞,细胞渗透压发生变化,细胞肿胀膨大并最终破裂,细胞内容物外渗,造成细胞焦亡[10]。于此同时,细胞渗出物成为新的炎性刺激物,造成更加广泛和剧烈的炎性反应。Wen[11]等研究报道,清热养阴祛湿丸能抑制NLPR3炎症复合体激活,降低NLRP3、Caspase-1、GSDMD蛋白表达,下调炎症因子IL-1β和IL-18的表达,调节细胞焦亡的发生,减轻关节炎。熊云昭[12]等报道,对梗阻性肾病大鼠模型给予化瘀解毒方灌药,可下调细胞炎性因子IL-1β等的表达,减轻肾脏炎性损伤。大黄牡丹汤出自《金匮要略》,方中大黄可逐瘀解毒、牡丹皮清热散瘀、芒硝软坚散结、桃仁破血、冬瓜仁利湿,使结瘀湿热速下,消肿减痛[13]。本研究结果显示,大黄牡丹汤可使LPS损伤肠上皮细胞活性显著升高,降低细胞凋亡率,细胞NLRP3、caspase-1和GSDMD-C蛋白表达显著降低,IL-1β和IL-18含量显著降低。提示大黄牡丹汤可能调控NLRP3/caspase-1通路,减少细胞焦亡。推测因大黄牡丹汤具有减轻炎症反应、阻止细胞焦亡的功效,可用于对炎症性肠病的治疗[14]。
综上所述,大黄牡丹汤可抑制NLRP3/caspase-1信号通路的激活,降低细胞炎性反应,对LPS诱导肠上皮细胞焦亡起保护作用。但中药方的有效成分及作用机制较为复杂,且本研究并未设计阳性药物处理组,因此,还需更多实验探究其具体作用机制,也是下一步研究重点方向。
