球毛壳菌α-葡聚糖酶的异源表达、纯化及特性表征
2021-11-30顾莉莉周楠迪田亚平
顾莉莉, 周楠迪, 田亚平*
(1.江南大学 生物工程学院,江苏 无锡214122;2.江南大学 工业生物技术教育部重点实验室,江苏 无锡214122)
α-葡聚糖酶,又称右旋糖酐酶(α-1,6 glucan-6 glucanohydrolase,EC 3.2.1.11),是一种可特异性催化α-葡聚糖中α-1,6-糖苷键的水解酶。该酶主要来源于真菌和细菌。随着研究的日益深入,该酶的应用领域被广泛挖掘[1]。在我国,该酶主要应用于制糖、医药、日化等领域[2-8]。各行业对该酶的需求日益迫切,但其产量目前仍然偏低,无法满足各个领域的需求。
近几年的有关研究一直以提高该酶的产量为目标。2014年,王雅洁等[9]从土壤中筛选一株能产生右旋糖酐酶的拟青霉(Paecilomyces),发酵液上清中的酶活力最高达19.34 U/ml。2019年,王乐怡[10]将细丽毛壳菌来源的α-葡聚糖酶基因在Bacillus subtilis WB800中表达,并构建了含有双p43启动子的表达框后,其提高至14.22 U/mL。同年,杨柳通过结合常压和室温等离子体和乙基甲基砜诱变球毛壳原始菌,使得α-葡聚糖酶的产量高达824.73 U/mL[11]。2018年,Wakil等人从土壤和蜂蜜中分离出产α-葡聚糖酶能力较强的短青霉BG8、尖孢镰刀菌BG4和交替链霉菌DD5,其活性进一步提高[12]。由于大多数原始菌的产量均较低,通过异源表达提高酶产量[13-14]是发展趋势。近年来的研究中,毕赤酵母表达系统已广泛地被选择用于表达外源蛋白质[15-17],该系统操作方便、培养基成分简明且遗传性状稳定,因此作者选择将球毛壳菌来源的α-葡聚糖酶在毕赤酵母GS115中进行表达,通过优化发酵条件等手段[18-25],以期达到较高的表达水平。
不同来源的α-葡聚糖酶的基本酶学性质不同。2017年,杨帆[26]研究了圆弧青霉菌产右旋糖酐酶的最适催化温度和pH分别为40℃和6.0,在偏碱性的条件下酶活保留效果较好;黎志德等[27]研究的毛壳菌来源的α-葡聚糖酶最适反应温度和pH为60℃和5.5;吴敏等[28]研究了重组后的刺孢青霉来源右旋糖酐酶的最适催化温度和pH分别为35℃和5.0,与其原始酶最适值一致;张宇琪[29]筛选到的一株嗜松青霉菌所产右旋糖酐酶的最适催化条件为45℃、pH为6,Zn2+、Cu2+强烈抑制其酶活性。近年关于该酶酶学性质的研究逐渐增多,寻找稳定性良好的α-葡聚糖酶也成为目前研究的主要方向。
1 材料与方法
1.1 材料
1.1.1 菌株与质粒巴斯德毕赤酵母(Pichia pastoris)GS115、大肠杆菌JM109、质粒pPIC9k:均为作者所在实验室保藏。
1.1.2 培养基LB、YPD、BMGY、BMMY、MD。
1.1.3 试剂与仪器限制性内切酶(EcoR I、Not I、Sac I)、Primer STAR、DNA Marker:购自大连宝生物公司;质粒抽提试剂盒、DNA Marker等:购自上海生工;葡聚糖T2000:购自卡迈舒生物科技公司;无氨基酵母氮源、遗传霉素、生物素:购自Bio Basic公司;其他常规试剂均为分析纯:购自上海国药集团。
PCR仪TC-25/H:BIOER公司产品;电转仪:Enppdorf公司产品;高速冷冻离心机himac CR22G:日立(HITACHI)公司产品;全温摇瓶柜HYL-A:强乐实验设备有限公司产品。
1.2 方法
1.2.1 α-葡聚糖酶基因的优化与合成将本实验室解析出的α-葡聚糖酶基因序列(NCBI登录号:MH122516.1),根据P.pastoris的密码子偏好性优化后由上海生工合成。
1.2.2 引物设计本实验所用引物使用SnapGene设计,交由上海生工合成,序列见表1。
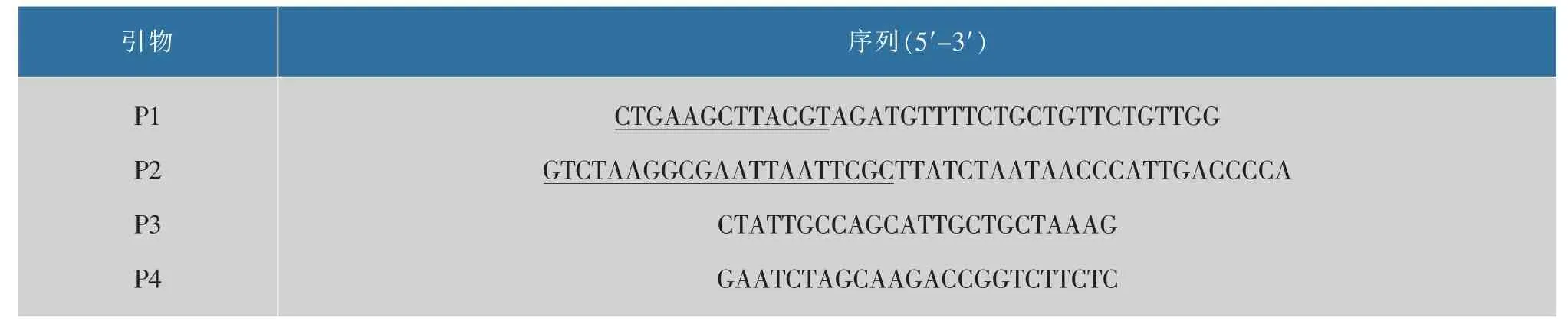
表1 本实验扩增DNA所用到的引物Table 1 Primers used in this study to amplify DNA
1.2.3 工程质粒pPIC9k-DEX的构建及鉴定质粒pPIC9k由质粒抽提试剂盒获得并用限制性内切酶(EcoR I、Not I)处理;无缝克隆试剂盒连接载体与目的基因(引物P1和P2扩增所得)转化大肠JM109后挑取长势良好的单菌落进行菌落PCR(菌落PCR引物为P3和P4)验证。验证结果正确的送上海生工测序。
1.2.4 工程菌的鉴定及高拷贝筛选将测序结果无误的单菌落培养后抽提pPIC9k-DEX工程质粒,限制性内切酶Sac I将其处理并用DNA纯化试剂盒进行回收,电击转化毕赤酵母GS115。挑取单菌落在95℃处理5 min后进行菌落PCR验证[24];转化子依次接种至G418质量浓度为1~6 mg/mL的YPD平板进行高拷贝筛选。甲醇诱导摇瓶发酵测定初始重组菌和不同G418质量浓度下正常生长的重组菌的表达α-葡聚糖酶的情况。
1.2.5 生物量的测定比浊法。取适量菌液离心弃上清液,加入等体积的纯水吹吸混匀,对照组为纯水;紫外可见光分光光度计600 nm处测定吸光值。以时间为横坐标,吸光度值为纵坐标绘制重组菌的生长曲线。
1.2.6 摇瓶发酵条件优化诱导起始时间:根据生长曲线将起始诱导时间确定为18、20、22、24、26、28 h;诱导温度:将诱导温度梯度设置为32、30、28、26、24、22、20℃;诱导甲醇体积分数:选取诱导甲醇体积分数梯度为0.5%、1%、1.5%、2%、2.5%、3%;诱导甲醇添加时间:将甲醇添加时间设定为每隔12、24、36 h;摇床转速:将摇床转速分别设置为190、210、230、250 r/min;诱导初始pH:将发酵培养基初始pH梯度设置为4~10;山梨醇添加量:选取山梨醇添加量为1~6 g/L;以上均每隔24 h测定各组发酵液上清中的酶活。
1.2.7 重组α-葡聚糖酶酶活的测定DNS法[29]。重组α-葡聚糖酶的酶活力用还原糖含量表示:酶活定义:50℃下,重组α-葡聚糖酶每分钟催化质量分数1%的底物(葡聚糖T2000)生成1μmol还原糖所需酶量,U/mL表示[11]。
1.2.8 重组α-葡聚糖酶的纯化及SDS-PAGE鉴定阴离子交换层析:粗酶液经0.22μm过滤膜过滤,用透析袋装好置于pH 7.4,20 mmol/L的Tris-HCl缓冲液(A液)中4℃下透析12 h后作为层析的样品溶液。Hitrap Q HP层析柱(5 mL)进行分离纯化。A液平衡柱床后样品泵每次进样量30 mL,B液(pH 7.4,含1 mol/L NaCl,20 mmol/L Tris-HCl缓冲液)在5 mL/min的流量下进行洗脱。收集器收集目标蛋白质并测定总酶活和蛋白质浓度。
阳离子交换层析:将阴离子交换层析获得的目标蛋白质样品置于pH 4.7、20 mmol/L HAc-NaAc缓冲液(A液)中4℃下透析10 h,作为阳离子交换层析的样品液。Hitrap HPSP层析柱(5 mL)用A液平衡后样品泵每次进样量15 mL,B液(pH 4.7,20 mmol/L HAc-NaAc,1 mol/L NaCl)分阶段洗脱,管收集目标蛋白质并测定每管的酶活与蛋白质浓度。
SDS-PAGE电泳验证条带大小以及纯度,并计算纯化倍数、比酶活和回收率。
1.2.9 重组α-葡聚糖酶的酶学特性重组α-葡聚糖酶的最适温度:设置温度梯度20~70℃(间隔5℃),将纯化后的酶液在不同温度下与底物反应,测定酶活力;热稳定性:将同样的酶液置于每个温度梯度下分别保温1 h和3 h,同样的方法测定酶活力。结果以最高酶活的百分比表示;重组α-葡聚糖酶的pH:设置pH梯度3~10(间隔0.5),测定不同pH条件下的酶活力。pH稳定性:将同样的酶液分别置于上述pH梯度缓冲液中,分别在室温(25℃)下放置6 h和4℃下放置24 h,测定各条件下的酶活力。结果以最高酶活的百分比表示;金属离子的影响:分别配制含有不同金属离子的质量分数1%底物溶液,至终浓度分别为0.1、1、10 mmol/L。测定各条件下的酶活力,结果以不添加金属离子条件下的酶活力为100%表示;动力学方程参数的测定:乙酸盐缓冲液配制质量浓度为1.5、5、7、10、15、20 mg/mL的T20、T40、T70和T2000的底物溶液,纯酶液与这些底物分别反应并测定酶活力。线性拟合法作图并计算Km及Vmax值。
2 结果与讨论
2.1 α-葡聚糖酶基因的密码子优化结果
经序列比对后发现,α-葡聚糖酶基因优化前和优化后序列一致性为73.38%。优化后的序列通过对低频密码子替换,使相对适用性高(91%~100%)的密码子从29%提高到76%,而使用频率较低(<50%)的密码子仅剩3%。最终使该基因的CAI(密码子适应指数)从0.56提高到0.91(CAI为0.8~1.0时被认为有利于高表达)。
2.2 工程质粒pPIC9k-DEX的构建及转化子的阳性鉴定
pPIC9k-DEX的工程质粒测序结果用DNAMAN进行序列同源性分析,测序结果与优化后DEX基因的同源性为100%,序列大小、方向均一致,表明目的基因已正确插入载体PPIC9k中,见图1。随机挑取的8株重组子的菌落PCR电泳验证结果中有6株扩增出了与DEX基因大小一致的条带,证明pPIC9K-DEX已成功转入毕赤酵母。重组毕赤酵母菌株表现为Mut+型,在甲醇诱导的强启动子AOX1的驱动下,重组蛋白由α-factor信号肽引导至胞外分泌,见图2。
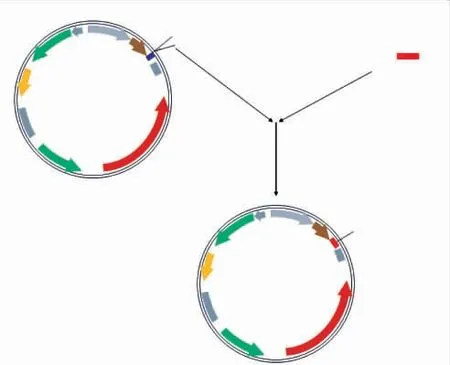
图1 工程质粒pPIC9k-DEX的构建图谱Fig.1 Construction of the engineering plasmid pPIC9k-DEX
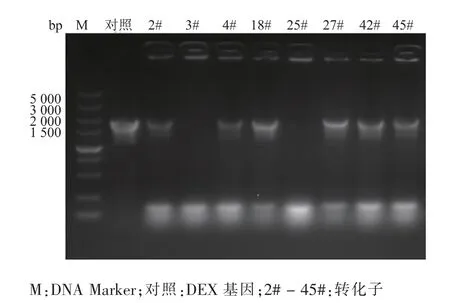
图2 重组酵母菌的菌落PCRFig.2 Colony PCR of recombinant yeast
2.3 重组毕赤酵母菌株表达优化结果
将转化成功的重组子进行摇瓶发酵培养并测定α-葡聚糖酶的表达量,结果发现初始摇瓶表达量最高的一株重组菌27#的发酵液酶活为2.692 U/mL。
图3为重组菌27#的生长曲线图。14 h之前为该菌株的生长延滞期,16~24 h为对数生长期,24~28 h为对数生长期后期,30 h以后进入稳定期。因此,摇瓶时间优化条件选择在18~28 h进行。
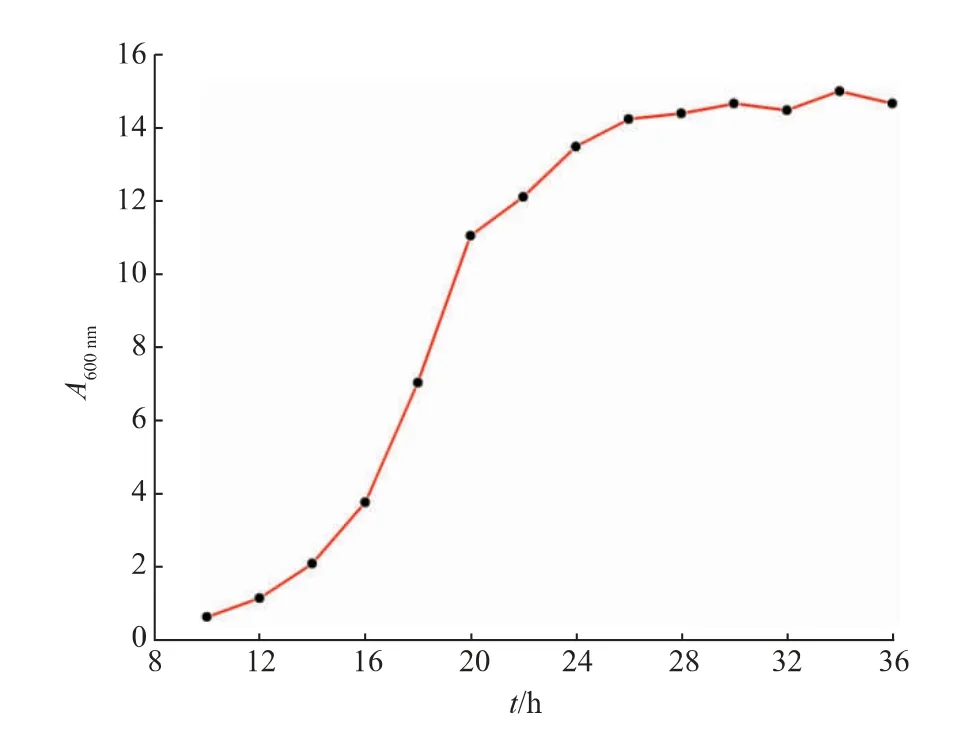
图3 重组毕赤酵母的生长曲线Fig.3 Growth curve of recombinant P.pastoris
图4 中(a)为重组α-葡聚糖酶基因的高拷贝筛选结果。随着G418质量浓度的升高该重组菌的产酶能力逐渐增强,当G418质量浓度为5 mg/mL时,该重组菌株产酶最高,为6.158 U/ml,比初始酶活提高约2.3倍。但当质量浓度增加至6 mg/mL时,酶活骤然降低,可能是由于蛋白质的过度折叠影响了细胞的代谢水平[20]。
图4(b)—(h)为摇瓶发酵条件优化结果。通过单因素实验条件的优化,最佳摇瓶水平发酵条件为:重组菌株生长26 h、诱导温度24℃、体积分数2.5%的甲醇每24 h添加一次、转速230 r/min、初始pH为8、山梨醇添加量为5 mg/mL时的重组酶表达量最高达47.915 U/mL,比初始表达量提高了17.80倍。
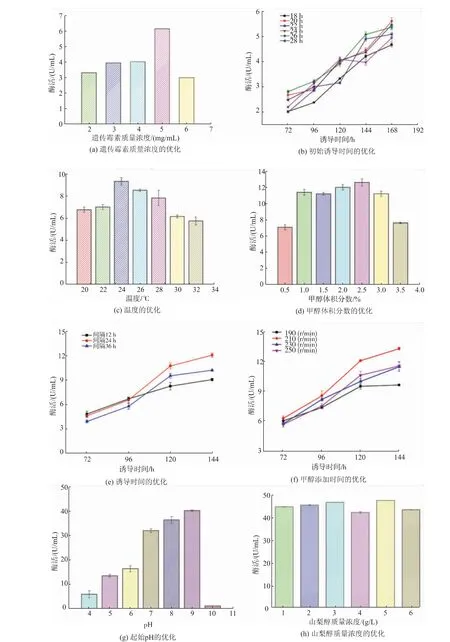
图4 重组菌产α-葡聚糖酶的优化结果Fig.4 Optimization ofα-glucanase production by recombinant strains
2.4 重组α-葡聚糖酶的纯化结果
阴离子交换层析结果如图5所示,透析后的粗酶液流经Hitrap Q HP层析柱后,有一部分蛋白质直接随缓冲液流穿,a峰即为流穿的蛋白质;b部分为100%B液(pH 7.4,含1 mol/L NaCl,20 mmol/L Tris-HCl)在NaCl质量分数为0~12.5%线性洗脱出的不同紫外吸收峰。收集后测定,目标蛋白质在流穿样品a中,而洗脱峰b全部为杂蛋白洗脱峰。重复多次收集a部分样品做SDS-PAGE电泳验证。
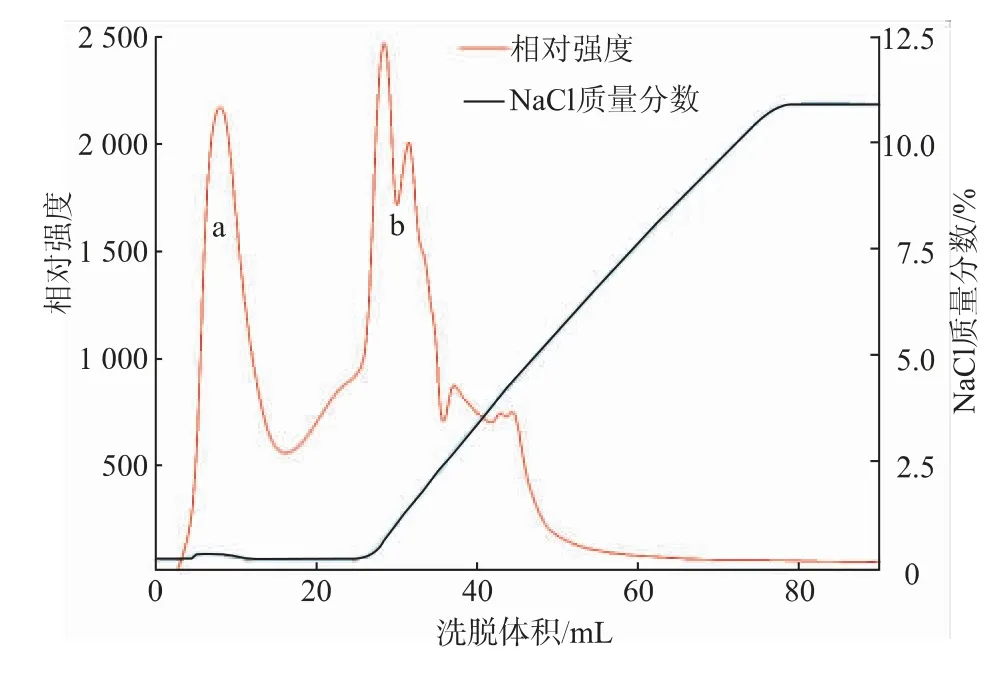
图5 重组α-葡聚糖酶的Hitrap Q HP层析图谱Fig.5 Hitrap Q HP chromatography of recombinantαglucanase
阳离子交换层析结果如图6所示,将上一步分离得到的目标蛋白质样品透析约后上Hitrap HP SP层析柱,图6(a)中,a处为流穿样品,b部分为不同NaCl质量分数梯度下洗脱出的目标蛋白质样品。经收集后测定在b处检测到目标蛋白质。图6(b)为b的放大图,目标蛋白质在收集体积为65~70 mL处被洗脱。收集图6(b)中的目标蛋白质样品做SDSPAGE电泳验证。
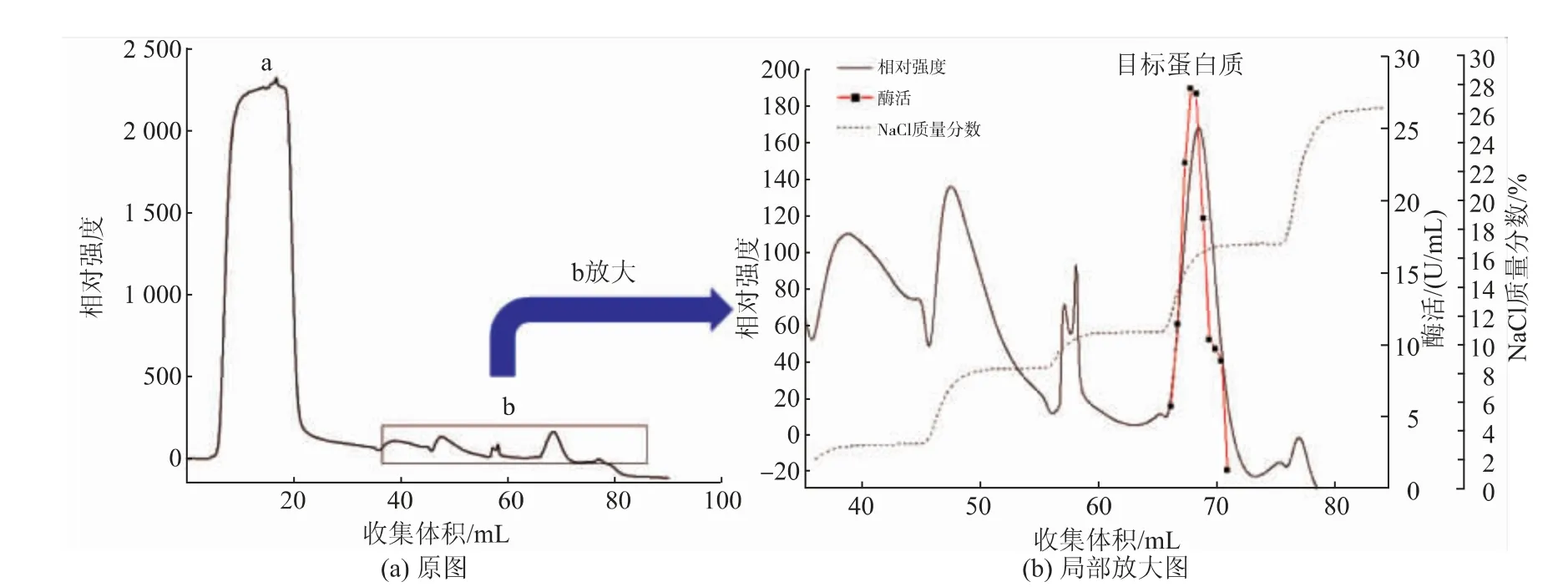
图6 重组α-葡聚糖酶的Hitrap HP SP层析图谱Fig.6 Hitrap HP SP chromatography of recombinantα-glucanase
SDS-PAGE电泳结果显示粗酶液经两步离子交换层析纯化后只有一条清晰的条带,说明该重组酶已被纯化至电泳纯,且该条带大小与α-葡聚糖酶理论值65 4500一致。结果见图7。

图7 重组酵母菌摇瓶发酵液上清的SDS-PAGE鉴定Fig.7 SDS-PAGE identification of supernatant of recombinant yeast flask fermentation broth
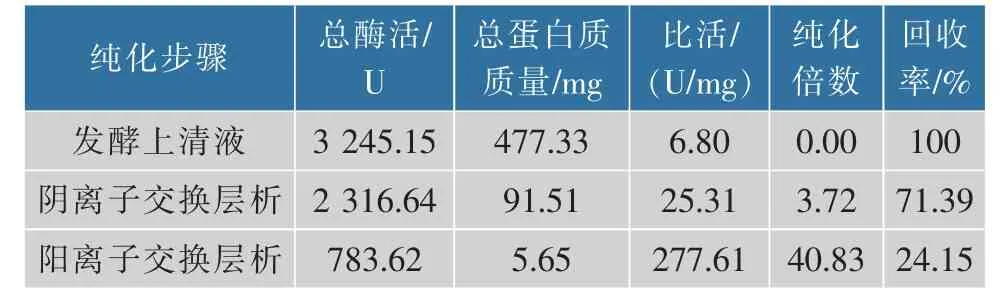
表2 重组α-葡聚糖酶的分离纯化结果Table 2 Isolation and purification of recombinantαglucanase
重组α-葡聚糖酶在粗酶液中比活为6.80 U/mg,杂蛋白质多造成了其比活低且目标蛋白质的表达水平较低。经两步离子交换层析纯化后的重组酶的比活达277.61 U/mg,回收率为24.15%,纯化倍数为40.83。
2.5 重组α-葡聚糖酶特性表征
如图8所示,重组α-葡聚糖酶活性随温度的升高逐渐增强,60℃时最高。当温度继续升高,其酶活性快速下降,说明该重组酶对高温比较敏感,温度的持续升高很大程度上影响了其催化活性。该重组酶在20~50℃的水浴锅中分别保温1 h和3 h之后,剩余酶活均维持在70%以上,保温1 h后的剩余酶活均略高于保温3 h,较短时间内在不同温度下酶活略有降低但变化不大。55℃时的剩余酶活均骤然下降,保温3 h后酶活均略低于保温1 h。在温度达到70℃时,两种条件下的剩余酶活均已处于很低的水平,高温已在很大程度上破坏了酶的活性。最适反应温度60℃与原始菌α-葡聚糖酶[24]一致,但热稳定性略有下降。斯达油脂酵母菌来源的α-葡聚糖酶在毕赤酵母X33中重组后的最适温度仅为35℃[22]。
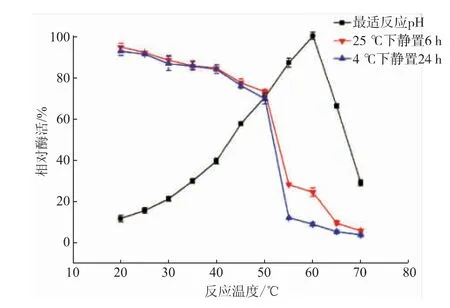
图8 重组α-葡聚糖酶的最适反应温度和热稳定性Fig.8 Optimal reaction temperature and thermal stability of recombinantα-glucanase
重组酶的最适pH为5.5,在pH 4~6范围内,该酶酶活可达80%以上,当pH小于3.5时,该酶酶活骤然下降,见图9。说明重组α-葡聚糖酶对低pH环境非常敏感,在低pH环境下其催化作用迅速降低;当pH大于6时,重组α-葡聚糖酶酶活缓慢下降,说明该重组酶对碱性环境的敏感性低于酸性环境,当pH大于9.5时,其相对酶活才降低到较低水平。在pH稳定性探究实验中,该重组酶在室温(25℃)下放置6 h和4℃放置24 h酶活稳定范围较宽,在pH为4.5~8.5时,其剩余酶活均可维持在80%左右的较高水平;但是对较酸性环境和碱性环境比较敏感。与原始菌的α-葡聚糖酶[24]相比,最适pH值一致,但其pH稳定范围略有提高,在碱性环境pH 8.5时仍有良好的稳定性。而油脂酵母来源的α-葡聚糖酶基因在毕赤酵母GS115中表达后所产重组酶的pH稳定范围仅为4~6[23]。
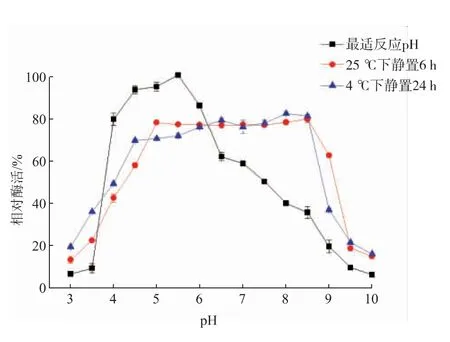
图9 重组α-葡聚糖酶的最适反应pH和pH稳定性Fig.9 Optimal pH and p H stability of recombinantαglucanase
不同种类和浓度的金属离子对该重组酶产生的影响不同,结果见表3。其中,Mg2+、Ca2+、Fe3+、Li+、Na+在低浓度(小于10 mmol/L)时对该重组酶有轻微的抑制作用,但在较高浓度(10 mmol/L)时,Ca2+和Fe3+又对其具有轻微的促进作用,使其相对酶活略有提高。Zn2+、Cu2+、Cr3+、K+均对该重组酶有不同程度的抑制作用,其中Zn2+和Cu2+对其的影响随着浓度升高逐渐增强,其中Cu2+的抑制作用最为明显,在低浓度(0.1 mmol/L)时,该重组酶的相对剩余酶活已低于50%,在浓度为10 mmol/L时,其相对剩余酶活已不足10%。Cu2+对该酶的抑制作用与许多研究报道一致[7、9、12]。而Cr3+、K+则是在低浓度(0.1 mmol/L)和较高浓度(10 mmol/L)时对其有抑制作用。Fe2+在1 mmol/L以下浓度时对该重组酶有抑制作用,但在较高浓度(10 mmol/L)时对其激活促进作用明显增加。还有一些离子如Na+、Co+、Mn2+等对该重组酶的抑制和促进作用均不太明显。
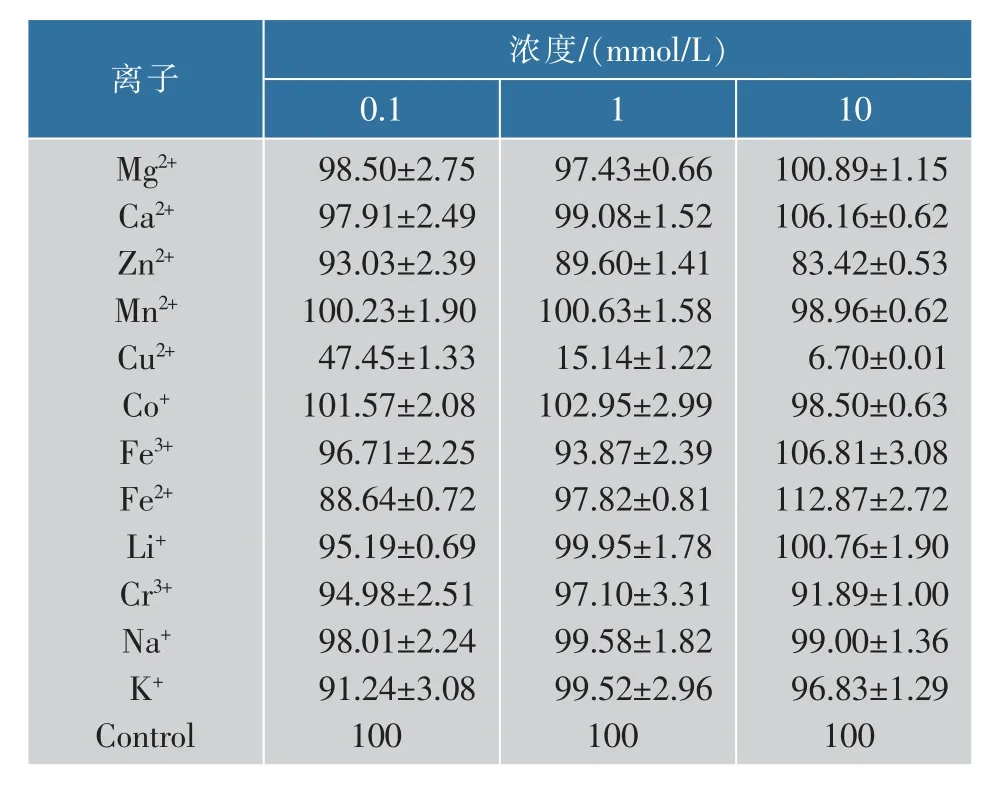
表3 金属离子对重组α-葡聚糖酶相对酶活的影响Table 3 Effectsof metal ions on recombinantα-glucanase
根据该重组α-葡聚糖酶催化不同底物时的反应速率,采用线性拟合法计算出该重组酶催化不同相对分子质量底物(底物分别为葡聚糖T20、T40、T70和T2000)时的动力学参数,结果如图10所示。由图10可计算得出该重组酶对葡聚糖T20、T40、T70和T2000的Km值分别为:2.25×10-3、1.32×10-3、1.89×10-4、7.4×10-6mol/L,Vm分 别 为:1.20×10-2、5.83×10-3、7.33×10-3、2.72×10-5mol/(L·min)。Kcat=3.81×102s-1。结果表明该重组酶对高相对分子质量的葡聚糖底物更具亲和力,葡聚糖T2000为最适底物。与原始菌α-葡聚糖酶一致[24],与王乐怡等[10]研究的重组α-葡聚糖酶最适底物一致。
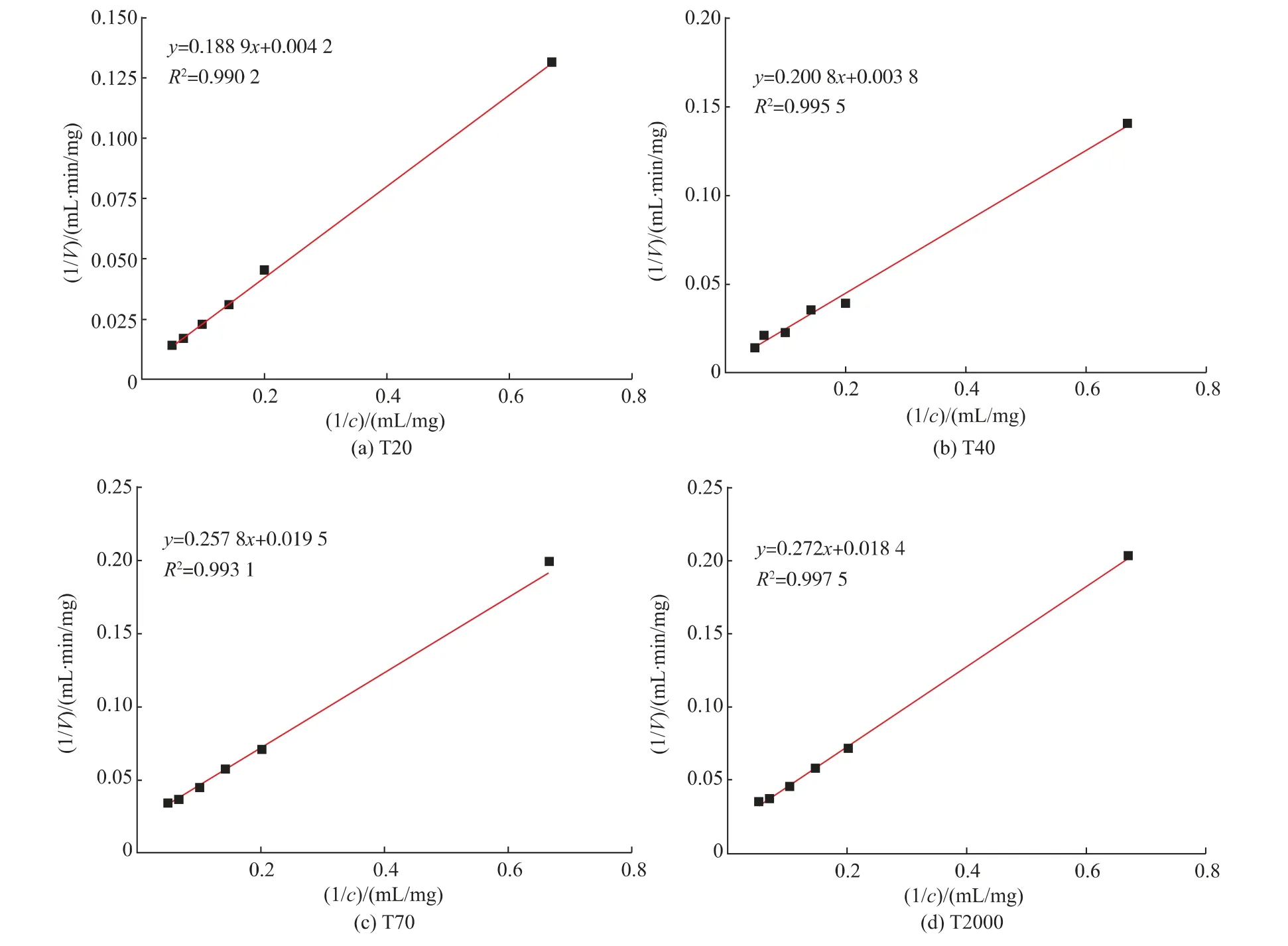
图10 重组α-葡聚糖酶对不同底物的动力学参数Fig.10 Kinetic parameters of recombinantα-glucanase on different substrates
3 结语
在前人研究基础上,将球毛壳菌(C.globosum)来源的α-葡聚糖酶基因序列根据巴斯德毕赤酵母密码子偏好性进行了优化合成,并成功构建了重组毕赤酵母菌株,经过高拷贝筛选及摇瓶水平的条件优化,将酶活提高了17.80倍。采用阴离子交换和阳离子交换双步层析相结合的纯化手段[25],成功将粗酶液纯化至电泳纯水平。对该重组酶的酶学性质探究发现,重组α-葡聚糖酶与野生菌产α-葡聚糖酶相比,最适温度和pH均一致,且pH稳定性范围有所提高,猜测可能是由于在真核细胞中发生了某种修饰,这种修饰作用使得该重组酶对碱性环境的耐受力更强。在探究酶动力学实验中发现该酶的最适底物同野生菌[11]的α-葡聚糖酶相同,且Km值(7.4×10-6mol/L)低于原始菌α-葡聚糖酶的Km值(3.1×10-2mol/L),说明重组后的α-葡聚糖酶对底物T2000的亲和性更高。
