多重免疫层析试纸辅助食品安全快速检测的研究进展
2021-11-30黄小林李倩影吴雨豪熊勇华
黄小林, 李倩影, 吴雨豪, 熊勇华
(1.食品科学与技术国家重点实验室,南昌大学,江西 南昌330031;2.南昌大学 食品学院,江西 南昌330031)
食品危害因子污染造成的食品安全问题,严重危害人类健康,制约经济社会发展。食品安全问题可涉及种植生产、加工运输、储藏销售等多环节,食品在任何一个环节遭受污染,都会引发潜在的食源性中毒及感染[1]。此外,多种食品危害因子可能共存于食品中,并在进入体内后产生协同增毒作用,严重威胁人类的身体健康。目前所建立的大多数分析方法侧重于对单一目标物实现精准、高灵敏检测[2]。然而传统针对单一目标物的检测方法只能够提供有限的样本信息,不够准确和高效。以快速、可靠的方式从单一食品样本中同时检测多个目标物,即多重检测,已受到研究人员的关注[3]。相较于传统单一检测,多重检测不仅能够提供更加丰富的样本信息,提高分析效率,降低误报或者漏报的风险,还能够减少样本使用量、缩短检测时间以及降低分析成本[4]。
高效液相色谱(high performance liquid chromatography,HPLC),气相色谱(gas chromatography,GC)、高效液相色谱串联质谱 (high performance liquid chromatography-tandem mass mpectrometry,HPLCMS/MS)及多重聚合酶链式反应(multiple polymerase chain reactions,mPCR)等方法已被广泛应用于食品危害因子的多重检测[5-8]。尽管此类方法具有较好的灵敏度和准确性,然而其存在样本前处理过程复杂、检测成本高、需要专业的实验技术人员以及仪器设备辅助检测等缺点,难以满足快速高通量筛查的需求。免疫层析试纸因其简单快速、成本低廉、结果易读以及无须特殊仪器辅助检测等优点,在食品安全检测等领域得到长足应用[9]。多重免疫层析试纸因其保留了免疫层析技术的优势,同时整合了多重检测的性能,已逐步成为一个高效的多重检测平台。
作者综述了多重免疫层析试纸在食品安全检测中应用的研究进展(见表1),介绍了不同类型信号标记物在改善多重检测能力、提高检测效率等方面的理论机制。
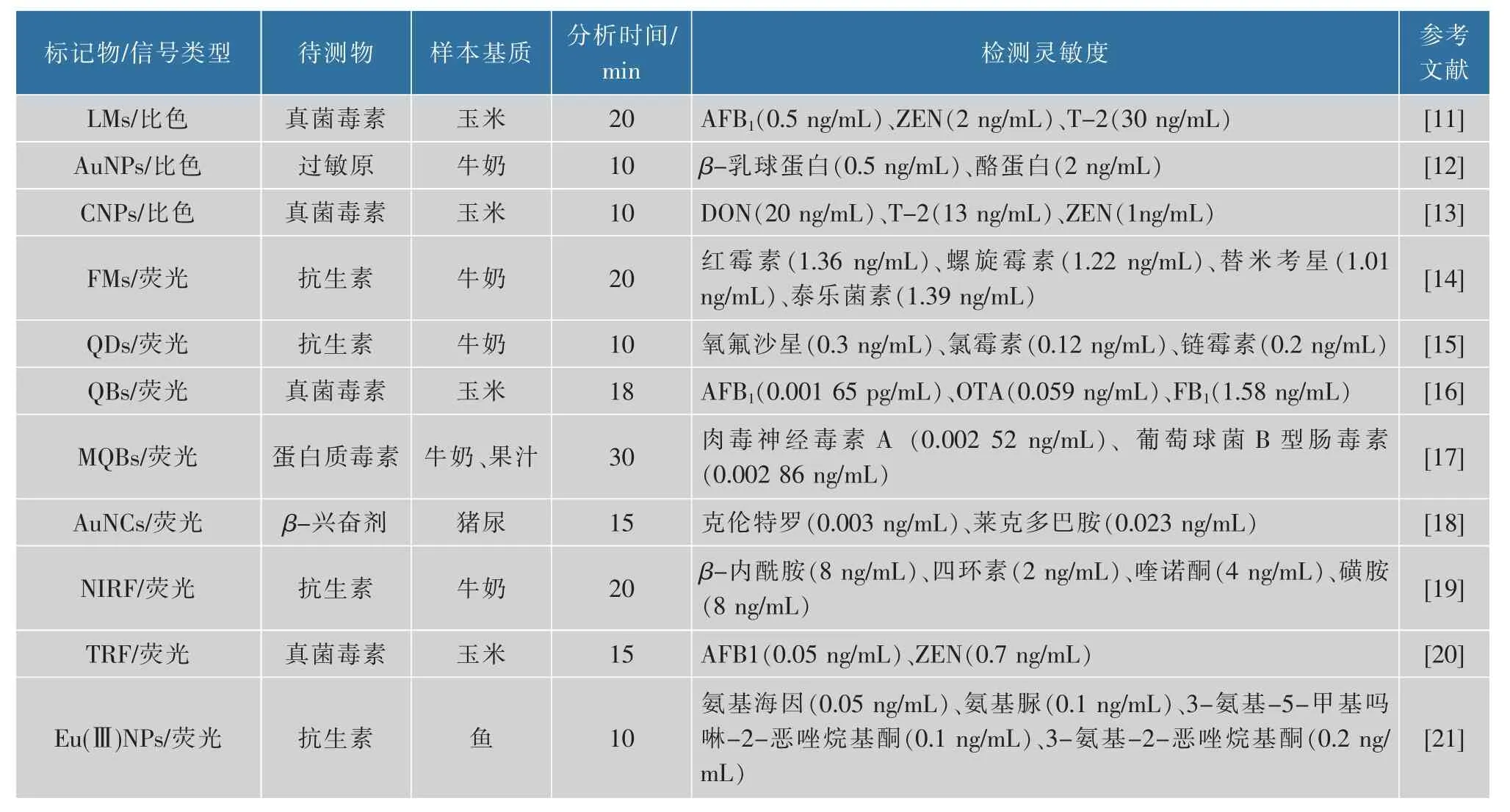
表1 多重免疫层析试纸条在食品安全检测中的应用Table 1 Application of multiplex immunochromatographic test strips in food safety detection
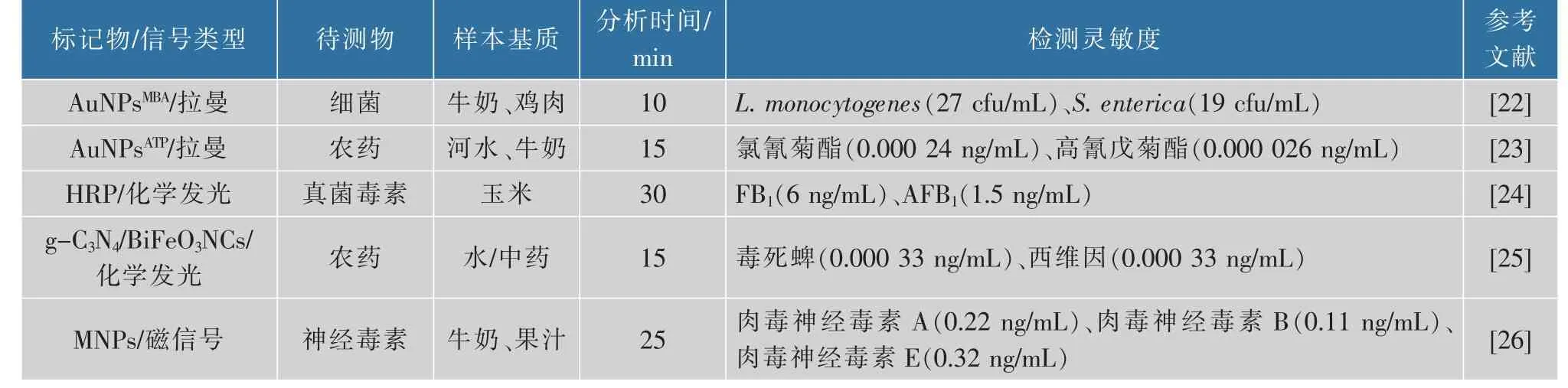
续表1
1 基于比色信号的多重免疫层析试纸
比色信号是免疫层析试纸中应用最为广泛的信号检测模式。其检测原理是比色纳米探针借助特异性的分子识别(如抗原抗体反应)沉积在检测线(T线)上,产生可供判读的颜色条带,仅需通过肉眼或者借助读取仪即可实现待测物的定性及半定量分析。目前常用的比色型标记探针主要包括乳胶微球、胶体金、胶体碳、胶体硒和其他有色标记物。
乳胶微球(latex microspheres,LMs)具有成本低廉、易于合成、色彩丰富等优点,适合用作比色信号探针构建多重免疫层析试纸条。Wang等将修饰了链霉亲和素的LMs分别与抗氨基脲抗体、抗氨基海因抗体、抗3-氨基-5-甲基吗啉-2-恶唑烷基酮抗体和抗3-氨基-2-恶唑烷基酮抗体偶联制备检测探针,同时将相应的竞争抗原及抗体喷涂于硝酸纤维素膜(nitrocellulose,NC)上作为T线和质控线(C线),用于构建适用于同时检测上述4种待测物的多重免疫层析试纸条[27]。结果表明,该方法可成功用于对鸡、鱼、虾等动物源性食品中4种硝基呋喃代谢物的同时检测,分析时间仅需10 min。采用类似的检测原理,研究者们也实现了不同种类食品中真菌毒素和抗生素残留的同时检测。
贵金属纳米材料的摩尔消光系数较有机染料高1 000倍,理论上有助于提高免疫层析试纸条的灵敏度。鉴于此,越来越多的研究团队采用贵金属纳米材料(如金、银等)作为比色信号探针用于构建多重免疫层析试纸。Han等构建了以胶体金(gold nanoparticles,AuNPs)为检测探针的多重免疫层析分析方法,其检测原理如图1所示。在这项研究中,AuNPs通过静电吸附作用与单克隆抗体偶联制备检测探针,同时在试纸条检测区域设置8条T线和1条C线,建立了能够同时检测牛奶中的黄曲霉毒素M1、三聚氰胺、喹诺酮、四环素、β-内酰胺、磺胺、氯霉素及链霉素等8种危害因子的多重免疫层析试纸[28]。结合银染信号放大技术,Yu等实现了玉米样本中伏马毒素B1(fumonisin B1,FB1)及玉米赤霉烯酮(zearalenone,ZEN)的增敏检测[29]。结果表明,该方法的检测灵敏度较常规AuNPs免疫层析方法提高了2.5倍和2.0倍。此外基于贵金属纳米材料的多重免疫层析技术在生物毒素[30]、农兽药残留[31]及重金属污染检测[32]中也具有突出的性能。
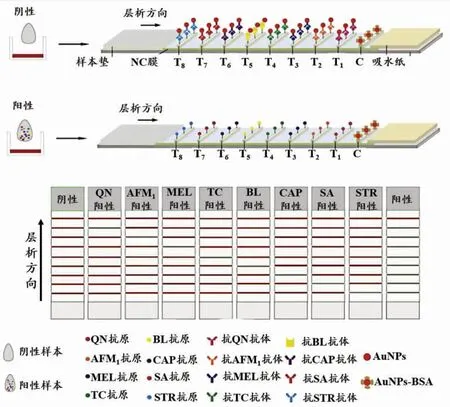
图1 基于胶体金的多重免疫层析试纸条示意图Fig.1 Schematic description of AuNPs-based multiplex immunochromatographic test strip
胶 体 碳(carbon nanoparticles,CNPs)因 其 呈 现棕黑色与NC膜的白色背景形成强烈颜色对比,因此具有更高的信噪比和灵敏度。此外相对于AuNPs,CNPs稳定性好、无毒且价格低廉,可作为免疫层析试纸条的替代标记物[33]。Noguera等采用CNPs作为比色信号标签建立了高灵敏检测4种产志贺毒素大肠杆菌毒力因子编码基因(vt1、vt2、eae、ehxA)的多重免疫层析方法,其检测灵敏度高于常用定量PCR方法,且检测时间仅需45 min。Zhang等[13]报道了一种易于合成的无定型CNPs,并将其作为多重免疫层析比色信号探针,用于玉米样本中3种真菌毒素的同时检测[34]。结果表明,该方法对(deoxynivalenol,DON)、T-2毒素和ZEN的检出限为20、13μg/kg和1μg/kg,其检出限较AuNPs和量子点高8倍和2倍。
2 基于荧光信号的多重免疫层析试纸
比色信号易受待测样品本底颜色干扰,难以应用于有色食品样本检测。基于荧光信号的免疫层析方法具有灵敏度高、稳定性好、不受样本颜色干扰等优点,现已成为食品安全快速检测的研究热点。目前,应用于构建多重免疫层析试纸条的荧光信号标记物主要包括荧光微球、量子点微球、金纳米团簇(gold nanoclusters,AuNCs)、上转换纳米材料等。
荧 光 微 球(fluorescent microspheres,FMs)是 通过将具有荧光特性的有机染料包裹于聚苯乙烯微球而形成。与单分子有机荧光素相比,FMs具有更高的荧光信号强度、结构稳定性和光稳定性。Zhang等[35]选取商品化的红、绿两色FMs分别与2种藻类毒素单克隆抗体偶联,并以此为荧光探针构建了可同时检测鱼肉中微囊藻毒素(microcystin-LR,MCLR)和冈田酸(okadaic acid,OA)的免疫层析试纸条。结果表明,该试纸条对MC-LR和OA的检出限分别为0.074μg/kg和2.42μg/kg,且该方法的检测结果与HPLC-MS/MS相关性好。
量子点(quantum dots,QDs)具有量子产率高、光稳定性好、耐光漂白及发射波长可调等优势,被视为免疫层析领域极具应用前景的信号标记物。基于QDs的免疫层析试纸条,大大提高了灵敏度。Taranova等[15]选用发射波长为525、585、625 nm的水溶性QDs作为荧光信号探针,在N-羟基琥珀酰亚胺作用下分别与抗氧氟沙星抗体、抗氯霉素抗体和抗体链霉素抗体偶联,构建了可同时检测牛奶中3种抗生素的免疫层析分析方法。最佳检测条件下,该试纸条对氧氟沙星、氯霉素和链霉素的检出限为0.3、0.12、0.2 ng/mL,灵敏度较对应ELISA方法高80~200倍。 量子点荧光微球 (quantum dots nanobeads,QBs)是一种将大量QDs封装于聚合物基质而成的新型荧光纳米材料。与QDs相比,QBs具有更高的荧光强度和更强的环境耐受性,有助于提高免疫层析试纸条灵敏度和稳定性[36]。Shao等[37]采用微乳液自组装成功地制备了粒径约为100 nm、发射波长为618 nm的QBs,并将其作为信号标记物构建了可同时检测玉米中黄曲霉毒素B1(aflatoxin B1,AFB1)和ZEN的免疫层析分析方法。在最优条件下,该方法对AFB1和ZEN的灵敏度分别为1.65、59.15 pg/mL。磁性QBs(magnetic QBs,MQBs)因其兼具磁性和荧光信号输出,可同时对目标物实现磁富集和荧光传感,从而进一步提高试纸条的灵敏度。Wang等采用活化酯方法将MQBs分别与抗肉毒神经毒素A(botulinum neurotoxin type A,BoNT/A)抗体和抗葡萄球菌B型肠毒素(staphylococcal enterotoxin B,SEB)抗体偶联制备检测探针,在检测过程中,分散在样本中的检测探针捕获目标物,并在外加磁场下进行富集浓缩,磁回收探针随后用于免疫层析分析[17](如图2)。结果表明,该方法对BoNT/A和SEB的检出限分别为2.52、2.86 pg/mL。
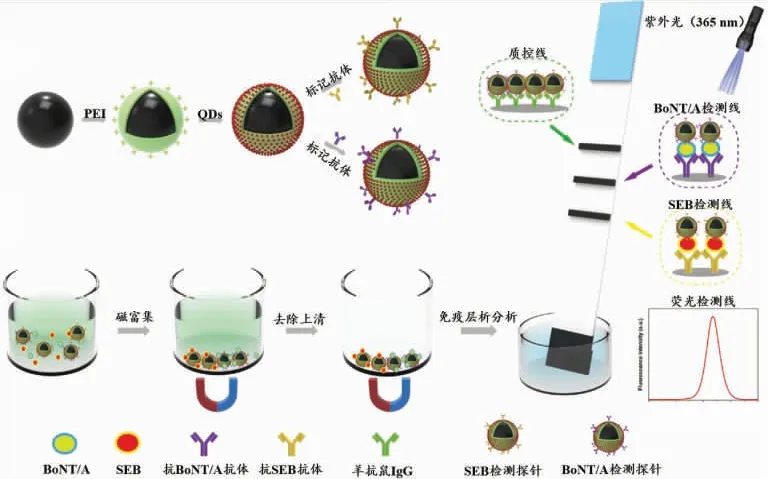
图2 基于荧光-磁复合材料多重免疫层析试纸条原理图Fig.2 Schematic of multiplex immunochromatographic test strips based on fluorescent-magnetic composite nanomaterials
传统短波长发射荧光标记物易受光散射和自荧光的干扰,导致背景荧光信号增强,信噪比降低。相比之下,近红外荧光(near infrared fluorescence,NIRF)信号探针能有效规避背景荧光信号带来的影响,显著提高信噪比,有助于增加灵敏度[38]。Chen等报道了适用于动物源性食品中多种抗生素同时检测的近红外免疫层析试纸条[19]。在此研究中,染料被用作为近红外荧光信号标记物,在近红外激发光的照射下结合荧光成像系统采集试纸条T线上的荧光信号,并以此构建荧光强度与目标物浓度之间的线性关系,实现了牛奶中内酰胺类、四环素类、喹诺酮类和磺胺类抗生素的快速检测。时间分辨荧光(time resolved fluorescence,TRF)也是消除背景荧光信号以提高灵敏度的常用方法。Chang等使用Eu(Ⅲ)纳米粒子偶联抗AFB1抗体、抗ZEN抗体及抗赭曲霉毒素A(ochratoxin A,OTA)抗体以制备检测探针,并以此构建了高灵敏同时检测谷物食品中AFB1、ZEN及OTA的免疫层析试纸条[39]。结合TRF信号读取仪,该方法对AFB1、ZEN和OTA的检测灵敏度分别为0.04、0.20、0.10μg/kg。
3 基于表面增强拉曼散射信号的免疫层析试纸
与荧光信号相比,表面增强拉曼散射(surface enhanced Raman scattering,SERS)信号具有更高的光学强度和光稳定性[40]。此外SERS信号具有优异的单分子检测及多重检测的能力。鉴于此,SERS纳米材料可作为免疫层析技术的高灵敏信号探针,广泛应用于各种生物标志物的定量检测[41]。Shi等通过表面配位将对氨基苯硫酚 (4-aminothiophenol PATP)修饰在AuNPs表面制备AuNPsPATP信号探针,通过AuNPs表面局域电磁场显著增强PATP分子的拉曼信号[42]。随后通过静电吸附作用进一步将抗新霉素抗体和抗喹诺酮抗体标记至AuNPs表面制备检测探针。结合竞争免疫分析模式,构建了同时检测牛奶中新霉素和喹诺酮的免疫层析方法。如图3所示,随着AuNPsPATP检测探针在T线的沉积,T线可产生较强的比色信号;此外,在He-Ne激发光源的照射下,探针表面的PATP分子可产生波数为1 078 cm-1拉曼信号[42]。在最佳检测条件下,基于比色信号对新霉素和喹诺酮的定量检出限分别为10、200 ng/mL,而基于SERS信号的定量检出限分别为0.37、0.55 pg/mL。此外以不同拉曼分子作为信号探针结合单一T线检测也能实现多种目标物的同时检测。Wu等将4-巯基苯甲酸 (4-mercaptobutyramidine,4-MBA)和5,5’-二硫代双(2-硝 基 苯 甲 酸)(5,5’-dithiobis(2-nitrobenzoic acid),DTNB)分别标记于AuNPs表面以合成两种具有不同特征峰的SERS标签AuNPs4-MBA和AuNPsDTNB,结合双抗体夹心免疫分析模式,构建了高灵敏检测单增李斯特菌和鼠伤寒沙门氏菌的拉曼免疫层析试纸条[43]。通过记录4-MBA(1 343 cm-1)和DTNB(1 567 cm-1)的拉曼特征峰,实现了单一T线上两种拉曼信号的高效分离,避免了信号间的相互干扰。在最优检测条件下,该方法对两种致病菌的检出限均低至75 CFU/mL。
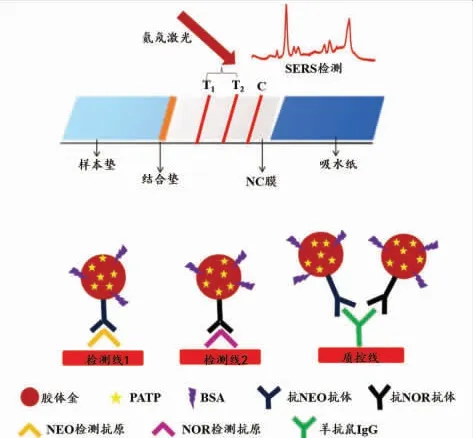
图3 基于表面增强拉曼散射信号的多重免疫层析试纸原理图Fig.3 Schematic illustration of SERS-based multiplex immunochromatographic test strip
由于AuNPs表面热点对拉曼分子的信号增强能力有限,且位于金属表面的拉曼报告分子容易受到检测环境的干扰,导致检测信号不稳定、检测灵敏度偏低。Liu等[22]通过在表面修饰了MBA的金纳米粒子表面还原生长银壳,制备得到拉曼分子位于金核和银壳之间的核壳式拉曼探针(AuMBA@Ag)。金核和银壳之间高强度的局域电磁场显著增强了MBA分子的拉曼信号,有利于提高多重免疫层析试纸的检测灵敏度。将该探针应用于构建多重免疫层析分析,并结合重组酶聚合酶链式反应,实现了对牛奶、鸡胸肉或牛肉等食品样品中单增李斯特菌和鼠伤寒沙门氏菌毒力基因的同时检测。最佳检测条件下,该方法对两种致病菌的检测灵敏度分别为27、19 CFU/mL。
4 基于化学发光信号的多重免疫层析试纸
与荧光、拉曼信号不同,化学发光(Chemiluminescence,CL)信号是利用化学反应来诱导发射,检测信号的产生不依赖于昂贵的激发光源及滤光片。化学发光信号具有较高的信噪比和检测灵敏度,适用于痕量目标物的高灵敏检测[44]。Zangheri等将辣根 过 氧 化 物 酶 (horseradish peroxidase,HPR)标记两种真菌毒素单克隆抗体制备检测探针,以鲁米诺和过氧化氢作为化学发光底物,建立了基于酶催化化学发光的竞争型多重免疫层析分析方法[24]。当样本中不存在或存在低浓度目标物时,抗体标记的HRP酶被T线上竞争抗原捕获,从而催化双氧水产生羟自由基,羟自由基再与鲁米诺氧化产生高强度的化学发光信号;随着目标物浓度的升高,T线捕获的HRP酶减少,化学发光信号强度也随之降低。该方法对玉米中FB1和AFB1的检出限分别为6μg/kg和1.5μg/kg。与天然HPR酶相比,具有类过氧化物酶活性的纳米材料因其具有更高的化学稳定性、环境耐受性以及酶催化活性,可作为酶的替代物用于高性能生物传感器的开发。此外沉积在T线上的纳米酶通常能够产生肉眼可见的比色信号,从而赋予了试纸比色和化学发光双信号读取能力。研究者合成了具有类HPR酶活性的石墨碳氮化物/铋铁氧体纳米复合材料(g-C3N4/BiFeO3NCs),并使用该复合材料作为比色和化学发光双模式探针建立了同时检测河水或中药样本中的毒死蜱(chlorpyrifos,CHL)和西维因(carbaryl,CAR)的免疫层析试纸(见图4),其中基于比色信号的检出限为50 ng/mL,而基于化学发光信号的定量检出限低至0.033 ng/mL[25]。
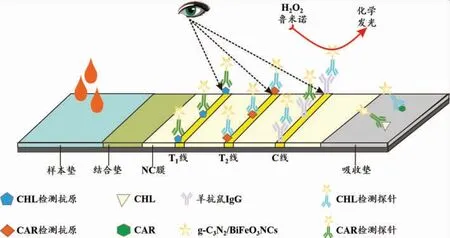
图4 基于比色-化学发光双信号读取的多重免疫层析试纸原理图Fig.4 Schematic of multiplex immunochromatographic test strip based on colorimetric-chemiluminescence dual-signal readout
5 基于磁信号的多重免疫层析试纸
光学免疫层析试纸仅能检测由少量沉积于NC膜表层信号探针产生的光学信号,然而将近90%信号探针无法被有效探测[45]。与光学信号相比,磁性信号穿透力更强,可有效提高检测信号的利用率。此外待测样品中通常不存在磁背景干扰,且磁信号采集不受光散射、自吸收、自荧光以及光漂白等影响,因此磁免疫层析技术具有信噪比高、检测信号稳定等优势[46]。结合配套的磁信号读取仪,不仅能提高磁性层析技术的灵敏度,也能提高其准确度。Wang等采用不同粒径磁性纳米颗粒(magnetic nanoparticle,MNPs)作为检测探针,结合饱和磁强度读取仪读取T线磁信号强度,初步证实了磁性探针在免疫层析试纸条平台的应用潜力[47]。研究结果表明,磁性层析技术的灵敏度较传统胶体金免疫层析试纸条约提高了10~1 000倍。鉴于其突出的优势,近年来磁性免疫层析技术赢得了研究者们广泛的关注,已被用于各种分析物的准确定量检测[48]。ORLOV等[26]采用羧基化MNPs作为检测探针,结合竞争免疫分析模式,建立了同时高灵敏检测牛奶中3种肉毒毒素A、B、E的磁免疫层析传感器。如图5所示,作者将3个独立的单重免疫层析试纸条叠加并组装在一个微型套管中,在加入样品10分钟后,通过磁性强度读取仪分别读取相应目标物T线的磁信号强度,并构建磁强度与目标分析物浓度的线性关系实现定量检测。在最优检测条件下,该方法对BoNT-A、BoNT-B、BoNT-E的检出限分别为0.2、0.11、0.32 ng/mL。

图5 基于磁纳米粒子的多重免疫层析试纸示意图Fig.5 Schematic description of MNPs-based multiplex immunochromatographic test strip
6 展望
多重免疫层析试纸因其操作简单、适用于现场等优点,在食品危害因子的快速筛查方面发挥了巨大作用。得益于材料科学和纳米技术的快速发展,各种各样的新型标记探针被开发用于增加多重检测的通量以及提高试纸检测性能。作者从检测信号的角度系统回顾了近年来多重免疫层析试纸在食品安全检测中应用的研究进展,并着重分析了各类信号探针的优缺点及适用场景(见表2)。将先进信号输出方式与免疫层析技术相结合,极大提高了多重检测的能力和灵敏度,改变了食品危害因子同时检测的研究现状。虽然如此,多重免疫层析试纸在单次检测中样本用量以及探针用量相对较大,因此如何减少二者的用量对于降低检测成本、拓宽待测物的应用范围具有重要意义。其次,样品前处理技术的滞后严重制约了食品分析技术的快速发展。虽然新型标记物的应用提高了免疫层析技术的灵敏度,但是复杂食品组分容易干扰检测信号的稳定性和重现性,从而影响检测结果的准确性和可靠性。近年来快速发展的磁分离技术、微流控技术以及其他前处理技术均可整合用于提高食品样本中待测物的分离纯化,降低样本基质干扰。最后,荧光、化学发光、SERS以及磁信号的读取通常需要昂贵的信号读取仪,增加了检测成本。基于智能手机的便携式读取仪具有成本低廉、设备轻便、可实时远程数据操纵等优点,可用于简化多重免疫层析方法的信号采集以及数据处理,大大提高检测结果的时效性。总之,未来的研究重点应集中于开发智能化、便携式、检测通量大、灵敏度高以及特异性好的多重免疫层析检测新方法,为食品中多种危害因子的同时检测提供技术支撑,切实保障人民群众“舌尖上的安全”。
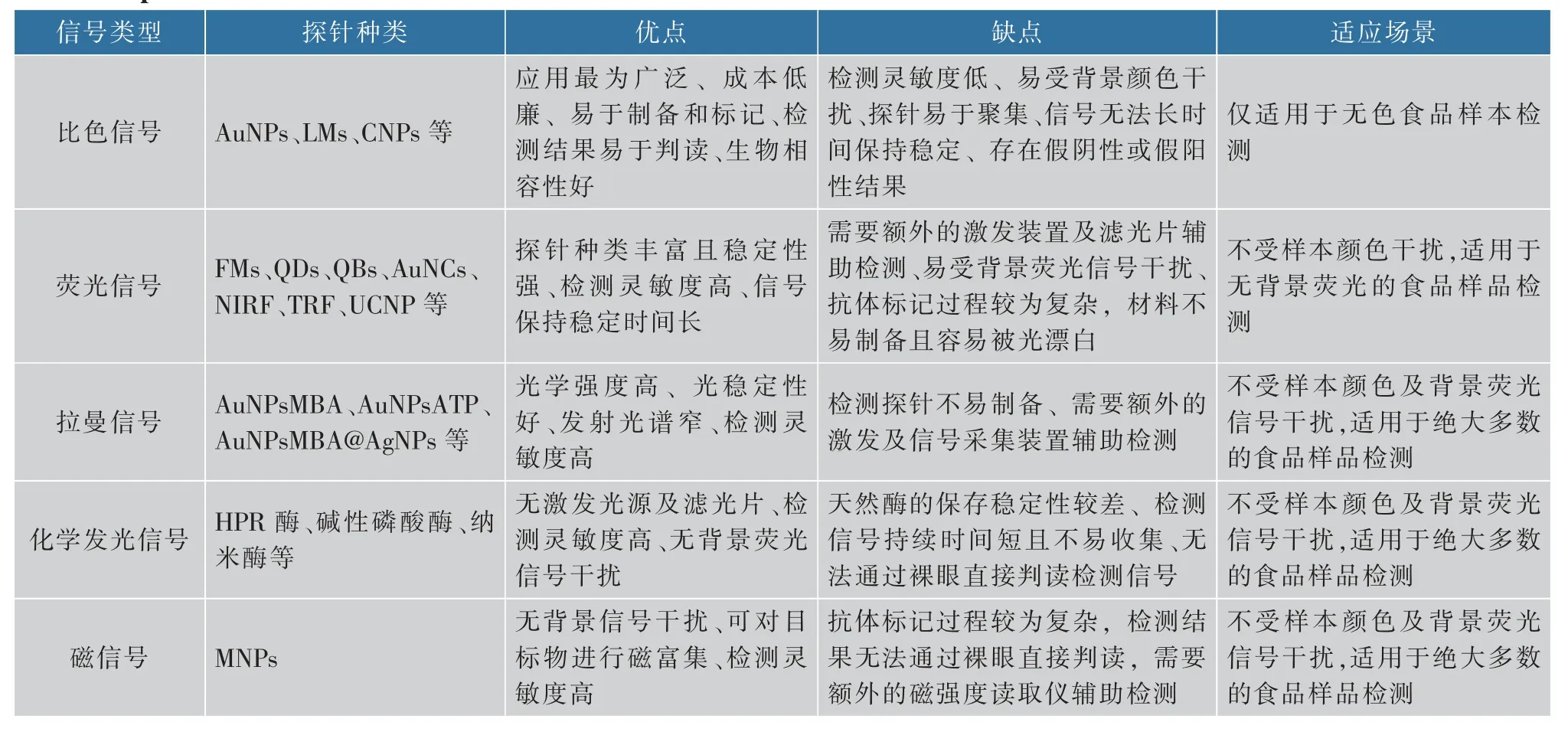
表2 不同类型信号输出模式的标记探针的优缺点及适用范围Table 2 A summary of advantages/disadvantages and applicable scope of labelled probes with different signal output patterns
