黏附型G蛋白偶联受体与肿瘤关系的研究进展
2021-11-30孙家唯潘霞
孙家唯 潘霞
G蛋白偶联受体(GPCR)在哺乳动物中有5个主要家族,其中黏附型G蛋白偶联受体(adhesion GPCR,aGPCR)家族为第2大家族,有33个成员。aGPCR由胞内域、七次跨膜域(7 transmembrane,7TM)和胞外域(extracellular domain,ECD)组成[1]。aGPCR在细胞膜附近的GPCR自溶诱导(GPCR autoproteolysis inducing,GAIN)结构域中的GPCR蛋白水解位点(GPCR proteolysis site,GPS)水解产生一个N-末端片段(N-terminal fragment,NTF)和一个C-末端片段(C-terminal fragment,CTF),两个受体片段通常不分离,而是以非共价复合物的形式存在,而GAIN结构域确保了NTF和CTF以非共价键的形式形成异源二聚体[1]。aGPCR主要调节细胞的黏附、迁移、极性和导向,而这与肿瘤发生所需的细胞生物学行为密切相关[2]。
在过去的20年里,关于与肿瘤发生过程相关的aGPCR的研究数量有限。CD97是首个被发现与癌症相关的aGPCR,CD97在正常甲状腺细胞和高分化乳头状癌及部分滤泡性甲状腺癌中不表达,但在间变性癌中表达增高。随后,其他的aGPCR如GPR56亦被发现与癌症相关[3]。而借助基因芯片、蛋白质组分析,越来越多在肿瘤发生、发展中发挥重要作用的aGPCR被发现。本文就aGPCR在肿瘤发生、发展中的表达、调节和作用的研究进展作一综述。
1aGPCR的分类
通过对aGPCR的7TM进行分类,人类基因组可分为9个不同的亚家族,共33个同源基因(表1)。每个亚家族都有一个独特的N端域组合,其N端长度差异较大。
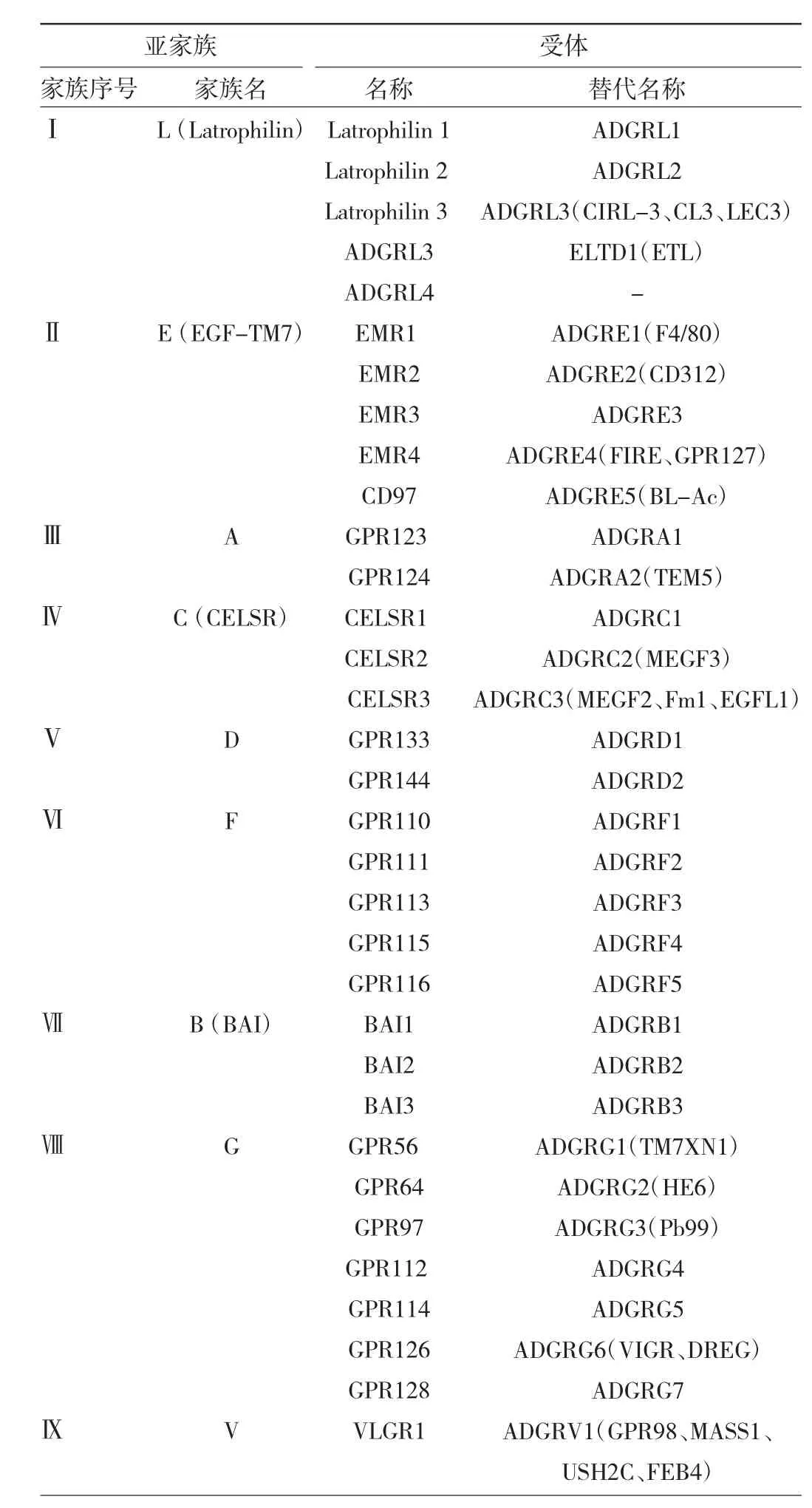
表1 aGPCR家族成员
aGPCR在GPS处自动裂解或者在ECD内的蛋白水解后会获得NTF甚至更小的片段,这些可溶性片段从aGPCR中释放至体液中。因此,可溶性NTF可以在大范围内与互作配体结合,从而调控肿瘤发生过程中的肿瘤-基质相互作用。据报道,存在循环可溶性NTF的aGPCR 有 GPR124、BAI1、BAI2、CD97、GPR116、GPR126和 LPHN1。不同的aGPCR虽然 NTF结构相同,但功能可能截然相反,体外和体内实验均证明CD97的NTF会与α5β3、αvβ2结合从而刺激肿瘤血管生成,促进内皮细胞迁移[4]。GPR124的NTF可以刺激内皮细胞的生成,BAI1的NTF则具有抗血管生成和抗肿瘤生成活性[5]。在炎症区域可检测到从CD97阳性免疫细胞释放的可溶性CD97,但患有CD97阳性肿瘤的患者的体液中检测不到CD97的存在[6]。以上研究均表明,NTF蛋白的释放与其功能密切相关,且有组织特异性。
2 aGPCR对肿瘤生物学行为的影响
2.1 细胞增殖、凋亡和周期 aGPCR通过调控肿瘤细胞分裂、凋亡从而影响肿瘤细胞增殖,但它们在信号传导中的作用尚不清楚。既往一项研究表明在结肠癌细胞HCT116和宫颈癌细胞HeLa敲低GPR56后可观察到短暂的细胞凋亡,且细胞生长被抑制,这表明GPR56具有促进肿瘤发生的功能[7]。在体外白血病细胞系中也有研究报道了类似的观察结果,提示GPR56的敲除诱导了细胞凋亡[8]。但另一项研究结果表明,GPR56可促进小鼠黑素瘤细胞A375P和MC-1的皮下种植瘤生长,而在体外实验中,对肿瘤细胞增殖无促进作用,进一步研究发现GPR56主要通过调节细胞外基质促进体内肿瘤生长[9]。GPR56的NTF可与组织转谷氨酰胺酶(transgluteminase 2,TG2)和胶原蛋白Ⅲ结合[9]。TG2是细胞外基质中的一种交联酶,免疫缺陷型TG2-/-小鼠的黑色素瘤生长受抑,而TG2+/+小鼠黑色素瘤生长明显加快,但TG2促癌作用可以被GPR56过表达从而介导的TG2内化和降解所拮抗[9],GPR56和胶原蛋白Ⅲ在癌症进展中的相互作用尚鲜见报道。GPR56对肿瘤细胞增殖和凋亡的影响在不同研究结果间相互矛盾,反映了GPR56的功能实现可能有组织特异性。
体外实验中,miRNA-139-5p可通过下调ELTD1抑制胶质母细胞瘤细胞增殖[10]。在血清饥饿和星形孢菌素诱导的条件下,CD97抑制纤维肉瘤细胞HT1080和宫颈癌细胞HeLa的固有凋亡[11]。肿瘤浸润性免疫细胞等基质细胞中aGPCR的表达改变也可能影响肿瘤进展。已有研究发现BAI1可作为巨噬细胞上的吞噬受体发挥作用,其可以通过将暴露于膜的磷脂酰丝氨酸基团结合到BAI1的细胞外血小板反应素重复序列来识别凋亡细胞。巨噬细胞或肿瘤细胞中的BAI1可能通过清除死亡肿瘤细胞发挥作用[12]。
2.2 细胞黏附 细胞黏附是恶性肿瘤转移过程中的关键步骤。既往研究发现一些aGPCR可影响肿瘤细胞黏附,但潜在调控机制尚未得到深入研究[8,13-14]。GPR64的促癌作用是由胎盘生长因子和基质金属蛋白酶1所介导的。在乳腺癌细胞系Hs578T和MDA-MB-231中沉默GPR64可致细胞黏附和迁移减少[13]。当急性髓细胞白血病细胞敲低GPR56后,与细胞外基质的黏附则减少[8]。GPR56在细胞-细胞外基质黏附中起促进作用,但是否不同肿瘤细胞都有同样的现象,以及这是否是GPR56在癌症进展中的主要发挥的功能仍有待研究。在乳腺癌细胞系Hs578T和MDA-MB-231中沉默GPR64可导致细胞黏附和迁移的减少[13]。其他aGPCR如EMR2和GPR126也可与细胞外基质相互作用[14],但对肿瘤的影响尚不清楚。
2.3 细胞迁移和侵袭 在所有的aGPCR中,关于CD97在细胞迁移和侵袭中作用的研究最多。CD97对肿瘤侵袭的促进作用在体外和体内实验模型中均已得到证实,对15种不同的结直肠癌细胞系的Transwell实验证明了CD97可促进细胞迁移[8],并促进急性髓系白血病细胞MV4-1向FBS和溶血磷脂酸的趋化迁移[15]。但目前已经发表的关于CD97对肿瘤的迁移的影响的研究结果常常相互矛盾。一项研究结果提示CD97过表达可以增加结肠癌细胞迁移并诱导肿瘤早期生长[6];在小鼠胃癌模型中,亦提示CD97可促进局部肿瘤生长和转移扩散[16];而另一项研究得出了相反的结论:CD97可通过调节基质金属蛋白酶-2活性来抑制人纤维肉瘤细胞的迁移[17]。体外细胞实验结果表明CD97可促进胶质母细胞瘤细胞的迁移侵袭,CD97 siRNA靶向干扰后两种胶质母细胞瘤细胞的迁移和侵袭受到抑制,但增殖未受影响,蛋白质质谱组学分析显示CD97在高侵袭性胶质母细胞瘤细胞的侵袭性伪足处富集[18]。
GPR56在白血病细胞系中可抑制细胞向基质细胞衍生因子1的迁移[8]。在黑色素瘤转移模型中,GPR56表达与转移情况负相关,且GPR56的过表达抑制黑色素瘤细胞的生长和转移[19]。GPR116可通过Gαq-p63RhoGEF-RhoA/Rac1途径促进乳腺癌细胞MDA-MB-231中细胞趋向血清的迁移和侵袭[20]。
2.4 新生血管生成 新生血管的生成对肿瘤持续生长至关重要,研究发现aGPCR部分成员参与调节肿瘤血管生成,其中最受关注的是BAI1。胶质母细胞瘤是恶性程度最高的原发性颅内脑肿瘤,治愈率较低,已有研究均表明BAI1可抑制胶质母细胞瘤血管生成[5],此外在结肠癌、乳腺癌、胃癌和肾细胞癌中也发现BAI1具有抑制新生血管生成的作用[21]。BAI1可在GPS处被切割,释放出一种名为血管生长抑制素120的可溶NTF,通过阻断αvβ5整合素抑制内皮细胞的增殖,减少微血管内皮细胞的迁移,并抑制体内血管生成和神经胶质瘤生长[5]。近期有研究在BAI1中新发现了在末端也可进行蛋白水解,然后可切割形成一个包含精氨酸甘氨酸天冬氨酸盐的NTF,该片段在体外和体内均能够抑制血管生成[22]。BAI1的ECD包含促甲状腺素受体,而既往研究表明促甲状腺素受体可负调节血管生成[23]。GPR56过表达可通过抑制蛋白激酶Cα的活化致黑色素瘤细胞分泌血管内皮生长因子受到抑制,从而抑制血管生成[9]。与全长受体的功能相反,GPR56中CTF片段的缺失会促进磷脂肌醇-α信号通路活化、增强血管内皮生长因子分泌和血管生成。GPR56及其CTF的这些相反功能表明GPR56可能存在不同的激活状态。
许多aGPCR可刺激肿瘤中的新血管形成。GPR124为肿瘤内皮标志物,在人内皮细胞中敲除GPR124会抑制小鼠移植瘤的血管生成和肿瘤生长。一项体外实验结果提示GPR124可促进血管内皮生长因子诱导的肿瘤血管的生成[24]。ELTD1是肿瘤血管生成的关键调节因子,在小鼠高级别胶质瘤模型中,ELTD1抗体可以有效的阻断血管生成[25]。CD97的NTF可通过结合整合素α5β1和αvβ3来促进血管生成,并在内皮细胞中引发趋化反应,使之募集到肿瘤处[4]。体外的鸡胚尿囊膜实验和内皮细胞管腔形成实验结果均提示CD97的过表达能够促进纤维肉瘤细胞HT1080的管腔形成[26]。
3 aGPCR的临床意义
越来越多的研究表明肿瘤中aGPCR表达发生改变且与疾病的临床特征具有相关性,提示aGPCR可作为潜在的肿瘤诊断、预后预测的标志物和治疗靶点。
3.1 ADGRE CD97是唯一一个不仅可在免疫细胞表达的ADGRE家族成员,还可以在上皮和间充质来源的细胞中表达[27]。CD97几乎在所有肿瘤细胞中呈阳性,且其高表达与淋巴结转移、肿瘤浸润深度、肿瘤分期及患者不良预后相关。在神经母细胞瘤中CD97水平较低,在小细胞肺癌中CD97呈阴性,而在非小细胞肺癌中CD97呈强阳性,这提示检测CD97水平有助于肺癌的鉴别分类[27]。在正常人肠上皮细胞中,CD97低水平表达,而在结直肠癌中,CD97表达增加且在细胞中的表达位置改变[6]。CD97在低分化胰腺导管腺癌的肿瘤细胞中高表达,但在正常胰腺上皮细胞中不表达[28]。一项纳入了37例胰腺癌患者的研究结果显示,CD97与胰腺癌侵袭性、预后相关[29]。在分别纳入了187和539例胶质母细胞瘤患者的两项独立队列研究中,CD97在Ⅳ期胶质母细胞瘤中表达上调,且与预后相关[30]。此外,CD97表达水平对白血病的评估非常关键,通过对白血病细胞表面蛋白质研究发现,CD97可作为急性淋巴细胞白血病微小残留病灶的有效标志物,且CD97也是急性髓系白血病中的白血病干细胞标志物[31]。糖基化模式改变是肿瘤的常见特征,CD97在正常平滑肌细胞和骨骼肌细胞中核心蛋白未修饰,而在对应肿瘤细胞即平滑肌肉瘤和横纹肌肉瘤细胞中,CD97被N-糖基化[29];且与互作配体CD55结合过程中,CD97的N-糖基化是必需的,这与CD97和CD55经常在肿瘤中共表达的现象一致[29]。
ADGRE成员EMR1-3只在白细胞中表达,因此,EMR1-3几乎只在血液恶性肿瘤的细胞中表达[32]。EMR2在胃癌、胰腺癌、食管癌和结肠直肠癌中不表达或表达水平很低[33]。据报道EMR2蛋白在乳腺癌中高表达且浸润性肿瘤中的EMR2表达水平明显高于原位癌,且EMR2高表达与患者不良预后相关[33]。EMR2在胶质母细胞瘤特别是在间充质亚型中上调,并且与总生存率较差和侵袭性表型相关[34]。
3.2 ADGRG 在ADGRG成员中,GPR56与肿瘤关系的研究是最多的。1999年Zendman等[3]就发现与低转移性细胞系相比,在高转移性黑色素瘤细胞系中GPR56表达下调。Kausar等[35]与在黑色素瘤中的抑癌作用相反,GPR56在其他癌症类型中较之相应正常组织表达上调。GPR56可作为一种具有较强再增殖能力白血病亚群标志物,并且GPR56高表达与高风险基因亚组和不良预后显著相关[36]。
3.3 ADGRB ADGRB成员BAI1-3蛋白主要在脑组织中表达。与正常组织相比,在原发性神经胶质瘤、肺腺癌、胃癌、结肠直肠癌以及肺腺癌脑转移瘤中,BAI1表达水平下调,乳腺癌中BAI1的表达显著降低,并与患者预后不良相关[37]。BAI2和BAI3基因与BAI1具有序列同一性,其中BAI1包含5个血小板反应蛋白1型重复序列,而BAI2或BAI3每个仅包含4个,与BAI1不同,BAI2或BAI3在神经胶质瘤细胞中没有被沉默的现象[38]。而在肺癌、乳腺癌、卵巢癌和脑癌几种肿瘤中,BAI1会发生基因沉默或体细胞突变[39],提示肿瘤发生的过程可能需要阻断BAI1的功能。但迄今为止,突变是否改变了BAI1在肿瘤中的作用尚鲜见研究报道。
3.4 其他基因 CELSR在肿瘤中表达情况的相关临床研究较少。慢性淋巴细胞白血病患者的B细胞中CELSR1上调[27]。而CELSR1和CELSR3分别在胃肠肿瘤和脑肿瘤中高表达[40]。
ELTD1可参与体外和体内生理、病理血管生成调节,在肿瘤周围血管中的表达上调,是胶质母细胞瘤相关的微血管系统95个上调基因之一。与恶性程度低的胶质瘤相比,ELTD1在高度恶性胶质瘤中表达水平更高[25]。
4 小结与展望
aGPCR参与肿瘤细胞的增殖、迁移和侵袭过程,影响肿瘤发生、发展的各个阶段。aGPCR的作用机制多样,NTF、CTF、NTF-CTF相互作用等都可能各自介导不同的信号传递,这些都为aGPCR在肿瘤中发挥作用提供了结构基础。但由于许多aGPCR的配体尚未被发现,目前对aGPCR作用的研究仍不够深入,未来应广泛开展aGPCR作用研究,在分子水平探究受体激动信号途径和生理作用,以便临床、药物研发等得以开展,为肿瘤的防治提供重要的理论依据及实验基础。
