促性腺激素释放激素激动剂对子宫腺肌病病灶及子宫内膜Ki-67、VEGF、NGF 表达及神经纤维分布的影响
2021-11-30陈君霞王运根章英孙丽萍
陈君霞 王运根 章英 孙丽萍
子宫腺肌病是一种良性子宫疾病,其定义为子宫内膜腺体及间质存在于子宫肌层内[1],临床表现为痛经、子宫异常出血、月经过多、不孕、流产等。在子宫腺肌病发展过程中,子宫内膜腺体和间质的植入需要细胞增殖和血管生成共同完成。另外,有研究发现腺肌病病灶神经纤维分布异常可能在子宫腺肌病疼痛发生机制中起重要作用[2-3],子宫腺肌病患者疼痛的严重程度与子宫内膜和肌层神经纤维的增加密切相关,而与病变的程度无关[3]。目前普遍认为子宫腺肌病和子宫内膜异位症有类似的发病机制,受相同的类固醇激素影响。短效口服避孕药或孕激素治疗均可明显缓解子宫内膜异位症患者的盆腔疼痛,且已证实这两类药物均可显著降低子宫内膜异位症患者子宫内膜和子宫肌层的神经纤维密度[4-5]。促性腺激素释放激素激动剂(GnRHa)为人工合成的十肽类化合物,对促性腺激素释放激素(GnRH)受体的亲和力较天然GnRH高百倍,可持续抑制垂体分泌促性腺激素,导致卵巢激素水平明显下降,是临床上治疗子宫腺肌病和子宫内膜异位症的常用药物。本研究探讨GnRHa对子宫腺肌病患者子宫腺肌病病灶及子宫内膜细胞增殖、血管增殖、神经生长因子及神经纤维密度的影响,现报道如下。
1 对象和方法
1.1 对象 选取2014年1月至2020年6月绍兴市人民医院收治的因子宫腺肌病行经腹或腹腔镜下子宫全切术的患者68例,患者年龄32~50(45.68±3.39)岁。纳入标准:(1)患者年龄30~50岁,存在重度痛经[视觉模拟评分法(VAS)评分7~9分],伴或不伴有月经量过多;(2)经临床表现及阴道超声检查明确诊断为子宫腺肌病;(3)所有患者既往均无腹部手术史、盆腔炎性疾病史、神经性疼痛病史或内分泌疾病史。排除标准:就诊前半年内接受过任何激素治疗。68例患者中,有36例同时存在月经过多。在接受子宫切除术前,所有患者均被告知可选择GnRHa预处理及相关的受益(缩小子宫体积有利于手术,缓解痛经,暂时性闭经改善贫血等)和可能出现的风险(低雌激素相关症状等)。权衡利弊后,其中36例患者选择术前GnRHa预处理作为GnRHa治疗组,另外32例患者选择直接手术治疗作为对照组。两组患者年龄、孕次、产次、月经过多发生率等方面比较差异均无统计学意义(均P>0.05),见表 1。

表1 两组患者一般资料比较
GnRHa治疗组患者于月经第1天给予皮下注射醋酸亮丙瑞林针3.75 mg(天津武田药品有限公司,规格:3.75 mg/支),此后每隔4周注射1次,共3个周期,末次注射后1个月内接受子宫全切术;对照组患者术前不作处理。两组患者行子宫全切除术后,迅速将切下子宫剖开,于子宫肌层寻找并切取子宫腺肌病病灶,同时切取子宫内膜组织,并将组织标本置于4%中性缓冲甲醛溶液中固定,4℃保存。子宫内膜为基底层子宫内膜,即距离内膜-肌层交界处300 μm以内的内膜组织。
1.2 方法
1.2.1 VAS评分评价疼痛程度 采用VAS评分评价子宫腺肌病患者痛经程度。VAS评分:0分为无痛;>0分为疼痛,其中>0分且<7分为轻中度痛,≥7分为重度痛。
1.2.2 增殖细胞相关核抗原-67(Ki-67)、血管内皮生长因子(VEGF)、神经生长因子(NGF)、蛋白基因产物-9.5(PGP-9.5)表达情况检测 采用免疫组化法。Ki-67:固定后的组织标本常规石蜡包埋,4 μm厚度连续切片,二甲苯和梯度乙醇常规脱蜡,0.01 mol/L柠檬酸盐缓冲液(pH 6.0)中进行煮沸抗原修复,0.3%H2O2阻断内源性过氧化物酶。将鼠抗人Ki-67单克隆抗体(M7240,中国上海基因生物科技有限公司,规格:0.2 ml,批号:GT209429,1∶200稀释)滴加在组织玻片上,4 ℃孵育过夜。放大显色系统采用EnVision试剂盒(丹麦DAKO公司,批号:20059650),操作方法按试剂盒说明书进行。3,3'-二氨基联苯胺显色,苏木素复染。常规脱水,透明,干燥,封片,光学显微镜下观察。
VEGF:固定及抗原修复步骤同上,滴加鼠抗人VEGF单克隆抗体(VG1,中国上海基因生物科技有限公司,规格:4 ml,批号:GT217004),操作方法按试剂盒说明书进行。复染及脱水、干燥等步骤同上。光学显微镜下观察。
NGF:固定及抗原修复步骤同上,滴加单克隆兔抗人NGF抗体(EP1320Y,中国上海基因生物科技有限公司,规格:0.2 ml,批号:GR226375-44,1∶500 稀释),操作方法按试剂盒说明书进行。复染及脱水、干燥等步骤同上。光学显微镜下观察。
PGP-9.5:固定及抗原修复步骤同上,滴加兔抗人PGP-9.5多克隆抗体(Z5116,丹麦DAKO公司,规格:0.2 ml,批号:GZ511629,1∶500 稀释),操作方法按试剂盒说明书进行。复染及脱水、干燥等步骤同上。光学显微镜下观察。
1.2.3 检测方法 Ki-67和VEGF染色评价:随机选取3个视野,高倍镜下(×400)计数阳性染色细胞个数及总细胞个数,计算阳性细胞占总细胞的比例,取其平均值。
NGF的染色评价:低倍镜(×100)下选取NGF阳性高表达区,再转换成高倍镜(×400),通过免疫反应性(IR)评分评价,其中染色强度评分0分即阴性,1分即弱阳性,2分即中度染色,3分即强阳性;阳性染色细胞的百分比评分0分即0%细胞阳性染色,1分即≤10%细胞阳性染色,2分即11%~50%细胞阳性染色,3分即51%~80%细胞阳性染色,4分即≥81%细胞阳性染色。IR评分=染色强度评分×阳性染色细胞的百分比评分。
PGP-9.5阳性神经纤维密度计算:参考Tokushige等[6]的方法并加以改进。采用德国莱卡公司生产的显微激光切割系统(型号:Leica DM3000)进行计数并拍片。神经纤维密度计算方法为:低倍镜(×100)下选取PGP-9.5阳性高表达区,再转换成高倍镜(×400),进行图像采集,计数5个高倍视野下PGP-9.5阳性神经纤维数,计算其平均值。每张片子由两位互盲且对该病例临床资料并不了解的课题组成员计数PGP-9.5阳性神经纤维个数,要求两者计数结果差别<5%。
1.3 统计学处理 采用SPSS 11.0统计软件。符合正态分布的计量资料以表示,组间比较采用两独立样本t检验;不符合正态分布的计量资料以M(P25,P75)表示,组间比较采用秩和检验。计数资料用率表示,组间比较采用χ2检验。P<0.05为差异有统计学意义。
2 结果
2.1 两组患者子宫不同组织Ki-67阳性细胞比例比较 GnRHa治疗组和对照组患者子宫腺肌病病灶组织 Ki-67阳性细胞比例分别为(9.56±3.48)%和(44.53±10.02)%,差异有统计学意义(P<0.05);两组子宫内膜组织Ki-67阳性染色细胞比例分别为(7.56±2.27)%和(43.66±9.87)%,差异有统计学意义(P<0.05)。见图 1(插页)。
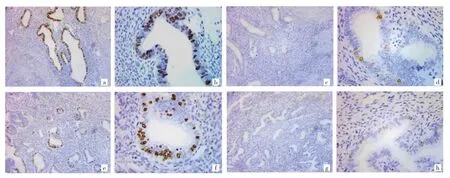
图1 两组患者子宫不同组织增殖细胞相关核抗原(Ki-67)免疫组化染色图[a、b、c、d为子宫腺肌病病灶,e、f、g、h为子宫内膜组织;a、b、e、f为对照组,c、d、g、h 为促性腺激素释放激素激动剂(GnRHa)治疗组;a、c、e、g为 100 倍镜下观,b、d、f、h 为 400 倍镜下观]
2.2 两组患者子宫不同组织VEGF阳性细胞比例比较 GnRHa治疗组和对照组患者子宫腺肌病病灶组织VEGF阳性细胞比例分别为(6.06±1.71)%和(10.09±2.43)%,差异有统计学意义(P<0.05);两组子宫内膜组织VEGF阳性染色细胞比例分别为(6.86±2.28)%和(7.69±2.84)%,差异无统计学意义(P>0.05)。见图 2(插页)。
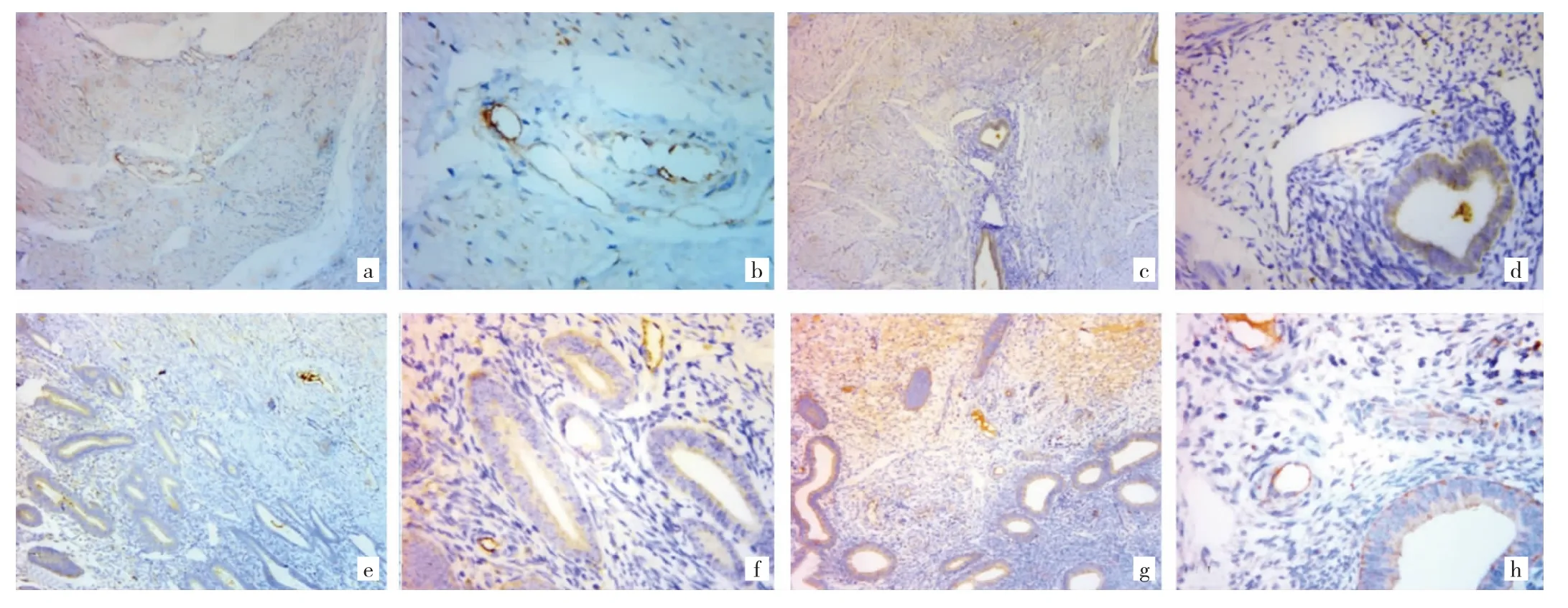
图2 两组患者子宫不同组织血管内皮生长因子(VEGF)免疫组化染色图[a、b、c、d为子宫腺肌病病灶,e、f、g、h为子宫内膜组织;a、b、e、f为对照组,c、d、g、h 为促性腺激素释放激素激动剂(GnRHa)治疗组;a、c、e、g为 100 倍镜下观,b、d、f、h 为 400 倍镜下观]
2.3 两组患者子宫不同组织NGF表达的IR评分比较 GnRHa治疗组和对照组患者子宫腺肌病病灶组织IR评分比例分别为3.92±1.20和6.84±2.68,差异有统计学意义(P<0.05);在子宫内膜部位,两组IR评分比例分别为2.78±1.57和5.66±2.81,差异有统计学意义(P<0.05)。见图 3(插页)。

图3 两组患者子宫不同组织神经生长因子(NGF)免疫组化染色图[a、b、c、d 为子宫腺肌病病灶,e、f、g、h 为子宫内膜组织;a、b、e、f为对照组,c、d、g、h 为促性腺激素释放激素激动剂(GnRHa)治疗组;a、c、e、g 为 100 倍镜下观,b、d、f、h 为 400 倍镜下观]
2.4 两组患者子宫不同组织PGP-9.5阳性神经纤维密度比较 GnRHa治疗组和对照组患者子宫腺肌病病灶组织PGP-9.5阳性神经纤维密度分别为1(1,2)和 3(2,4),差异有统计学意义(P<0.05);两组子宫内膜组织PGP-9.5阳性神经纤维密度分别为 1(1,2)和 2(1,3),差异有统计学意义(P<0.05)。见图 4(插页)。

图4 两组患者子宫不同组织蛋白基因产物-9.5(PGP-9.5)免疫组化染色图[a、b、c、d为子宫腺肌病病灶,e、f、g、h为子宫内膜组织;a、b、e、f为对照组,c、d、g、h 为促性腺激素释放激素激动剂(GnRHa)治疗组;a、c、e、g 为 100 倍镜下观,b、d、f、h 为 400 倍镜下观]
3 讨论
临床研究表明,目前在各种药物保守治疗方法中,GnRHa在缓解子宫腺肌病患者痛经、减少子宫腺肌病病灶体积、减少月经量等方面的疗效最强[7]。一般认为,GnRHa的作用是通过竞争性下调垂体GnRH受体,抑制卵巢功能导致低雌激素状态,从而缓解疼痛,缩减病灶大小。然而,越来越多的证据表明GnRHa对子宫腺肌病或子宫内膜异位症患者的病灶和子宫内膜组织均存在直接的作用[8-11],而本研究进一步证实了GnRHa在人体内对子宫腺肌病病灶部位和子宫内膜组织学的影响。
Ki-67与细胞增殖有关,体外研究表明,GnRHa可降低子宫腺肌病患者子宫肌层中Ki-67的表达[9]。VEGF是病理生理条件下血管生成的主要促进因子,也是内皮细胞的生存因子[12]。VEGF的释放与子宫腺肌病的发生有关,而体外研究发现GnRHa可通过减少VEGF的释放直接抑制异位子宫内膜的存活和生长[13],因此笔者推测在体内也有类似的结果。PGP-9.5是一个泛神经纤维标志物,可标记有髓和无髓鞘的神经纤维[14]。依据以往的研究[4-5],笔者假设GnRHa可以抑制细胞增殖,减少血管生成,并减少病变组织和子宫内膜的神经纤维密度。在本研究中,笔者使用Ki-67、VEGF、NGF、PGP-9.5 进行免疫组化染色,分析GnRHa作用下子宫腺肌病患者病灶部位和子宫内膜的细胞增殖、血管增殖及神经纤维密度变化。
本研究结果显示,GnRHa治疗组患者子宫腺肌病病灶和子宫内膜组织Ki-67阳性细胞比例均较对照组显著降低,说明GnRHa可降低子宫腺肌病患者子宫组织中细胞的增殖,这解释了GnRHa在减少子宫腺肌病患者子宫体积方面的显著作用。而新生血管生成受抑制或许也是GnRHa治疗缩小子宫腺肌病子宫体积的原因。根据以往的研究,VEGF在血管和神经发生过程中起重要作用,其在子宫腺肌病患者的在位和异位子宫内膜中均有强烈表达[15]。外源性VEGF-A可促进接受过去神经手术成年大鼠交感神经突的生长[16]。本研究发现,GnRHa治疗组的子宫腺肌病病灶VEGF表达明显低于对照组,提示GnRHa治疗可显著抑制子宫腺肌病病灶血管增殖,从而抑制该部位异位内膜的生长。虽然GnRHa治疗组的子宫内膜组织VEGF表达较对照组降低并不显著,但笔者仍然推测GnRHa可以减少该部位的新生血管形成,差异无统计学意义的原因可能是本研究中Gn-RHa治疗组没有经过足够的周期治疗,本研究Gn-RHa治疗组在子宫切除前仅用GnRHa治疗了3个周期。关于GnRHa对子宫腺肌病组织血管再生的影响,还需要进行更多的研究。
GnRHa治疗组组织中NGF表达及PGP-9.5阳性神经纤维密度均显著低于对照组,这些发现可能揭示了GnRHa控制腺肌症相关疼痛的机制。据文献报道,神经重塑和神经纤维分布改变可能是导致子宫腺肌病相关疼痛的原因,而NGF在神经重塑和神经纤维分布中起重要作用[17]。据报道,在子宫内膜异位病灶中,NGF表达异常增高[18-19],并且在子宫内膜异位病灶中,疼痛组患者的PGP-9.5阳性神经纤维明显高于无痛组[20]。既往研究显示地诺孕素可降低子宫内膜异位病灶的NGF表达强度,同时减少病灶神经纤维密度[5]。本研究结果发现,与对照组相比,GnRHa治疗组子宫腺肌病病灶及子宫内膜中NGF的IR评分及PGP-9.5阳性神经纤维密度均明显降低,这可能是GnRHa减轻子宫腺肌病相关疼痛症状的机制之一,提示GnRHa可能直接作用于子宫腺肌病病灶内的神经系统。
总之,本研究结果表明,GnRHa治疗后子宫腺肌病病灶和子宫内膜具有显著的组织学特征,包括细胞增殖和血管增生减少,NGF的IR评分比例降低以及PGP-9.5阳性神经纤维密度降低。当然,对于GnRHa对子宫腺肌病中血管生成的影响,还需要更多的周期研究。事实上,GnRH受体在子宫内膜异位、子宫腺肌病和子宫肌瘤等外周组织中均有表达[9,21]。体外实验显示GnRHa可抑制子宫内膜异位症细胞增殖,提示GnRHa可能对子宫内膜异位症病灶有直接作用[10]。除了雌激素抑制的间接作用之外,GnRHa对子宫腺肌病病灶及子宫内膜组织是否存在直接作用,本研究所显示的这些变化究竟是GnRHa的直接影响,还是雌激素的继发性改变,亦或兼而有之,目前尚不清楚,需要进一步的前瞻性研究来克服这些局限性。
