对不同感染途径构建的肺炎链球菌小鼠模型的比较研究
2021-11-29王飞清
李 丽,任 民,王飞清
(贵州中医药大学第一附属医院检验科,贵州 贵阳 550001)
肺炎链球菌属于链球菌属,为革兰阳性菌,其菌体外有荚膜。儿童、老年人、免疫力低下或存在免疫缺陷的人群均易感染该菌。一般情况下,肺炎链球菌定植于鼻腔黏膜中,不引起疾病症状。在某些诱因的作用下,该菌可穿透鼻腔黏膜,通过血管内皮屏障进入肺部、血液中甚至脑部,从而可引发肺炎、败血症及脑膜炎等严重的感染性疾病[1-2]。由肺炎链球菌感染所致肺炎、脑膜炎、中耳炎等疾病的发病率均较高[3]。但该菌引发上述疾病的分子机制至今尚不明确。构建稳定的肺炎链球菌致病动物模型可为临床上研究肺炎链球菌感染的分子机制、防治由该菌所致的疾病提供参考依据。构建动物模型的关键在于动物的选择。动物实验研究发现,利用感染肺炎链球菌的大鼠、家兔等动物无法构建稳定的动物模型。小鼠是建立肺炎链球菌感染动物模型的最佳选择[4-6]。研究发现,机体在被病原菌感染后,会产生多种炎症因子、趋化因子和急性时相蛋白,如C- 反应蛋白(c-reaction protein,CRP)、肿瘤坏死因子(tumor necrosis factor-α,TNF-α)、白细胞介素-1(interleukin-1,IL-1)、白细胞介素-6(interleukin-6,IL-6)等。它们在血液中浓度的变化情况可反映机体发生感染的情况[7]。在本次实验中,我院采用经鼻腔滴注和经腹腔注射两种感染途径构建肺炎链球菌小鼠模型,对比经不同的感染途径构建的肺炎链球菌小鼠模型,其体征、血清CRP、TNF-α、IL-1、IL-6 等感染性指标的变化情况及其肺组织病理切片的情况,以期为临床上选择不同的感染途径构建肺炎链球菌小鼠模型及研究肺炎链球菌的致病分子机制奠定基础。
1 材料与方法
1.1 实验动物
选取40 只体重在30 ~35 g 之间的清洁级雄性昆明小鼠〔由贵州医科大学动物实验中心提供,生产许可证:SCXK(黔)2018-0001 〕。饲养小鼠的环境温度为20℃~25℃,湿度为60% 左右,饮食方式为自由饮食,按照每隔12 h 进行明暗交替的方式进行饲养。本研究经贵州医科大学医学伦理委员会批准实施(伦理审查批准文号:1305020),所有的实验操作均符合动物伦理保护协定。
1.2 实验菌株
肺炎链球菌标准菌株(ATCC49619),购自美国Thermo公司。
1.3 主要仪器及试剂
电子天平(由美国双杰兄弟有限公司提供)、二氧化碳培养箱(品牌:美国Thermo,型号:Forma Series Ⅱ)、显微镜(品牌:日本OLYMPUS,型号:CX23)、VITEK MS 全自动快速微生物质谱检测系统(由法国生物梅里埃公司提供)、酶标仪(品牌:普朗,型号:DNM-9606)、DensiCHEK plus 比浊仪(由法国生物梅里埃公司提供)、酶 联 免 疫 吸 附 试 验(enzyme linked immunosorbent assay,ELISA)试剂盒(由南京建成生物科技有限公司提供)、90 mm 哥伦比亚血琼脂平板培养基(由法国生物梅里埃公司提供)、奥普托欣药敏纸片(由OXOID 公司提供)、二甲苯(由国药集团化学试剂有限公司提供)。
1.4 研究方法
1.4.1 小鼠模型的构建方法 对40 只清洁级小鼠进行1周的适应性饲养后,将其随机分为鼻腔组、腹腔组、鼻腔对照组及腹腔对照组,每组各10 只小鼠。对四组小鼠均采用自由饮用自来水及饲料的方式进行饲养。将经过纯培养的肺炎链球菌用无菌生理盐水冲洗制备成菌悬液,再用麦氏比浊仪将其配置成1.0 个麦氏单位的菌悬液,确保菌悬液中细菌的计数为3×108 CFU/mL。为鼻腔组小鼠采用经鼻腔滴注的方式接种菌悬液,为腹腔组小鼠采用经腹腔注射的方式接种菌悬液,每只小鼠均接种150 μL 的菌悬液。同时为鼻腔对照组小鼠经鼻腔滴注无菌生理盐水(150 μL/只),为腹腔对照组小鼠经腹腔注射无菌生理盐水(150 μL/只)。注药完毕后,每隔2 h 观察1 次鼻腔组和腹腔组小鼠的发病情况,并记录观察的时间。
1.4.2 对鼻腔组与腹腔组小鼠模型体内的致病菌进行分离与鉴定的方法 在鼻腔组小鼠感染肺炎链球菌72 h、腹腔组小鼠感染肺炎链球菌12 ~14 h 后,分别采集两组小鼠适量的血液标本和肺组织,接种在哥伦比亚血琼脂平板上。在温度为35 ℃、二氧化碳浓度为5%的环境下对血琼脂平板进行18 ~24 h 的孵育后,形成直径为0.5 ~1.5 mm、灰色、细小、圆形(扁平)、表面光滑、中央呈脐窝状、周围有草绿色溶血环的菌落。挑取单个的典型菌落,对其进行进一步的分离纯化。采用革兰染色法、奥普托欣敏感试验和质谱仪对纯化后的菌株进行鉴定。
1.4.3 对小鼠模型进行血清炎症因子检测的方法 在鼻腔组小鼠感染肺炎链球菌72 h、腹腔组小鼠感染肺炎链球菌12 ~14 h 后,采用浓度为10% 的水合氯醛对四组小鼠进行麻醉,采用眼球取血法将其处死,并收集其全血。将其全血标本置入EP 管(一种小型离心管)中。按照3500 r/min 的转速对小鼠的全血标本进行10 min 的离心处理后,吸取血清标本。将血清标本放置在2℃~8℃的环境下保存。采用酶联免疫吸附试验(enzyme linked immunosorbent assay,ELISA)检测小鼠血清炎症因子(包括CRP、TNF-α、IL-1 和IL-6)的水平,在吸取血清标本后4 h 内完成检测。严格按照试剂盒的说明书进行操作。
1.4.4 对小鼠模型的肺组织进行病理学检查的方法 在用眼球取血法为四组小鼠取血后,迅速取其肺组织,将其肺组织放置在浓度为10% 的多聚甲醛溶液中固定3 d。对肺组织进行脱水、石蜡包埋、切片(厚度为5 μm)处理,并用苏木精- 伊红染色法(Hematoxylin-Eosin staining,HE)进行染色,然后在光学显微镜下观察肺组织发生炎症细胞浸润的程度。
1.5 统计学分析
采用SPSS 22.0 统计软件对本次研究中的数据进行分析,符合正态分布的计量资料用均数±标准差(±s)表示,组间比较用t检验,两两比较用最小显著差数法,P<0.05为差异具有统计学意义。
2 结果
2.1 肺炎链球菌小鼠模型构建成功的判断标准
在鼻腔组和腹腔组小鼠发病后,采用革兰染色法对其致病菌株进行鉴定,结果显示,其致病菌株为革兰阳性球菌。该菌呈矛头状,成双排列,或呈短链状排列(见图1)。采用奥普托欣敏感试验对两组小鼠的致病菌株进行鉴定的结果显示,其致病菌株抑菌圈的直径≥14 mm,表明其致病菌株对奥普托欣试验敏感(见图1)。采用VITEK MS 质谱仪对两组小鼠的致病菌株进行鉴定的结果显示,其致病菌株为肺炎链球菌,该鉴定结果的可信度为99.9%(见图2)。以上的鉴定结果表明,两组小鼠的致病菌株均为肺炎链球菌。采用经鼻腔滴注和经腹腔注射两种感染途径构建肺炎链球菌小鼠模型均获得成功。
2.2 四组小鼠体征的变化情况
在四组小鼠注药完毕后,鼻腔对照组和腹腔对照组小鼠的精力充沛,活动及饮食正常,其毛色光泽鲜艳,均未发生死亡。鼻腔组小鼠在滴注肺炎链球菌20 h 后开始出现打喷嚏等症状,其精神逐渐萎靡、活动减少、食欲降低,蜷缩成团、竖毛。在注药72 h 后,该组小鼠不再进食,其面部开始肿胀,闭眼,此时采用眼球取血法将其处死。从注药到处死的过程中,鼻腔组小鼠均未发生死亡。腹腔组小鼠在接种肺炎链球菌4 ~6 h 后开始出现活动减少、精神萎靡不振、进食量逐渐减少的现象,且蜷缩成团,被毛簇起。随后,该组小鼠出现不同程度的呼吸急促,其进食及活动停止,部分小鼠开始出现闭眼的症状,其面部肿胀、脱毛。在注药12 ~14 h 后,该组小鼠中有5 只小鼠死亡,此时,采用眼球取血法处死剩余的5 只小鼠。
2.3 四组小鼠血清炎症因子水平的对比
与鼻腔对照组、腹腔对照组小鼠相比,鼻腔组和腹腔组小鼠血清CRP、TNF-α、IL-1 和IL-6 的水平均较高,P<0.001。与鼻腔组小鼠相比,腹腔组小鼠血清CRP、TNF-α、IL-1 和IL-6 的水平均较高,P<0.001。详见表1。
表1 四组小鼠血清炎症因子水平的对比(± s )

表1 四组小鼠血清炎症因子水平的对比(± s )
注:a 与鼻腔对照组、腹腔对照组相比,P <0.001;b 与鼻腔组相比,P <0.001。
炎症因子 鼻腔对照组 腹腔对照组 鼻腔组 腹腔组 F 值 P 值CRP(μg/mL) 7.98±3.15 7.86±2.97 32.22±8.28a 70.96±16.43ab 59.425 <0.001 TNF-α(pg/mL) 5.09±2.86 5.13±2.63 59.91±18.75a 206.24±42.29ab 138.965 <0.001 IL-1(pg/mL) 28.98±13.50 29.12±11.32 141.61±42.67a 277.18±32.73ab 88.939 <0.001 IL-6(pg/mL) 44.05±8.54 46.57±8.05 317.36±85.73a 513.50±78.95ab 93.683 <0.001
2.4 对四组小鼠的肺组织切片进行病理检查的结果
对四组小鼠的肺组织切片进行病理检查的结果显示,鼻腔对照组和腹腔对照组小鼠肺泡组织的结构及轮廓清晰,其肺泡腔内无炎症细胞浸润发生。腹腔组小鼠肺泡组织的结构及轮廓模糊,其肺泡腔内发生炎症细胞浸润的程度严重,并引发肺组织损伤。鼻腔组小鼠肺泡组织的部分轮廓及结构模糊,其肺组织周围出现少量的炎症细胞浸润,且浸润的程度轻于腹腔组小鼠(见图3)。
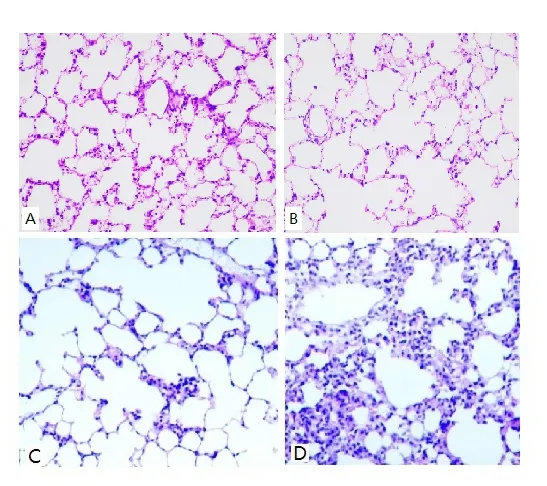
图3 四组小鼠肺组织的病理切片
3 讨论
近年来,随着多重耐药菌感染现象的不断发生,肺炎链球菌感染的发病机制、快速诊断方法逐渐成为临床上研究的热点。构建稳定的肺炎链球菌动物模型可为肺炎链球菌感染机制、疗效评价等方面的实验研究提供保障。在本次研究中,我院选择昆明小鼠为实验对象,构建经临床常见途径感染的肺炎链球菌小鼠模型,以探讨经鼻腔滴注和经腹腔注射两种感染途径对肺炎链球菌小鼠机体的影响,建立肺炎链球菌感染动物模型的制备标准,进而为提高肺炎链球菌小鼠模型的稳定性,深入研究肺炎链球菌感染的分子机制提供参考。
通过进行本次研究可知,与经鼻腔滴注感染肺炎链球菌的小鼠相比,经腹腔注射感染肺炎链球菌的小鼠发病急、感染程度严重。可见,经腹腔注射的感染途径较适宜构建急重度肺炎链球菌感染动物模型。经鼻腔滴注的感染途径主要用于研究肺部感染。而且,经该途径构建的肺炎链球菌小鼠模型病程进展缓慢、发生感染的程度易被控制,可根据需求开展相关的实验。研究表明,患者机体对细菌的免疫反应情况决定了其感染肺炎链球菌后最终的转归情况[8-9]。在患者感染肺炎链球菌的早期,其机体中的TNF-α、IL-1、IL-6 等促炎因子作为炎症及免疫应答体系中的重要介质,均呈高表达的状态[10-11]。TNF-α 可促进炎症细胞的黏附、游走和浸润,并释放大量的活性氧自由基、蛋白水解酶、脂类介质及细胞因子[12]。IL-1 和IL-6 可促进细胞的分化发育,调节细胞的生理功能,并可诱导中性粒细胞的浸润,促进肝组织合成CRP 等急性时相蛋白[3、13]。CRP是一种非特异性炎症因子,在机体发生感染时,其含量可急剧上升,且其水平的变化早于体温、血白细胞计数的变化。另外,该指标不受抗菌药物、免疫抑制剂、肾上腺皮质激素的影响,是监测感染、评估组织损伤的常用指标[14-15]。通过进行本次研究可知,采用经腹腔注射的感染途经构建的肺炎链球菌小鼠模型,其发生感染的程度重于采用经鼻腔滴注的感染途径构建的肺炎链球菌小鼠模型。其原因可能与腹腔感染可导致机体的炎症反应和与抗炎反应失衡,进而可导致机体产生病理性损伤有关[16]。
综上所述,经鼻腔滴注、腹腔注射两种感染途径构建的肺炎链球菌小鼠模型,其发病时间、死亡情况、血清炎症因子的水平及肺组织发生病理损伤的程度均存在明显的差异。构建稳定的肺炎链球菌感染动物模型是进行实验研究的基础。在本次实验中,肺炎链球菌小鼠模型的成功构建可进一步辅助临床上诊断、治疗肺炎链球菌感染,改善发生感染患者的预后。
