体外扩增的Vγ9Vδ2 T细胞对肺癌细胞的杀伤作用
2021-11-27余才锋
蒲 波,余才锋,孙 锎
(重庆三峡中心医院呼吸与危重症医学科,重庆 404000)
肺癌是全球癌症死亡的主要原因,死亡人数占全球癌症死亡患者的18.4%,位居癌症死亡人数的第一位[1]。近60%的肺癌在初诊时即为转移性[2]。肺癌患者5年存活率仍低于5%[2],因此寻找肺癌的有效治疗手段仍是近些年研究的热点。
γδT细胞代表T细胞的一个特殊亚群,其细胞识别相关抗原不具有主要组织相容性复合体(major histocompatibility complex,MHC)限制性,被认为是连接先天和适应性免疫反应的桥梁[3-4]。γδT细胞根据表面分子表达可分为Vγ9Vδ1 T细胞(主要分布于上皮相关的淋巴组织)和Vγ9Vδ2 T细胞(主要分布于外周血)亚群[5-6]。其中Vγ9Vδ2 T细胞以杀伤功能为主,在抗肿瘤免疫和防止病原体入侵方面有重要的作用,在肿瘤免疫治疗中展现出良好的潜力[7-10]。程序化死亡分子(programmed death-1,PD-1)是一种免疫负调节分子,与其配体PD-L1相互作用,对机体的免疫功能发挥抑制作用。多项研究[11-13]已证实,PD-1分子在肺癌的发生和发展中有重要的作用,多种针对PD-1的单克隆抗体已被用于治疗肺癌[14-15]。关于Vγ9Vδ2 T细胞对肺癌细胞的杀伤情况及PD-1对Vγ9Vδ2 T细胞的调节机制鲜有报道。本文分离肺癌患者外周血Vγ9Vδ2 T细胞并体外扩增,观察对肺癌细胞的杀伤情况,探讨PD-1对Vγ9Vδ2 T细胞杀伤功能的影响及相关机制,以期为肺癌患者Vγ9Vδ2 T细胞免疫疗法的应用提供科学依据。
1 资料与方法
1.1 一般资料
收集重庆三峡中心医院2019年1月至12月经病理诊断为肺癌的患者共20例,其中男性15例,女性5例。所有患者术前均未接受化疗和放疗。患者年龄46~80岁,平均(60.15±10.42)岁。所有患者均知情同意,本研究经医院伦理委员会批准。
1.2 外周血单个核细胞(peripheral blood mononuclear cell,PBMC)分离
无菌抽取肺癌患者外周静脉血5 mL,在无菌环境中转入15 mL无菌离心管中,加入5 mL RPMI-1640培养基(Gibco公司)稀释后混匀。于50 mL离心管中加入5 mL的淋巴细胞分离液(Biolegend公司),然后将稀释的血液缓慢沿离心管壁加到淋巴细胞分离液的上层,800×g离心20 min后,吸取上层血清和下层淋巴细胞分离液中间的白膜层,加入装有10 mL无血清RPMI-1640培养基的50 mL离心管中,混匀后400×g离心10 min;弃上清,再加入培养液重复上述操作;最后用1 mL含10%胎牛血清(Gibco公司)的RPMI-1640完全培养基将细胞沉淀重悬,台盼蓝染色计数后制备成浓度为2×106个/mL的细胞悬液。
1.3 γδT细胞扩增方法
anti-pan-TCRγδmAb抗体(Beckman公司)包被。取干净无菌的24孔板一个,于24孔板的2个孔中每孔加入10μL anti-pan-TCRγδmAb(0.05 mg·mL-1)及500μL RPMI-1640培养基;将24孔板置于37°C孵箱孵育2 h;取出24孔板,弃去孔中液体,于孔中加入制备好的上述PBMC悬液2 mL,37°C、5%CO2培养箱中培养。在培养的第5天,弃去旧培养基,采用PBS缓冲液洗涤2遍,加入新鲜培养基继续培养;待培养至第14天时收集扩增的γδT细胞,采用流式细胞仪分析纯度及细胞亚型。
1.4 流式细胞术
固相化抗体扩增后的细胞以含1%牛血清白蛋白(bovine serum albumin,BSA;Sigma公司)的磷酸盐缓冲溶液(phosphate buffer saline,PBS;Hyclone公司);洗涤2次后,加入相应荧光抗体(PE-anti-CD3抗体和FITC-anti-TCRγδ抗体/PE-anti-CD3抗体和FITC-anti-Vδ1抗体/PEanti-CD3抗体和FITC-anti-Vδ2抗体/PE-anti-CD3抗体和FITC-anti-Vδ2抗体以及APC-anti-PD-1)(Biolegend公司),4℃避光孵育30 min;以含1%BSA的PBS洗涤2次后,细胞重悬于0.1 mL 1%多聚甲醛固定液中待流式细胞仪检测。
1.5 Vγ9Vδ2 T细胞杀伤功能检测
采用CytoTox 96R非放射性细胞杀伤检测试剂盒(Promega公司)定量测量乳酸脱氢酶(LDH)。具体方法[16]:Vγ9Vδ2 T细胞和肺癌细胞系分别按10∶1、20∶1和40∶1的比例进行共培养。37°C、5%CO2培养箱中孵育6 h后,吸取50μL培养上清转移到酶分析板中,向酶分析板中加入检测缓冲液(50μL/孔),盖好平板,室温避光孵育30 min,向每孔中加入50μL终止液,在590 nm记录吸光值,根据吸光值作标准曲线评估细胞杀伤能力。
1.6 Vγ9Vδ2 T细胞杀伤封闭实验
采用CytoTox 96R非放射性细胞杀伤检测试剂盒,分析阻断Fas/FasL途径和PD-1/PD-L1途径对细胞杀伤的封闭作用。穿孔素-颗粒酶途径封闭实验中,在37°C条件下,采用100 nmol·L-1穿孔素/颗粒酶途径的阻断剂(CMA)(Sigma公司)预处理Vγ9Vδ2 T细胞1 h;在37°C条件下,分别采用FasL(Biolegend公司)中和抗体和PDL1(Santa Cruz公司)中和抗体封闭Vγ9Vδ2 T细胞中FasL和PD-L1 1 h。之后按照1.5实验步骤进行操作。
1.7 细胞脱颗粒情况检测
Vγ9Vδ2 T细胞和肺癌细胞系NCI-H446细胞按照效靶比40∶1的比例混合置于24孔板中,24孔板离心使细胞沉淀于底部充分接触,37°C、5%CO2培养箱孵育6 h。随后收取细胞置于15 mL离心管中离心,加入1 mL含1%BSA的PBS洗涤液重悬于eppendorf管中,充分混匀后250×g离心8 min,弃上清。细胞沉淀以0.1 mL含1%BSA的PBS重悬,于液体中加入FITC-anti-TCRVδ2抗体(Biolegend公司)和PE-anti-CD107a抗体(Biolegend公司)进行孵育,流式细胞仪进行检测,分析CD107a阳性的细胞占总杀伤细胞的比例,评价其脱颗粒能力。其中,TCRVδ2为Vγ9Vδ2 T细胞表面标记,而CD107a为脱颗粒细胞的标记物。
1.8 Vγ9Vδ2 T细胞裂解性颗粒极化情况检测
分别将Vγ9Vδ2 T细胞和肺癌细胞NCI-H446悬液稀释至1×107个/mL。取Vγ9Vδ2 T细胞和肺癌细胞NCI-H446悬液各100μL混匀,20×g离心3 min;37°C、5%CO2培养箱孵育20 min;混合细胞转入poly-D-lysine包被的2孔细胞培养板(购自BD Biosciences公司)中,室温孵育1 h;弃去培养基,1 mL PBS洗2次;4%多聚甲醛1 mL室温固定20 min;1 mL PBS洗2次;0.5 mL透化缓冲液室温处理细胞30 min;加入含3μg·mL-1穿孔素抗体的染色Buffer室温染色1 h;1 mL PBS洗3次,每次5 min;将片子于空气中吹干;采用Pro-Long Gold Antifade Reagent封片,在激光共聚焦下随机分析100个细胞,根据Vγ9Vδ2 T与肺癌细胞形成的突触数量,判断细胞极化情况。
1.9 统计学方法
采用SPSS 16.0统计学软件进行数据分析。数据均采用均数±标准差(±s)表示,两组间数据比较采用t检验,三组间比较使用方差分析。P≤0.05为差异有统计学意义。
2 结果
2.1 体外扩增肺癌患者外周血γδT细胞比例及亚型分析
流式细胞术检测肺癌患者外周血初始分离情况下γδT细胞比例为(3.53±2.21)%;采用anti-pan-TCRγδmAb固相化扩增14 d后,γδT细胞比例可增加至(82.5±13.4)%(P<0.01)。扩增的γδT细胞中Vγ9Vδ1 T细胞比例为(42.4±7.92)%,Vγ9Vδ2 T细胞比例为(40.1±8.51)%。见图1。
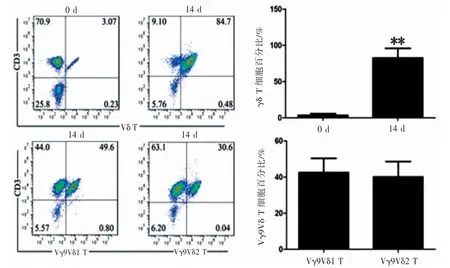
图1 流式细胞术检测肺癌患者外周血γδT细胞比例及亚型
2.2 Vγ9Vδ2 T细胞对肺癌细胞系的细胞毒作用
对3例肺癌患者外周血扩增的γδT细胞进行流式分选,以获取纯度>90%的Vγ9Vδ2 T细胞用于杀伤实验。与对照组相比(单纯肺癌细胞),体外扩增的肺癌患者外周血Vγ9Vδ2 T细胞对NCI-H446细胞和A549细胞均具有杀伤效果(P均<0.05)。见表1。

表1 Vγ9Vδ2 T细胞对肺癌细胞系的细胞毒作用(%)
2.3 体外扩增Vγ9Vδ2 T细胞表面PD-1表达分析及其对Vγ9Vδ2 T细胞杀伤功能的影响
体外扩增肺癌患者外周血Vγ9Vδ2 T细胞表面均存在不同程度的PD-1表达。采用PD-L1封闭抗体封闭NIC-H446细胞和A549细胞表面PD-L1作用后,Vγ9Vδ2 T对肺癌细胞的杀伤能力增强[NCI-H446细胞:(35.24±4.12)%vs.(20.04±2.85)%;A549细胞:(20.14±1.95)%vs.(13.21±1.74)%](P均<0.01)。见图2。
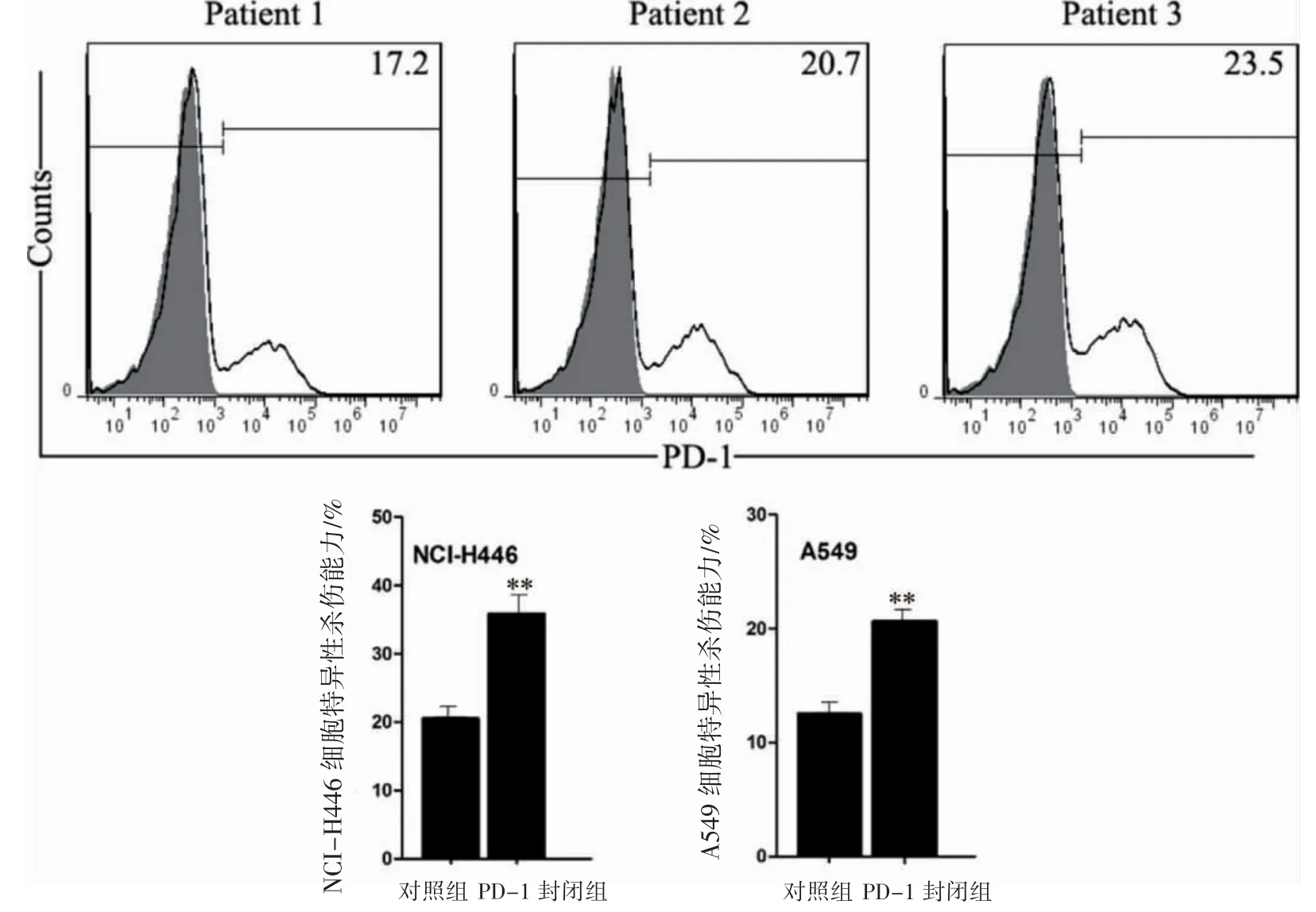
图2 Vγ9Vδ2 T细胞表面PD-1表达分析及其对Vγ9Vδ2 T细胞杀伤功能的影响
2.4 Vγ9Vδ2 T细胞对肺癌细胞的杀伤作用主要依赖于穿孔素-颗粒酶途径
采用穿孔素-颗粒酶途径抑制剂CMA处理Vγ9Vδ2 T细胞后,Vγ9Vδ2 T细胞对NCI-H446细胞和A549细胞的杀伤作用均降低(P均<0.01);而采用FasL中和抗体封闭Fas-FasL途径后,Vγ9Vδ2 T细胞对NCI-H446细胞和A549细胞的杀伤作用无变化(P均>0.05)。见图3。
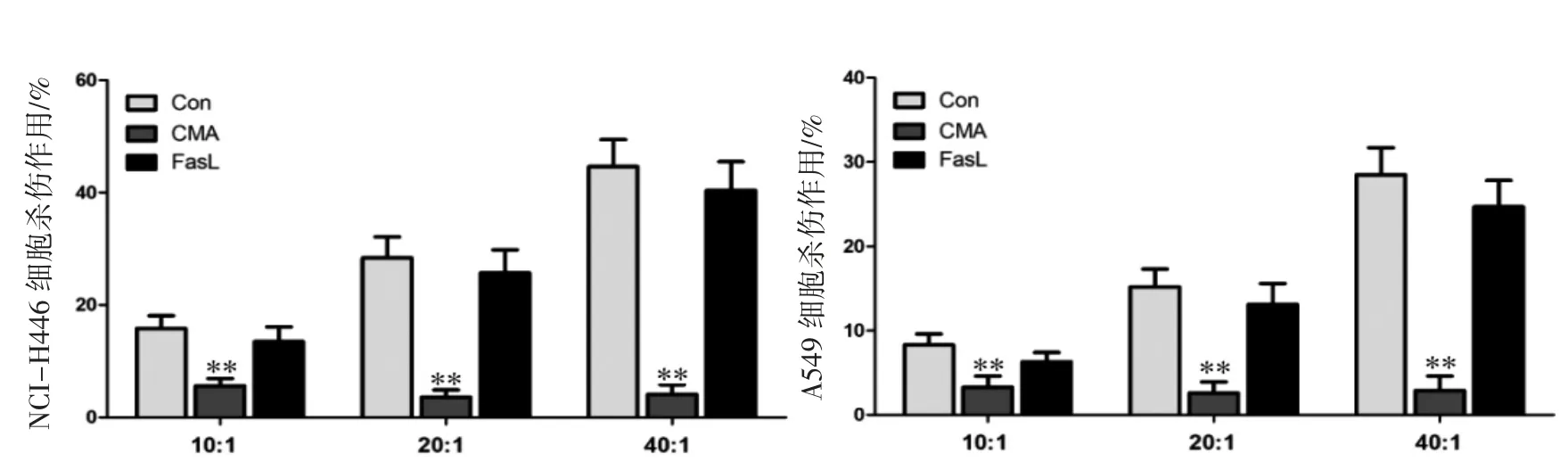
图3 穿孔素-颗粒酶途径在Vγ9Vδ2 T细胞杀伤功能中具有重要作用
2.5 阻断PD-1可增加Vγ9Vδ2 T细胞裂解性颗粒极化
流式细胞染色结果显示,阻断PD-1作用后,Vγ9Vδ2 T细胞脱颗粒方面能力无变化(P>0.05)。激光共聚焦实验结果显示,阻断PD-1作用后,Vγ9Vδ2 T细胞与肺癌细胞间的突出增多(P<0.01)。见图4。

图4 Vγ9Vδ2 T细胞脱颗粒及裂解性颗粒极化情况检测
3 讨论
本研究结果显示,采用anti-pan-TCRγδmAb固相化扩增肺癌患者PMBC 14 d后,γδT细胞纯度可达80%以上,其中Vγ9Vδ2 T细胞比例和Vγ9Vδ1 T细胞比例相似,各占一半。前期已有研究证实[16],健康人PMBC经14 d扩增后,γδT细胞纯度也可达80%以上,但其中主要为Vγ9Vδ2 T细胞,可占80%左右,仅有一小部分为Vγ9Vδ1 T细胞(比例<10%)。健康人和肺癌患者外周血扩增γδT细胞亚型的不同,推测可能与肺癌患者Vγ9Vδ1 T细胞的免疫抑制功能有关,从而抑制了Vγ9Vδ2 T细胞的增殖。已有研究[17-19]证实,Vγ9Vδ1 T细胞与多种肿瘤的免疫逃逸有关,且Peng等[20]研究结果显示,在乳腺癌患者外周血扩增的γδT细胞中Vγ9Vδ1 T细胞比例也增加。
流式细胞术结果显示,体外扩增肺癌患者外周血Vγ9Vδ2 T细胞表面均存在不同程度的PD-1表达,在阻断PD-1作用后Vγ9Vδ2 T细胞对肺癌细胞的杀伤能力增强。已有大量研究[11-13]发现PD-1的表达与杀伤性T细胞的杀伤功能抑制有关,且已证实PD-1分子在肺癌的发生和发展中具有重要的作用。PD-1抑制剂的出现改善了晚期肺癌患者的前景[14-15]。2015年以来,美国食品药品监督管理局(FDA)已批准多种PD-1抑制剂用于肺癌的一线和二线治疗。
PD-1抑制剂可联合化疗、放疗或小分子抑制剂等联合疗法治疗肺癌[21-24]。目前临床还未见PD-1抑制剂联合过继免疫治疗的研究进展。本研究从基础研究角度阐释PD-1抑制Vγ9Vδ2 T细胞杀伤功能的机制,证明Vγ9Vδ2 T细胞杀伤肺癌细胞的主要途径是穿孔素-颗粒酶。Vγ9Vδ2 T细胞通过穿孔素-颗粒酶途径杀伤靶细胞需要脱颗粒和裂解性颗粒极化两个步骤[25]。颗粒酶和穿孔素存在于细胞的胞浆颗粒中,活化的Vγ9Vδ2 T细胞将颗粒酶和穿孔素释放进入细胞间隙。穿孔素可以在细胞膜上形成孔道,增加细胞膜通透性,引发靶细胞裂解。另外,穿孔素还引起裂解性颗粒极化,在细胞质、胞浆和细胞核重新分布,使颗粒酶聚集在裂解部分,促进靶细胞裂解[26]。流式细胞术结果显示阻断PD-1作用后,Vγ9Vδ2 T细胞脱颗粒方面能力并未增加,而裂解性颗粒极化水平增加。说明PD-1主要是通过抑制Vγ9Vδ2 T细胞裂解性颗粒极化从而抑制Vγ9Vδ2 T细胞对肺癌细胞的杀伤能力。然而,本研究仍存在一定的不足,如未对PD-1抑制Vγ9Vδ2 T细胞的裂解性颗粒极化的信号机制开展进一步的研究。因此,进一步的信号机制研究也是未来关注的重点。
综上所述,肺癌患者外周血扩增Vγ9Vδ2 T细胞在体外对肺癌细胞具有杀伤作用,且主要依赖于裂解性颗粒的极化;而PD-1抑制肺癌患者外周血扩增Vγ9Vδ2 T细胞的杀伤作用主要通过抑制裂解性颗粒极化而实现,为阐明肺癌患者外周血扩增Vγ9Vδ2 T细胞杀伤肺癌细胞的作用机制提供了一定的证据支持。
