三角帆蚌细胞周期蛋白基因筛选及其表达分析
2021-11-27冯上乐李雪男陈一格刘瑞琦白志毅李文娟
冯上乐,李雪男,陈一格,刘瑞琦,白志毅,b,c,李文娟,b,c,*
(上海海洋大学 a. 农业农村部淡水水产种质资源重点实验室;b. 水产种质资源发掘与利用教育部重点实验室;c. 水产科学国家级实验教学示范中心,上海201306)
三角帆蚌(Hyriopsiscumingii)隶属于软体动物门(Mollusca)双壳纲(Bivalvia)真瓣鳃目(Eulamellibranchia)蚌科(Unionidae)帆蚌属,主要分布于中国长江下游广大流域,是中国特有的淡水育珠蚌,占据重要的经济与战略地位[1]。在三角帆蚌体外细胞培养研究中,游离细胞的增殖能力较低,活性较差[2-3],限制了该领域细胞学方面的研究,至今细胞系的建立仍未突破。细胞周期蛋白在细胞周期过程中发挥重要作用,是细胞分裂的内在动力因子,参与细胞的增殖、分化[4]。因此,探究细胞周期蛋白在细胞分裂过程中的作用对解决游离细胞增殖问题具有重要意义。
1983年,在海胆(Echinoidea)中发现周期蛋白,随后在高等真核生物中数十种周期蛋白被相继发现,但在细胞周期时相转换中,仅有A、B、C、D、E 5种周期蛋白发挥关键作用[5]。水生动物中,对细胞周期蛋白基因A、B、E的研究集中于性腺发育过程,很多研究表明,在性腺发育过程中,这3种周期蛋白基因均存在高表达,且cyclinA、cyclinB随着性腺发育表达量逐渐升高[6-8]。细胞周期蛋白A参与调控细胞周期S期和M期,Visudtiphole等[9]从斑节对虾(Penaeusmonodon)中克隆了cyclinA基因,并发现其在成体卵巢中表达水平显著高于幼体。成熟促进因子(mature promoting factor,MPF)是动物卵母细胞和精母细胞减数分裂成熟过程中控制G2/M期转变的关键调控因子,细胞周期蛋白B是MPF的主要成分,在海胆、斑节对虾的卵母细胞,以及刀额新对虾(Metapenaeusensis)、大黄鱼(Larimichthyscrocea)卵巢中均大量表达,推测其与卵巢的发育密切相关[10-14]。细胞周期蛋白D(cyclin D)参与调控细胞周期G1期,在水生生物中研究较少,对海胆的研究认为cyclin D对其胚胎早期发育有重要作用[15]。细胞周期蛋白E能与周期蛋白依赖性激酶2(cyclin dependent kinase 2,CDK2)结合调节G1/S期的转换,但其功能在水生动物中研究较少。Kurokawa等[16]克隆了海胆cyclinE基因的cDNA序列,发现海胆cyclin E氨基酸序列与爪蟾(Xenopuslaevis)、斑马鱼(Daniorerio)的cyclin E氨基酸序列高度相似。目前,cyclin基因在贝类中的研究较少。王桐等[17]在长牡蛎(Crassostreagigas)克隆得到cyclinB3基因,其表达量与性腺发育程度有关。刘佳敏等[18]克隆了三角帆蚌cyclinB基因,认为其在生殖细胞减数分裂中发挥重要作用,尚未见更深入的研究报道。
鉴于细胞周期蛋白在细胞增殖进程中的重要作用,使用Illumina HiSeq 2000对三角帆蚌进行转录组测序,参考实验室构建的不同时间外套膜插核的数字基因表达谱(digital gene expression profiling,DGE),进行三角帆蚌细胞周期蛋白基因筛选,结合生物信息分析和分子生物学手段,对靶基因进行初步验证,构建了三角帆蚌不同性别与组织cyclins基因的表达谱,为以后的功能研究提供理论基础。
1 材料与方法
1.1 实验动物
实验用三角帆蚌取自武义伟民水产养殖生产基地,挑选体重、体型相似,健康的2龄三角帆蚌,暂养于实验室中,日常投喂小球藻并充氧。
转录组测序样品选取:随机选取10只三角帆蚌,取其血淋巴、外套膜、性腺与内脏团分别置于灭菌的1.5 mL离心管中,迅速放入液氮中速冻,-80 ℃保存。
荧光定量样品选取:随机挑选15只雌蚌和15只雄蚌(三角帆蚌雌雄鉴别参考吴从迪等[19]的方法),分别取闭壳肌、内脏团、外套膜、斧足、心脏、血液、鳃与性腺,用0.5% DEPC(Invitrogen,美国)水洗净,置于灭菌1.5 mL离心管中并放入液氮中速冻,-80 ℃保存。
1.2 转录组测序分析
1.2.1 RNA提取、cDNA文库构建和Illumina测序、组装
RNA提取方法参照Trizol®Reaget(Invitrogen,美国)的说明,RNA纯度和浓度使用NANODROP 2000C(Thermo Fisher Scientific,美国)测定,RNA质量采用1%琼脂糖凝胶电泳检测,cDNA文库的构建和Illumina HiSeq 2000测序在北京诺禾致源科技股份有限公司进行,获得的测序原始数据经过去除接头、杂质和去冗余处理,并经Trinity软件拼接和同源基因的聚类分析后,获得unigene序列。
1.2.2 基因功能注释与cyclins基因筛选
组装得到的高质量unigene序列分别与Nr (NCBI non-redundant protein sequences)、Nt (NCBI nucleotide sequences)、Pfam (Protein family)、KOG/COG(euKaryotic Ortholog Groups/Clusters of Orthologous Groups of proteins)、Swiss-Prot(A manually annotated and reviewed protein sequence database)、KEGG(Kyoto Encyclopedia of Genes and Genomes)、GO(Gene Ontology)等数据库进行Blast比对(E-value<10-5,E-value表示假阳性率,E-value越小越好),得到unigene功能注释信息。
以“cell cycle”和“cyclin”为关键词在三角帆蚌转录组库中搜索,将筛选出的相关unigene进行基因注释,用pathway分析筛选出cyclins相关unigene。用NCBI网站的Blast功能将cyclins相关unigene与牡蛎等水生软体动物比对,选择序列保守性高的unigene,结合不同插核时间三角帆蚌外套膜的数字基因表达谱(DGE)分析(实验室已构建),筛选出三角帆蚌中与细胞分裂密切相关的cyclins基因。
1.3 cyclins基因克隆和序列分析
通过转录组数据库筛选得到cyclins基因序列,根据其保守区序列设计引物(引物设计要求退火温度为55~60 ℃,GC含量为40%~60%),引物序列见表1。PCR扩增模板选取三角帆蚌组织混合池cDNA。扩增条件:94 ℃ 3 min;94 ℃ 30 s,55 ℃ 30 s,72 ℃ 40 s,40个循环。扩增产物的回收纯化使用TaKaRa MiniBEST Agarose Gel DNA Extraction Kit Ver.4.0(TaKaRa,日本),与PMD19-T(TaKaRa,日本)连接后转入大肠埃希菌DH5α中。采用菌落PCR验证,验证的阳性菌液于生工生物工程(上海)股份有限公司测序。
用ORF Finder(http://www.ncbi.nlm.nih.gov/gorf/orfig.cgi)分析序列的开放阅读框,使用NCBI Blast分析比对氨基酸序列。使用DNAMAN软件比对克隆的三角帆蚌与GenBank中同源物种的cyclins核苷酸和氨基酸序列,预测序列保守性。使用String(http://string-db.org)进行靶蛋白预测。
1.4 cyclins基因表达分析
取冻存的组织样品用于RNA提取,RNA提取按照Trizol®Reaget(Invitrogen,美国)的操作说明进行,RNA纯度、浓度与质量检测与1.2.1节相同,反转录使用PrimeScript TM RT reagent Kit with gDNA Eraser(TaKaRa,日本)。根据克隆得到的cyclins基因CDS区序列,用NCBI Primer Blast设计实时荧光定量PCR引物。以2×iQTMSYBR Green Supermix(Bio-Rad,美国)为荧光染料,选取EF1α为内参基因,反应体系:cDNA 1.0 μL,2×iQTMSYBR Green Supermix 10.0 μL,上下游引物(10 μmol·L-1)各0.4 μL,ddH2O补齐至20 μL。反应条件:95 ℃ 2 min;95 ℃ 15 s,60 ℃ 30 s,40个循环。每个样品5个生物学重复,3次技术重复,基因表达水平用2-ΔΔCT法计算。
1.5 数据处理
结果用平均值±标准误差表示,采用SPSS 24.0对结果进行方差分析和组间多重比较,使用OriginPro 9.1软件进行作图分析,P<0.05表示差异显著,P<0.01表示差异极显著。
2 结果与分析
2.1 转录组unigene组装和功能注释
数据拼接后得到257 457条unigene,总核苷酸数193 448 860 bp,平均长度为751 bp,N50为1 796 bp。将所有的unigene在NCBI的非冗余蛋白质数据库(Nr)进行相似搜索(E值<10-5)。
将unigenes分别与Nr、Nt、Swissprot、KO、GO、和KOG、PfAM数据库比对注释,成功注释223 345条,注释率为86.7%。Nr、Nt、Swissprot、KO、GO、KOG和PfAM数据库分别注释到的44 822、11 068、33 642、11 636、50 182、22 718和49 277条unigenes。
2.2 三角帆蚌细胞周期蛋白筛选结果
数据筛选结果表明,103条unigene与cyclins相关,64条unigene与cycle相关,130条unigene与CDK相关。将找到的103条cyclins相关unigene进行基因注释和pathway分析,从中筛选出10个cyclins相关unigene(表2),结合这10个相关unigene的开放阅读框与靶蛋白预测结果,参考相关基因的文献,筛选得到4个cyclins基因:cyclinA、cyclinB[18]、cyclinD2、cyclinE。

表2 三角帆蚌转录组文库筛选的cyclins相关unigene
2.3 cyclins基因克隆与分析
克隆得到的三角帆蚌cyclinA基因的蛋白质编码区(coding sequence,CDS)长度为413 bp,分析其氨基酸序列发现,第3~81 aa构成一个周期蛋白框(图1)。与其他物种cyclin A的氨基酸序列比对结果(图2)显示,三角帆蚌cyclin A氨基酸序列与斑马贻贝相似性最高,为84%;与美洲牡蛎和太平洋牡蛎的相似性为72%。String蛋白数据库预测结果表明,三角帆蚌的cyclin A蛋白与CDK1、CDK2、细胞分裂周期基因6(CDC)能发生相互作用。

黑色框内为周期蛋白框。Black frame was the cyclin box.图1 三角帆蚌cyclin A基因预测的氨基酸序列Fig.1 Predicted amino acid sequence of cyclin A gene in Hyriopsis cumingii

cyclin A氨基酸比对所用物种登录号:斑马贻贝,AAC35953.1;美洲牡蛎,XP_022320685.1;太平洋牡蛎,XP_034299932.1;虾夷扇贝,XP_021364053.1;斑节对虾,ACH72071.1;非洲爪蟾,NP_001081579.1;斑马鱼,AAH68323.2;长棘海星,XP_022085019.1。GenBank accession numbers of cyclin A: Dreissena polymorpha, AAC35953.1;Crassostrea virginica, XP_022320685.1; Crassostrea gigas, XP_034299932.1;Mizuhopecten yessoensis, XP_021364053.1;Penaeus monodon, ACH72071.1;Xenopus laevis, NP_001081579.1;Danio rerio, AAH68323.2;Acanthaster planci, XP_022085019.1.图2 三角帆蚌与其他物种cyclin A氨基酸相似性序列比对Fig.2 Amino acid similarity alignment of cyclin A among Hyriopsis cumingii and other species
克隆得到的cyclinD2编码的CDS区长度为501 bp,氨基酸序列分析表明第22~148 aa构成了一个周期蛋白框(图3)。氨基酸序列比对结果(图4)显示,三角帆蚌cyclin D2氨基酸序列与美洲牡蛎、太平洋牡蛎相似性最高并聚为一支,相似性为77%,其次与虾夷扇贝相似性较高,为76%。String蛋白数据库预测表明,cyclin D2与细胞周期蛋白依赖性激酶6(cyclin-dependent kinase 6,CDK6)、细胞周期蛋白依赖性激酶4(cyclin-dependent kinase 4,CDK4)能发生相互作用。

黑色框内为cyclin box。Black frame was the cyclin box.图3 三角帆蚌cyclin D2基因预测的氨基酸序列Fig.3 Predicted amino acid sequence of cyclin D2 gene in Hyriopsis cumingii
cyclin D2氨基酸比对所用物种登录号:斑马贻贝,AAM44813.1;美洲牡蛎,XP_022292709.1;太平洋牡蛎,XP_011430967.2;虾夷扇贝,XP_021360132.1;非洲爪蟾,CAA61665.1;斑马鱼,NP_001082914.1;长棘海星,XP_022112210.1。GenBank accession numbers of cyclin D2: Dreissena polymorpha, AAM44813.1;Crassostrea virginica, XP_022292709.1;Crassostrea gigas, XP_011430967.2;Mizuhopecten yessoensis, XP_021360132.1;Xenopus laevis, CAA61665.1;Danio rerio, NP_001082914.1;Acanthaster planci, XP_022112210.1.图4 三角帆蚌与其他物种cyclin D2氨基酸相似性序列比对Fig.4 Amino acid sequence similarity alignment of cyclin D2 among Hyriopsis cumingii and other species
克隆得到的cyclinE基因编码的CDS区长度为415 bp,由于其氨基酸序列较短(图5),通过NCBI对其氨基酸序列进行分析未得到结果。氨基酸序列比对结果(图6)显示,三角帆蚌cyclin E氨基酸序列与虾夷扇贝序列相似性最高,为65%,其次,与美洲牡蛎和太平洋牡蛎相似性较高且聚为一支,相似性为60%。String蛋白数据库预测显示,cyclin E能在细胞周期调控中与CDK1、CDK2、CDK4相互作用。

图5 三角帆蚌cyclin E基因预测的氨基酸序列Fig.5 Predicted amino acid sequence of cyclin E gene in Hyriopsis cumingii

cyclin E氨基酸比对所用物种登录号:美洲牡蛎,XP_022336414.1;太平洋牡蛎,XP_011433150.1;虾夷扇贝,OWF54564.1;斑节对虾,AGW23550.1;非洲爪蟾,CAA78370.1;斑马鱼,CAA58574.1;长棘海星,XP_022092193.1。GenBank accession numbers of cyclin E: Crassostrea virginica, XP_022336414.1;Crassostrea gigas, XP_011433150.1;Mizuhopecten yessoensis, OWF54564.1;Penaeus monodon, AGW23550.1;Xenopus laevis, CAA78370.1;Danio rerio, CAA58574.1; Acanthaster planci, XP_022092193.1.图6 三角帆蚌与其他物种cyclin E氨基酸相似性序列比对Fig.6 Amino acid sequence similarity alignment of cyclin E among Hyriopsis cumingii and other species
2.4 cyclins基因组织表达分析
定量分析结果表明,三角帆蚌cyclins基因mRNA在闭壳肌、斧足、外套膜、心脏、血液、内脏团、鳃、性腺中均有表达,且呈现出不同的组织与性别差异。
cyclinA基因在三角帆蚌雌雄个体各个组织中均有表达,在性腺中表达量最高,显著(P<0.05)高于其他组织,在血液、闭壳肌、内脏团、心脏中表达量也较高(图7-A)。在心脏中,雌性cyclinA表达量显著高于雄性(P<0.05);在性腺中,雌性cyclinA表达量约为雄性的15倍,差异极显著(P<0.01);在闭壳肌和血液中,雄性cyclinA表达量显著高于雌性(P<0.05)(图7-B)。
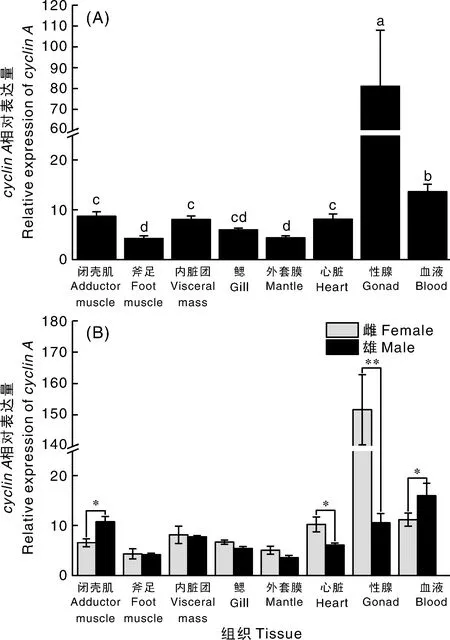
组间无相同字母表示差异显著(P<0.05);*表示差异显著(P<0.05),**表示差异极显著(P<0.01)。下同。Values without the same letters were significantly different (P<0.05);* indicated P<0.05, ** indicated P<0.01. The same as below.图7 cyclin A基因的相对表达量Fig.7 Relative expression level of cyclin A
cyclinD2基因在三角帆蚌雌雄个体各个组织中均有表达,其中,在鳃中表达量显著(P<0.05)高于其他组织,在斧足、外套膜、心脏中表达量也较高(图8-A)。在外套膜中,雌性cyclinD2表达量显著(P<0.05)高于雄性;在心脏和性腺中,雄性cyclinD2表达量均显著(P<0.05)高于雌性,其他组织cyclinD2基因表达量无性别差异(图8-B)。
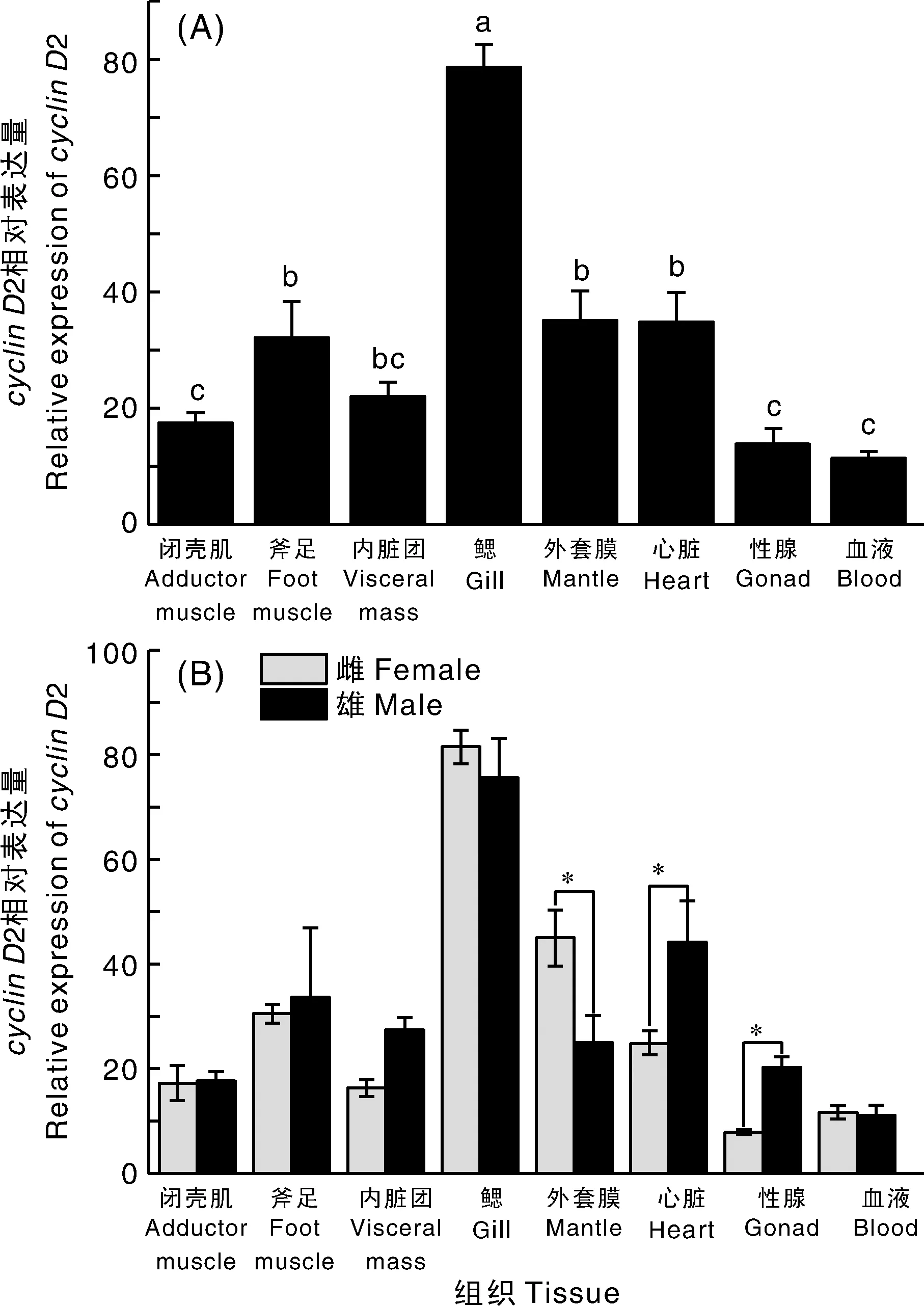
图8 cyclin D2基因的相对表达量Fig.8 Relative expression level ofcyclin D2
cyclinE基因在三角帆蚌雌雄个体各个组织中也均有表达,其中,在性腺中表达量显著(P<0.05)高于其他组织,鳃、内脏团、闭壳肌、血液中表达量也较高(图9-A)。在斧足、心脏中,雌性cyclinE表达量显著(P<0.05)高于雄性;在性腺中,雌性cyclinE表达量约为雄性的5倍,差异极显著(P<0.01)。在鳃中,雄性cyclinE表达量显著(P<0.05)高于雌性(图9-B)。
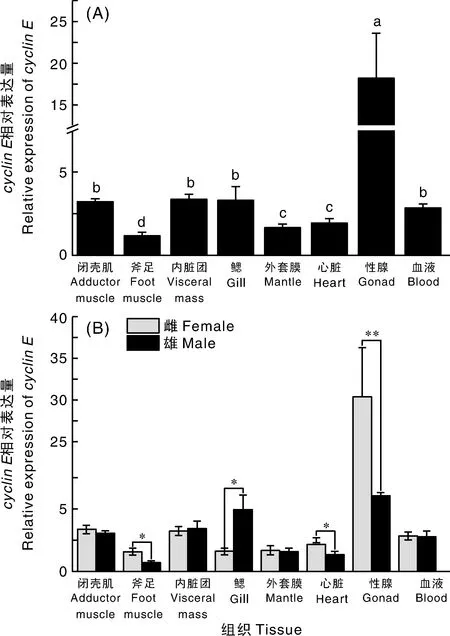
图9 cyclin E基因的相对表达量Fig.9 Relative expression level of cyclin E
3 讨论
细胞周期蛋白最早被发现于海胆中[20],随后在高等生物中鉴定出了多种细胞周期蛋白,各种周期蛋白通过与CDK结合调控细胞的分裂[21]。研究表明,细胞周期蛋白的表达失调与细胞凋亡、多种癌症发生有密切关系[22]。本研究采用高通量测序技术,构建了三角帆蚌转录组文库,从中筛选出了三角帆蚌cyclinA、cyclinD2、cyclinE基因,并进行了生物信息和表达分析。
通过氨基酸序列比对发现,三角帆蚌cyclin A、cyclin D2均具有周期蛋白标志性的周期蛋白框,而cyclin E因序列较短未得到比对结果。氨基酸序列相似性比对结果表明,三角帆蚌cyclin A、cyclin D2、cyclin E与牡蛎、扇贝等双壳贝类氨基酸相似性较高,这进一步验证了转录组所筛选出的基因为三角帆蚌细胞周期蛋白基因。
细胞周期的调控中,cyclin A、cyclin B被认为是M期周期蛋白,cyclin E是一类调节细胞周期G1-S期转换的周期蛋白,cyclin A与cyclin B可以通过不同方式激活MPF,诱导减数分裂[23]。本实验中,cyclinA、cyclinE基因在三角帆蚌性腺中的表达量最高,且显著高于其他组织。Li等[8]在鲎(Tachypleustridentatus)中发现,cyclinA基因与卵巢发育密切相关,随着卵巢的发育cyclinA表达量逐渐增加,卵巢发育过程中,大量细胞开始增殖,cyclinA基因的高表达与生殖细胞的分裂活动有关。刘佳敏等[18]研究表明,三角帆蚌cyclinB基因与cyclinA具有相似的组织表达特性,推测在细胞周期调控中,cyclinA、cyclinB可能发挥相似的功能。此外,Huang等[7]研究发现,在性腺组织中雌性拟穴青蟹(Scyllaparamamosain)cyclinA表达量显著高于雄性,本研究结果与此一致,暗示cyclinA在三角帆蚌卵巢发育过程中发挥重要作用,作为细胞分裂旺盛的组织,其与生殖细胞的分裂活动有关。cyclinE在水生动物性腺发育过程中的作用研究较少。赵超等[24]发现,在斑节对虾(Penaeusmonodon)卵巢中cyclinE也存在高表达现象,暗示cyclinE基因与cyclinA相似,其表达可能也与性腺发育有密切关系。
cyclinD在G0期细胞受到有丝分裂原刺激后表达,是一类调控G1-S期转变的周期蛋白,可作为一种细胞增殖潜能的指标,用于肿瘤发生的预后[25]。cyclinD1为原癌基因,在对人类多种肿瘤的研究中均发现cyclinD1基因的持续高表达[22,26]。本研究选用的三角帆蚌为5月份购置暂养的2龄蚌,此时为蚌的繁育时期,其受精卵发育在鳃套腔中进行[27],且鳃是三角帆蚌重要的呼吸和滤食器官;研究中发现,三角帆蚌cyclinD2基因在鳃中的表达量显著高于其他组织,暗示三角帆蚌鳃组织细胞具有较强的增殖能力,也可能与鳃细胞的损伤修复或处于繁育时期的生理状态有关。
