N-羟乙酰神经氨酸(Neu5Gc)参与肿瘤进程的研究进展①
2021-11-26李庆伟辽宁师范大学生命科学学院七鳃鳗研究中心大连116081
曹 旭 逄 越 李庆伟 (辽宁师范大学生命科学学院,七鳃鳗研究中心,大连116081)
糖链是进化最快的一类复杂生物大分子,糖基化是分泌蛋白和膜结合蛋白最常见、最复杂、最具可塑性的翻译后修饰,在进化中存在更多的结构变异,使其表现出显著的多样性并具有多种生物学作用。唾液酸(sialicacid,Sia)是一类酸性九碳单糖的总称,其家族成员有50 多种,主要是由N-乙酰神经氨酸(Neu5Ac)、N-羟乙酰神经氨酸(Neu5Gc)和脱氨神经氨酸(deaminon-euraminic acid,KDN)这3 种核心结构衍生而成。Sia 作为糖衣末端单位覆盖于细胞表面或在分泌分子的糖链上附着,能稳定胞膜及其相关分子、传递跨膜信号,具有自配体和非自配体的受体功能等。Neu5Ac和Neu5Gc都参与构成鞘糖脂(glycopinglipid)和神经节苷脂(ganglioside,GS)如GM3,Neu5Gc 以单天线或双天线型(寡唾液酸或双唾液酸链)连接在GS 或糖蛋白末端,这样的结构有利于胚胎的早期发育和抗微生物感染并且与儿童神经发育有关,还有助于提高认知能力[1-3];此外它能中和毒素,调节血红蛋白[4-5];Neu5Gc 若在碳水化合物中,则可掩盖抗原位点和受体,又可作为配体被各种微生物和Ⅰ型凝集素识别[6];α2-8 糖苷键连接的Neu5Gc 还能充当信使参与信号传导、细胞分化、黏附等过程中,在特异性抗原表面表达。糖基化的变化是肿瘤向恶性转化的典型特征之一,异常糖基化有很多发生机制,如各种酶的表达、酶的活性改变以及细胞内环境的平衡,任何情况出现变化都可能导致异常聚糖合成,这与自身免疫病和癌症等病理条件相关[7]。人类缺少胞苷单磷酸-N-乙酰神经氨酸羟化酶(cytidine monoph-ospho-N-acetyl⁃neu-raminic acid hydroxylase,CMAH),从而无法内源性合成Neu5Gc,且有诸多研究表明Neu5Gc 在肿瘤细胞中特异性高表达,因此其存在具有特殊性。本文综述Sia家族中的Neu5Gc引起炎症反应和肿瘤进程中的变化情况及其相应生物学功能,为临床上鉴别诊断肿瘤及其治疗提供指导。
1 Neu5Gc的合成代谢及调控
1.1 Neu5Gc的合成代谢 哺乳动物能够利用糖酵解产生Sia,这一途径的失调与多种代谢疾病有关,如糖尿病、阿尔茨海默病、心脑血管疾病和癌症等[8]。在真核细胞中 Neu5Ac 由 3 种酶在胞浆中催化产生,然后转运到细胞核中,并活化成单磷酸胞苷-N-乙酰神经氨酸(cytidinemonophospho-N-acetyl⁃neuraminic acid,CMP-Neu5Ac),再由 CMP-Neu5Ac羟化酶(CMAH)催化形成CMP-Neu5Gc 后经特定的转运蛋白泵入高尔基体中,在唾液酸转移酶的作用下形成糖复合物后进入细胞表面或从细胞中分泌出来,具体合成途径见图 1[9]。由于 CMP-Neu5Ac 羟化酶活性在不同物种及不同组织中有所区别,所以Neu5Gc因种属不同而含量各异,在正常人体内的组织中很难检测到Neu5Gc,因为人类在进化过程中,CMAH 基因缺失了一个外显子,导致了开放阅读框的不完整性,CMP-Neu5Ac 羟化酶因此失活,目前该酶是唯一已知能使Neu5Ac 经生物合成Neu5Gc 的酶,所以人体不具有从Neu5Ac合成Neu5Gc的能力,体内的Neu5Gc 是外源性的。通过与Neu5Gc 抗体(IgY)的免疫反应却发现它在人脉管系统的内皮细胞、胎盘、中空器官的上皮细胞以及癌细胞中均有表达,在人类肿瘤中聚糖形式的Neu5Gc 占1%~3%[10]。食用红肉和其他哺乳动物制品将会摄入Neu5Gc,所以大多数研究者认为Neu5Gc 是食源性摄入后被吸收利用的,并猜想两种潜在摄取途径:①溶酶体将细胞摄取的糖脂或糖蛋白中的Neu5Gc释放到细胞质中再利用,用含Neu5Gc 糖复合物的培养基培养人类上皮细胞3 d后可检测到,即验证了这一猜想;②食物在肠道中分解代谢产物为中性前体N-羟乙酰甘露糖胺(ManNGc),它经被动扩散进入细胞内转化为Neu5Gc。这两种途径都能有效地绕过人类的酶缺陷,使外源的Neu5Gc 通过唾液酸化整合到人体细胞上。

图1 Neu5Gc及其唾液苷在真核细胞中的生物合成Fig.1 Biosynthesis of Neu5Gc and its sialosides in eukary⁃otic cells
对比Neu5Gc 和Neu5Ac 结构发现,仅一个氧原子的区别,所以它们的代谢和重复利用途径相似。BANDA等[11]在CMAH基因敲除小鼠模型(CMAH−/−)上进行了Neu5Gc 胃肠道代谢机制的研究,游离Neu5Gc 1~2 h 后即随尿液排出,Neu5Gc 糖蛋白则可以进入小肠壁,代谢合并到多个外周组织的糖蛋白和糖脂中,如肝脏、肾脏和小肠壁上均能检测到,最终证明Neu5Gc 可从食物吸收代谢入体,又基于内源机制的缺陷,所以得出结论Neu5Gc 是饮食来源的。对健康人群的研究表明,食用Neu5Gc 后,游离的Neu5Gc 4~6 h 后就被吸收或排泄出体外,仅在唾液和面部毛发还有少量残存,但结合态就不容易被排泄出去,会不断地在人体中积累,而营养不良人群比健康人更容易在体内蓄积Neu5Gc[12]。
1.2 Neu5Gc 相关调控机制 Neu5Gc 可能参与细胞凋亡和细胞信号转导,例如GM3鞘糖脂的Fas-Fas配体(Fas-FasL)途径,降解多种细胞内蛋白并激活DNase 的作用,使 DNA 片段化断裂,GM3 与膜配体的相互作用具有酶的活性及功能,能与生长因子受体结合,对PI3K/AKT 信号通路产生一定抑制作用[13]。在92 例非小细胞肺癌患者中 GM3(Neu5Gc)和表皮生长因子受体(epidermal growth factor recep⁃tor,EGFR)有63 例(68%)共同表达,与组织亚型无关[14]。双唾液酸神经节苷脂GD3(disialoganglioside-3,GD3)能降低线粒体膜通透性和激活细胞凋亡[15]。淋巴细胞脂筏的形成与Neu5Gc 相关,在猪的淋巴细胞中Neu5Gc 参与刺激T 细胞激活和抗原递呈细胞成熟,但是在人类淋巴细胞表面却不表达Neu5Gc(表1)。

表1 Neu5Gc或其组成物质参与的相关信号转导途径Tab.1 Relevant signal transduction pathways in which Neu5Gc or its constituent substances participate
对Neu5Gc 的合成催化酶CMAH 基因cDNA 序列一级结构预测,发现该酶不具有疏水区域,不存在起协助运输作用的信号肽,从Hela 细胞系得到该酶的cDNA 发现人与鼠的cDNA 在基因组上有同源序列,只是人的cDNA 缺少一个92 bp 的片段而导致其失活,比较基因组分析显示人类CMAH 失活模型为92 bp的外显子和内含子的融合。Neu5Gc的缺失在某种程度上促进了人类大脑的进化,许多其他组织中高表达CMAH/Neu5Gc 的动物,大脑中却不表达CMAH/Neu5Gc,这表明Neu5Gc 的缺失在人属出现之前,这有利于保护人类免于病原体的侵扰,只人类保持着与其他物种不同的进化差异即Neu5Gc和Neu5Ac 在各组织及其分泌的聚糖−蛋白质复合物中的比例无法调节,不能利用丰富的Neu5Gc 作为可靠的自我信号。
2 Neu5Gc的相关免疫学效应
2.1 天然免疫及选择 天然抗体主要由B1细胞分泌,NABS 主要防御传染性病原体,并参与肿瘤细胞的消除过程,这对早期预防肿瘤恶化非常重要。在癌症、炎症、感染性患者甚至是健康人体内能检测到抗Neu5Gc的抗体(Abs),且小鼠的B1细胞也能够分泌这种抗体[16],它可以是 IgA、IgM 或IgG 型,占血清Abs 总数的0.1%~0.2%,在健康人血液中存在特异性抗GM3(Neu5Gc)抗体,这些抗体通过激活补体系统能够杀伤表达GM3(Neu5Gc)的肿瘤细胞,血清中抗GM3(Neu5Gc)抗体水平随年龄的增加而降低,这表明对神经节苷脂的先天免疫在进化上已经固定了,也提示其对于肿瘤的免疫监测非常重要。
在人类生命进程中,一些疾病的发病风险升高除了与人类老化有关外,还可能是人类在进化过程中表观遗传学固有的变化[17],CMAH 缺失的完全固定是病原体介导的免疫选择的结果,如流感嗜血杆菌已经适应了Neu5Ac 的优先利用,从而避免了Neu5Gc在细菌的细胞表面表达,与之相似的还有霍乱弧菌,也通过适应Neu5Gc 在人类进化中的丢失机制而进化为人类特有的病原体[18-19],这种适应性的选择压力可能代表人类对Neu5Gc 异种抗原抗体反应;另外平衡多态性甚至是表达多态性可能发挥更大作用,通过女性生殖道中的抗体检测精子上的Neu5Gc抗原进行性别选择,雄性CMAH等位基因携带Neu5Gc,哺乳动物在直接接触精子时会产生抗精子抗体,这样的精子会被雌性子宫内的免疫细胞吞噬[20];此外灾变选择也是一种不能忽略的进化机制,在病毒流行中,合成相应碳水化合物抗原的父母群体灭绝,后代携带偶然的突变,子代体内的天然抗体与碳水化合物抗原结合消灭病毒,使这些子代免于灭绝,这个过程发生在古人类合成Neu5Gc抗原时,导致后代缺乏Neu5Gc 并产生相应抗体。现在很少有人会因为意外突变而失去一种常见的碳水化合物抗原,并产生一种天然抗体来对抗这种抗原,这类抗体在流行高毒性病毒事件中防止哺乳动物物种灭绝至关重要[21]。
2.2 免疫应答及逃逸 许多病原体依靠对宿主唾液酸不同的结合、合成和/或利用方式来逃避宿主的免疫防御,人体肠道黏膜免疫系统对胃肠道共生菌群有一定识别机制,某些条件下,可将其提呈并刺激淋巴细胞产生免疫应答,微生物或病原体细胞表面表达唾液酸分子,将自己伪装成自体成分,从而躲避或抑制宿主的免疫应答从而达到与人类共生的目的。人体中唾液酸生物合成酶对Neu5Ac 和Neu5Gc 一视同仁,但体液免疫系统却能将其区分,Neu5Gc可以说是一种独特的抗原,进入人体后它被当作外来抗原结合在宿主细胞表面[22],细胞生化机制识别其为“自我”,免疫系统识别为“非自我”,所以将其称为“异种自身抗原”,所以人体内Neu5Gc特异性免疫球蛋白(Ig)水平上下波动。Sia 对细胞排斥和黏附的影响已经被广泛研究,细胞反应性的改变和Sia 配体与互补受体唾液酸结合免疫球蛋白样凝集素家族(Siglecs)的结合有关,由于人类CMAH 基因的缺失引起的Neu5Gc/Neu5Ac 比值的变化则影响其结合能力的强弱,CD33相关的Siglecs能与Sia 选择性结合,Neu5Gc 的缺失有可能会让它们与Neu5Ac 结合;Siglec-9 表达在人的中性粒细胞和巨噬细胞上,与组织上特定的多元配体结合[23];Siglec-7 在 β 细胞上表达,人类 Siglec-7 的表达既可以抑制免疫激活又可以保持β 细胞功能使细胞存活,是一种新型治疗策略[24]。总之阻断其与Siglecs的相互作用,还需要更多了解特定的Siglec 结合结构、表达的内容、位置和时间等相关特性。Neu5Gc在人类免疫系统中的表现可定义为促炎分子[25],免疫调节失调可导致机体长期处于炎症状态,伤口转化为无法愈合的慢性溃疡[26],人体产生的Neu5Gc特异性抗体能够识别以唾液酸化糖蛋白或GM3 形式整合到细胞表面的Neu5Gc 结构并产生免疫应答反应最终生成慢性炎症,称为异种唾液酸炎(xeno⁃sialitis),所以人类细胞的所有糖基化在接触到其他动物血清后均可能被Neu5Gc 污染,会导致快速清除机制或触发抗体介导的炎症反应。用从人血清中获得的抗Neu5Gc 抗体培养血管内皮细胞后经转录组测序数据显示,大多数差异表达基因由预先存在的或抗人T 细胞球蛋白诱导的抗Neu5Gc 抗体共同激活,但不引起血管炎症变化[27]。构建的CMAH基因缺陷小鼠模型,有许多类人的特征表型,研究其内在病理生理后果,可以很好地阐明人体内相关的异常机制[28]。免疫应答假说认为GM3(Neu5Gc)在抑制肿瘤免疫应答中起着决定性作用,GM3(Neu5Gc)具有降低人和小鼠T 淋巴细胞CD4 表达的能力,特别是非活化T 细胞,从细胞中去除GM3后,CD4 的表达即完全恢复,GM3(Neu5Gc)还可能影响小鼠树突状细胞(DCs)的分化以及脂多糖对DCs成熟的刺激作用。此外,许多致命性致病菌,如人流感病毒、伤寒沙门菌和恶性疟原虫,更偏向与Neu5Ac 结合而不是 Neu5Gc,如恶性疟原虫(Pf)与赖氏疟原虫(Pr)非常相似,但物种易感性却很大不同,黑猩猩对Pr 易感,对Pf 不易感,人类则正好相反,这说明人类和黑猩猩的差异进化及疟疾易感性也与Neu5Gc缺失有关[21]。
3 Neu5Gc与癌症
Neu5Gc 在非人类Sia 中是独一无二的,在人类癌症免疫中具有重要作用,尽管由于CMAH 的功能丧失,人类不能合成Neu5Gc,但其仍可蓄积到由人细胞表达的聚糖中,含Neu5Gc 的糖蛋白可被培养的上皮细胞吸收,食物中的Neu5Gc 尤其是红肉和加工的肉制品的摄入被认为具有致癌和影响癌症变化的潜在风险,最近提出的一个假设是基于Neu5Gc和遗传毒性化合物的联合作用,影响肿瘤的发生进程[29],而抗 Neu5Gc 抗体同样可以刺激或抑制癌症进展。绝大多数(几乎100%)的人类具有与pAECs 结合的抗 Neu5Gc IgM 和 IgG 抗体,大约 50%的人具有与 pRBC 结合的抗 Neu5Gc 抗体[30],人类对Neu5Gc的抗原性并不是来自母系,而是由出生后食用含Neu5Gc 的牛奶后,由细胞表面常见的共生细菌所呈现出来的,这种通过抗体和补体介导的异种自身抗原诱导免疫应答后引起慢性炎症,增加了CMAH−/−小鼠形成癌症的风险[31]。体外实验显示,从饮食中加入Neu5Gc,最终能在一些上皮细胞和内皮细胞表面上呈现[32],而在包括肺癌、肝癌、结肠癌、肾癌、乳腺癌、皮肤癌、卵巢癌、喉癌和恶性淋巴瘤等多种癌症病理学中,Neu5Gc已被报告为潜在抗原(图2)。
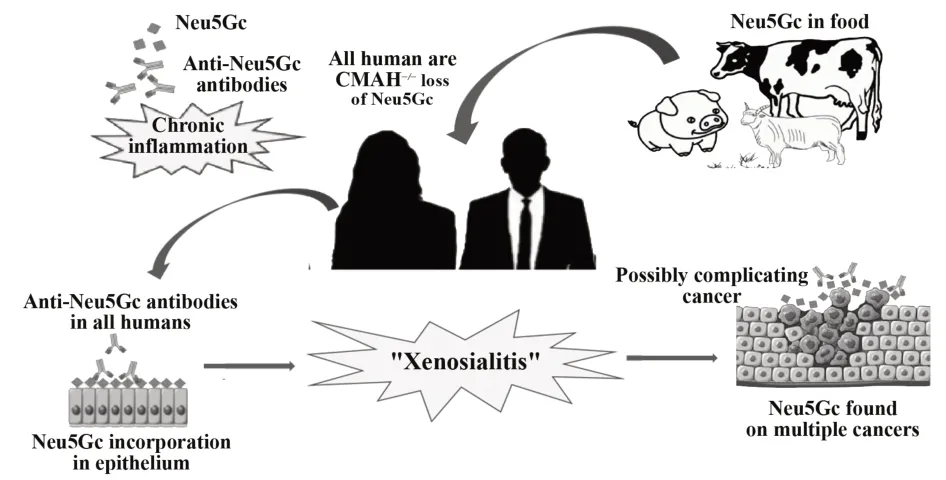
图2 Neu5Gc的摄入、积累和炎症的产生及对癌症的作用Fig.2 Absorption and accumulation of Neu5Gc,with generation of inflammation and their effects on cancer
在癌症进展期间肿瘤细胞常常能够产生免疫逃逸机制,主要通过表达低免疫原性抗原、抑制免疫细胞活化或者诱导免疫抑制微环境等方式,这些途径中的一些关键步骤可以为癌症靶向免疫治疗提供切入点。与免疫监视功能不同,免疫系统的炎症作用激活后反而会促进癌症进展,炎症还可以通过活性氧引起DNA 损伤,这是肿瘤发生过程中的致癌促进剂,由感染性和非感染性疾病引起的慢性炎症对于肿瘤的发生和发展是一种重要病因,炎症不仅在癌变过程中起促进作用,在免疫监视下生长的肿瘤反过来也会引起炎症,尤其是髓系细胞,如中性粒细胞和单核/巨噬细胞会促进癌症的浸润过程,因此,当免疫系统进行大量的免疫监视以消除肿瘤细胞时,炎症途径却被肿瘤细胞用来促进癌症的进展。肿瘤细胞表面异常糖基化是一种常见的癌症特征,其利用某些结构的损失或增益来实现糖基化重大改变,如截短结构的存在、前驱体的积累和新结构的合成,典型表现就是增加细胞表面的唾液酸,这不仅增加了总唾液酸含量,其修饰作用也有明显变化,与此同时Neu5Gc 在相应肿瘤组织中也高表达,Neu5Gc 能优先积累在恶性组织中,在缺氧的条件下,给 CMAH−/−小鼠饮用含 Neu5Gc 的水,与野生型相比基因缺失小鼠对Neu5Gc 的摄入明显升高。综上所述,肿瘤微环境越来越具有免疫抑制作用,导致肿瘤细胞存活和转移,肿瘤细胞糖基化通过“自我”样的方式诱导产生耐受性免疫细胞表型屏蔽效应细胞,促进免疫逃逸,最终导致肿瘤进展[33]。
4 应用前景
4.1 肿瘤的免疫诊断 肿瘤的早期诊断是降低癌症死亡率的关键,而无创分析或微创分析则是临床诊断最期望达到的理想状态,依赖于尿液或血清中肿瘤标志物水平变化来诊断是目前学者积极探索的方向[34]。由于假阴性或者假阳性较高,传统癌症生物标记物不能用于癌症的诊断,所以人们不断探索新的可靠的体液中可检测到的其他癌症生物标记物包括糖蛋白和抗异常聚糖抗体检测,抗异常聚糖抗体是一种保护性糖蛋白,对体内的外源性抗原具有高度的亲和力和特异性,最终导致抗原的消除[35-40]。异常唾液酸化主要表现为肿瘤抗原的增加,在健康组织中唾液酸的O-缩醛化可能影响其唾液酸化,在小鼠模型中的异种唾液酸炎在癌症发展中具有潜在危险,由于这种外源唾液酸的来源是饮食,所以避免含Neu5Gc 的食物摄入可能降低癌症风险,富含Neu5Gc 的红肉增加了炎症诱导癌症的风险,而Neu5Gc 消耗的减少也可能是干扰癌症进展的因素。Neu5Gc经代谢吸收进入人体内,被当作抗原来识别,产生Neu5Gc的抗体,当含有Neu5Gc的多糖遇到体液循环中的抗Neu5Gc 抗体时,就会触发炎症反应,从而促进肿瘤的生长[41]。有研究显示,在癌症患者中,产生H-D 抗体的患者发病率增加,随着唾液酸成分及其不同功能的深入研究,人们发现有一类含有Neu5Gc 末端结构的物质是人类某些肿瘤疾病中的一种特异性标志物,主要提示H-D抗原存在,含Neu5Gc 的糖基化合物作为人类的一种异体抗原,是一种癌胚抗原,也有称为Forssman抗原或H-D抗原,因此可考虑将循环抗Neu5Gc抗体作为一种肿瘤标志物来监测癌症患者血清变化情况。与健康组织中的细胞相比,肿瘤细胞表面上唾液酸的含量显著增加,唾液酸化的上调可能是因为摄入的Neu5Gc 优先在癌症组织中积聚。在胎儿、胎粪和某些实体肿瘤中均可检测到此抗原,唾液酸聚糖微阵列显示Neu5Gc 的抗体显著上调,这表明这种抗体可能起特定的肿瘤生物标志物的作用,如果该表位确实是相对癌症特异性的抗原,它可以用作治疗的靶点或用于药物递送的治疗工具。包括GM3 在内的含Neu5Gc 的神经节苷脂,最初被描述为 H-D 抗体的表位,GM3(Neu5Gc)是肿瘤联合抗原,单克隆抗体能够结合多种恶性组织,包括皮肤癌、神经外胚层肿瘤、泌尿生殖系统癌症、非小细胞肺癌和胃肠道肿瘤等,但目前还没有尝试控制患者饮食摄入Neu5Gc的试验。通过分析抗Neu5Gc抗体对不同Neu5Gc 聚糖表位的特异性,将70 多个化学酶法合成的Neu5Gc和Neu5Ac聚糖微阵列用以分析乳腺癌患者该抗体的结合特性,确定Neu5Gc 修饰的哪一种聚糖结构能够被识别。此外还利用含有20 个Neu5Gc 聚糖的靶标芯片,进一步分析了血清中抗体的结合特性,并在更多的样本中进行了验证,筛选出其中4 种糖基聚糖作为能区分正常人和前列腺癌、卵巢癌、子宫内膜癌、结肠癌、肺癌等各种癌症患者的潜在标志物,血清中各种类型的总抗Neu5Gc抗体与癌症风险呈正相关,这些发现也提示抗Neu5Gc 抗体作为肿瘤标志物的可能性,其中最显著的一个癌症相关表位是Neu5Gc 替代了Neu5Ac[42]。抗 Neu5Gc 抗体的分析可以用天然的Neu5Gc 进行,将聚糖与聚丙烯酰胺等聚合物偶联,并采用ELISA 方法检测抗体含量,这种便宜简单的方法可作为筛查工具用于监测疾病进展或治疗反应,而对Neu5Gc 抗体水平与肿瘤风险和进展的相关性通过数据库分析也是十分必要的。近年来,有诸多学者对Neu5Gc 及其抗体的定量检测不断付诸多种实践,在Neu5Gc 和Neu5Ac 电子结构参数和反应活性的研究中有效的区分仅有一个氧原子之差的这两种唾液酸结构[43]。NAGAI 等[44]利用亲水相互作用色谱-柱后衍生-荧光检测法测定血样中的唾液酸,MARTINS 等[45]利用高效液相色谱(HPLC)对Neu5Ac和Neu5Gc进行了分离、鉴定和定量,并系统地描述了优化后的HPLC 方法,将分布在肺膜上的唾液酸进行鉴别、分离和定量。还有学者建立了一种基于超分子质谱(MS)的方法对Neu5Gc 进行鉴定和定量,这是一种可靠的无衍生的Neu5Gc 分析方法,识别出Neu5Gc 和Neu5Ac 之间细微的结构差异[46]。此外还有人开发了糖队列,基于同位素标记然后通过反相高效液相色谱联用质谱分析(RPHPLC-MS)用于特定同分异构体的结构识别和唾液酸聚糖的定量,而将特异性唾液酸链全甲基化用于MALDI-TOF MS 方法,分析蛋白质糖基化作用中SSAP衍生化,同时与MALDI-TOF MS联用在糖组学分析中显示出独特的优势,并在治疗蛋白的糖基化图谱和临床糖链生物标志物的发现方面显示出一定 的潜 力[47-50]。 GONG 等[51]研制 了 一 种 用 于Neu5Gc可视化检测的纳米颗粒免疫层析试剂盒,利用Neu5Gc 和互补DNA 之间结合,与DNA 适配体进行竞争性反应,反应快速、灵敏,在Neu5Gc 相关癌症诊断方面具有巨大的潜力。除了对Neu5Gc 本身的检测和定量,各方学者还对抗Neu5Gc 抗体在异种排斥过程中的作用及如何利用Neu5Gc 结构复杂性来设计新的诊断方式以检测抗Neu5Gc 抗体展开研究[52]。CHENG 等[53]开发并合成了 3 种唾液酸形式的9-叠氮基类似物,可以在哺乳动物的细胞表面糖基中代谢,产生可识别含有Neu5Gc 的唾液聚糖抗体,表明唾液酸类似物可用于免疫学研究。使用聚糖微阵列来分别研究静脉注射的免疫球蛋白(IVIG)或混合的人类IgA 中的抗Neu5Gc IgGs 和IgAs,与 Neu5Gc-聚糖结合/Neu5Ac-聚糖结合的微阵列结合模式,不同的IVIG 制剂具有高度特异性的抗Neu5Gc IgG 反应,这种不同的抗Neu5Gc IgG/IgA序列在个体中可能对人类疾病有不同影响[54-55]。
4.2 肿瘤的免疫治疗 近年来在癌症治疗中免疫疗法展现了一定优势,其基本原理为诱导或扩大宿主对癌细胞的免疫反应,从而区分癌症和正常细胞之间的细微差别,目前主要有3种常见的免疫疗法:靶向细胞疗法、免疫检查点阻断(如针对PD-1 或PD-L1 的单克隆抗体进行阻断)和具有治疗性的癌症疫苗,疫苗可刺激肿瘤特异性T 细胞和肿瘤相关抗原抗体产生适应性免疫应答,目前瓶颈在于目标抗原的识别非常困难,所以获得成功的肿瘤疫苗寥寥无几[56-63]。
碳水化合物免疫原性较差,但其作为治疗靶点有巨大潜力,糖链广泛存在于细胞表面,被抗体和免疫受体识别、保护或清除。与正常细胞相比,癌细胞表现出异常的糖基化模式,而肿瘤相关糖抗原可以通过直接凋亡、Fc-阳性效应细胞或互补作用等方式对肿瘤细胞进行杀伤[64-65],肿瘤相关的糖基化变化产生碳水化合物新抗原,是免疫治疗的理想候选靶点,而Sia 作为覆盖在细胞表面的多糖,经常改变癌细胞上与癌症进展和/或转移相关的表达,特别是Neu5Gc,这种抗原在人类癌症上积累,产生了一系列癌症新抗原[66-67]。基于靶向抗原的低抗原性、肿瘤异质性和某些癌症中只有少数新抗原的低突变负担等限制,科学家希望寻找疫苗的其他潜在抗原,设计出一种有活性的癌症疫苗。采用高通量唾液酸多糖微阵列的方法监测疫苗效力,结果显示免疫反应动力学和疫苗质量是直接影响疫苗疗效的主要因素[68-70]。此外还有研究者开发利用以GM3(Neu5Gc)为靶点的疫苗,其主要机制是造成细胞质膜较大损伤,使其膜完整性丧失,胞内容物释放,促进提呈细胞对某些免疫原分子的识别、活化,在肿瘤部位引起炎症反应,激活和增殖T淋巴细胞,这个机制不依赖能量,不需要蛋白质重新合成,不受代谢抑制剂的影响[71]。此外,还有研究者通过技术手段得到一种特定的人源化GM3(Neu5Gc)神经节苷脂抗体14F7hT,验证其对几个不同器官肿瘤组织的识别能力和潜在的抗肿瘤效应,同样证明GM3(Neu5Gc)可作为肿瘤免疫治疗的靶点,而14F7hT也有望成为一种新型抗癌药物[72]。
5 总结与展望
蛋白质糖基化的改变对疾病的所有阶段都有决定性的影响,在恶性转化过程中,糖基化作用与健康组织相比发生了严重改变。恶性组织中,唾液酸化聚糖在细胞表面上调尤其是Neu5Gc 的增加,是异常糖基化的一个关键变化,表明这些抗体可能作为特定的肿瘤生物标志物发挥作用,如果这种表位确实是一种相对于癌症的特异性抗原,它有望成为靶点和药物传递的治疗工具。在功能上,癌症相关的高唾液酸修饰直接影响肿瘤细胞与微环境的相互作用,人体中Neu5Gc 是通过食物来源(特别是红肉)代谢进入组织的,自婴儿期接触含有Neu5Gc的奶制品导致产生抗Neu5Gc 抗体开始,这一过程持续存在于所有正常个体中,抗原抗体的免疫反应会产生慢性炎症,进而诱导癌症的发生和发展。这种错综复杂的相互作用为激活Neu5Gc 相关的致癌途径提供了分子基础,也提供了相关糖基化表位的重要来源,癌症特异性的蛋白糖基化改变所创造的特征分子可能被用来靶向肿瘤细胞,或者在肿瘤部位分泌或脱落到体液中然后作为非侵入性生物标志物。聚糖在不同的组织中具有多种作用,含有Neu5Gc的聚糖也可能是治疗的靶点,抗聚糖抗体的水平与疾病预后、生存率和监测疾病复发相关[73],那么抗Neu5Gc 抗体和/或Neu5Gc 组织负荷能否预测癌症的产生风险,降低Neu5Gc 负荷能否降低患癌风险,由红肉的摄入、异种唾液酸炎的产生和癌症风险之间的联系可知,减少Neu5Gc 的摄取或抑制其合成相关聚糖能够减少异种唾液酸炎的发生以及加强对癌症的预防,考虑到对人类疾病预防和治疗的潜在影响,Neu5Gc及其相互作用需要进一步的实验和转化研究。许多关于人类Sia 生物学的问题仍然没有得到探索或报道,希望这些研究能够进一步突出唾液酸的重要性并促进治疗学的进一步研究,因此糖生物学领域应继续朝着糖基化在癌症生物学、疾病的进展过程中的分子机制及其发挥的相关功能方面进行深入研究。