鸟粪石晶体生长速率关键影响因素的定量分析
2021-11-26孙雅周通陈广源季琳安吉远辉陆小华王昌松
孙雅,周通,陈广源,季琳安,吉远辉,陆小华,王昌松
(1 南京工业大学材料化学工程国家重点实验室,江苏南京210009; 2 东南大学化学化工学院,江苏省生物药物高技术研究重点实验室,江苏南京211189)
引 言
我国每年产生的城市污水中氨氮总量约为26万吨[1-2]。氨氮排入水体后容易引起水中藻类及其他微生物大量繁殖,造成水体富营养化,严重时会使水中溶解氧下降,鱼类大量死亡[3]。目前,污水处理厂普遍采用传统的生物技术,如硝化和反硝化,但能耗大,氮元素被去除而不能回收再利用[4-5]。水体中的氮元素是动、植物生长发育不可或缺的营养素,是一种极好的肥料[6],因此,开发回收氨氮的技术是可持续发展的要求。
鸟粪石结晶法在实现高效脱氮的同时能充分回收氨氮,产物是重要的农用缓释肥料[7]。通过投加Mg2+和PO43-,使之与废水中的氨氮生成难溶性复盐 MgNH4PO4·6H2O (magnesium ammonium phosphate,MAP)从而达到净化废水中氨氮的目的,其反应如式(1)所示[8-9]。MAP 法可对不同类型废水进行氨氮回收,包括工业印染废水[10]、养猪废水[11]、垃圾渗滤液[12]等。
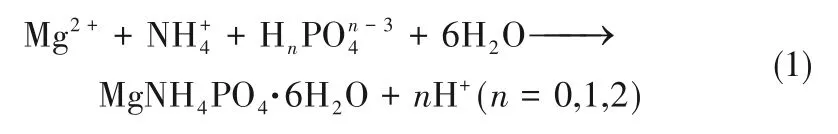
然而,MAP 晶体生长过程缓慢,晶粒细小[13-15]。因此,许多学者致力于研究MAP 晶体的生长机理,以提高MAP 的生长速率,增大粒径,开发其经济价值。如Ariyanto 等[16]发现温度和搅拌速度的提高显著增加了MAP 的生长速率,Koralewska 等[17]发现溶液中镁离子的质量分数从0.1%提升到2%时,MAP晶体的生长速率从8.38×10-9m/s提高到2.11×10-8m/s;当选择pH 为8.5、镁磷比为1.2、延长悬浮液平均停留时间至3600 s时,MAP晶体的生长速率从4.11×10-9m/s 提高至1.01×10-8m/s[18]。大量研究发现,溶液pH、温度、离子浓度和水动力条件等对MAP 晶体生长过程均具有重要影响,然而鲜有研究关注上述各参数条件对MAP生长的定量影响。
对于MAP 晶体生长过程,表面能理论、吸附层理论和基于扩散反应的传递理论常被用来解释晶体生长机理,但上述理论均使用表观浓度作为热力学推动力,为定量化研究带来了局限性[16,19]。而吉远辉团队用化学势替代表观浓度,建立了化学势梯度模型,可更准确预测晶体在不同条件下的溶解曲线和结晶动力学过程[20-23]。
本文拟利用该模型,选取温度、搅拌速度、pH和三种离子摩尔比四种影响因素,从热力学推动力和动力学生长速率常数两个方面评估影响MAP 生长的关键参数,并采用X 射线衍射仪(XRD)和粒度分析仪对晶体进行表征分析。
1 化学势梯度模型
MAP 结晶过程符合黏附型生长机制,生长速率与化学势梯度的关系为[21]:

式中,Gi是生长速率,mol/min;kt是生长速率常数,mol/min;R是理想气体常数,J/(mol·K);T是结晶的热力学温度,K分别是MAP 在主体相和固相中的化学势,J/mol。
MAP 结晶过程中的热力学推动力化学势梯度采用式(3)计算:
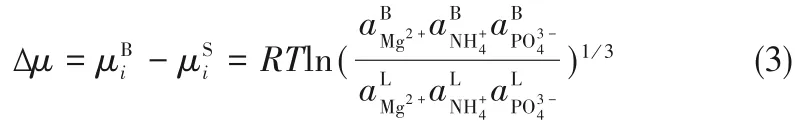

将式(2)通过式(3)改写为:

MAP晶体在水溶液中的生长速率被定义为:

式中,V是结晶溶液的体积,L是在溶液相中的浓度,mol/L。
将式(5)代入式(4)可得:
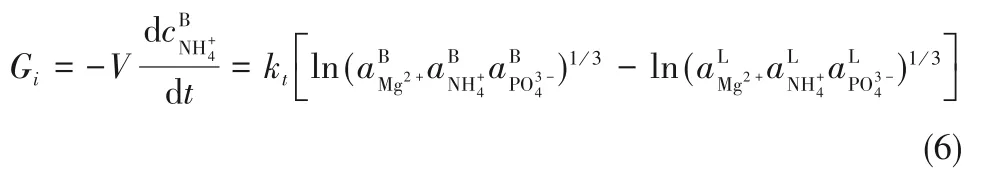
其中,kt值可通过参数和之间的关系进行回归。
Mg2+和在主体相和饱和溶液中的活度由式(7)和式(8)计算得到:


式中,A是常数,0.509(mol/kg)-1/2;I是离子强度,mol/L;zi是组分i的化合价;ci是组分i的浓度,mol/L。
MAP生长速率,计算公式如下:

式中,r是晶体的平均生长速率,m/s;Lproduct是产物经粒径测试后占比最多的粒径大小,m;Lseed是晶种经粒径测试后占比最多的粒径大小,m;t是晶体生长所用时间,s。
2 实 验
2.1 实验材料和装置
氯化铵(NH4Cl)、氢氧化钠(NaOH)和六水合氯化镁(MgCl2·6H2O)购买自西陇科学股份有限公司。十二水合磷酸氢二钠(Na2HPO4·12H2O)和盐酸(HCl)购买自国药集团化学试剂有限公司。MAP 晶种自制。实验用水均为超纯水。
实验装置见图1。

图1 实验装置示意图Fig.1 Schematic diagram of experimental equipment
2.2 实验方法
2.2.1 晶种的制备 量取500 ml 的0.0357 mol/L 模拟氨氮溶液于烧杯中,按照[Mg2+]∶[NH+4]∶[PO3-4]=1∶1∶1 的比例投加药品。称取一定量Na2HPO4·12H2O溶解于氨氮溶液中,调节实验温度25℃,pH=9,将MgCl2·6H2O 少量多次投加至溶液中,pH 开始下降时,用1 mol/L 的NaOH 维持pH=9。投加完毕后,继续搅拌10 min,静置1 h,沉淀产物用去离子水洗涤,放入鼓风干燥箱40℃干燥24 h。每组实验固定晶种量50 mg。
2.2.2 MAP 晶体生长实验 考察温度、pH、搅拌速度和离子摩尔比对MAP 生长速率的影响,实验条件如表1 所示。具体实验步骤为:配制0.00285 mol/L的模拟氨氮溶液,称取相应量的MgCl2·6H2O 和Na2HPO4·12H2O 固体。在夹套烧杯中用100 ml的模拟氨氮溶液溶解Na2HPO4·12H2O,调节温度和搅拌速度至实验值,随后加入晶种抑制初成核。以往的研究表明,在少量可溶和不可溶物质的反应结晶中,二级成核现象发生程度很小[25]。因此,在实验过程中投加晶种以确保晶体处于生长阶段。另取一烧杯,将MgCl2·6H2O 溶解于100 ml 氨氮溶液中,将其倒入夹套烧杯中,用0.05 mol/L NaOH 调节pH 至实验值,开始计时反应。实验过程中用pH 计监测pH 的变化。分别在1、3、5、7、10、20、30、60、90、120、180、240 min 时使用0.45 μm 滤膜采集样品,取出的滤液立即加入1 mol/L HCl 终止反应。样品采集完成后进行氨氮浓度的测定。MAP 晶体用去离子水洗涤,然后干燥,进行表征分析。
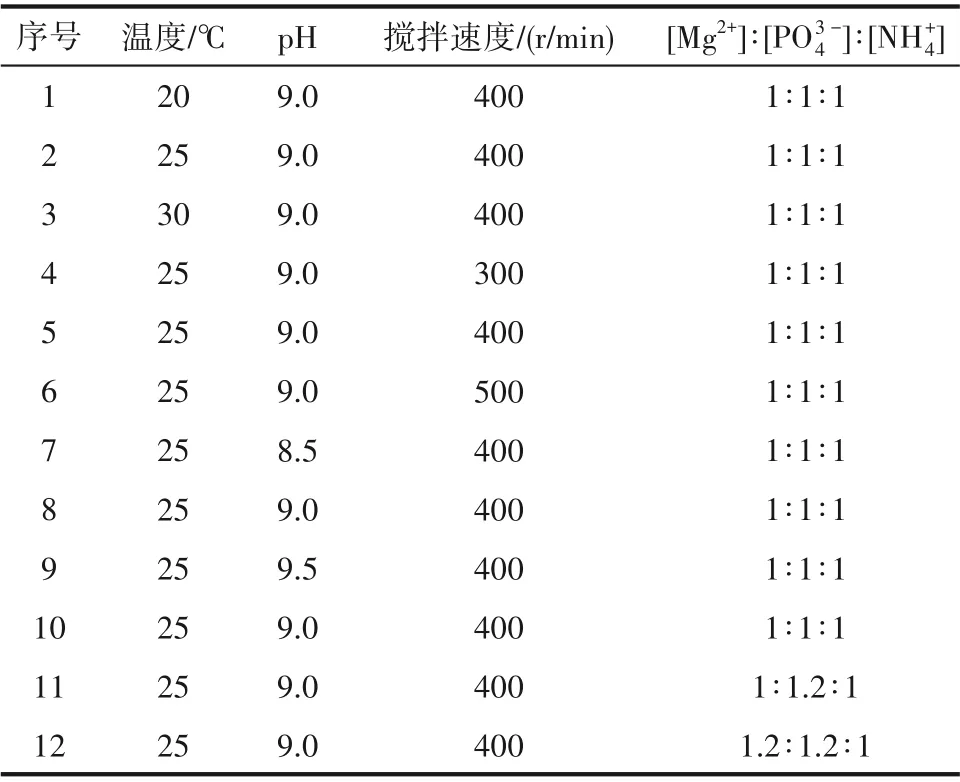
表1 MAP结晶的实验条件Table 1 Experimental conditions of MAP crystallization kinetics
2.2.3 表征方法 pH 值采用玻璃电极法测定,pH计为上海雷磁公司生产;氨氮浓度采用水杨酸分光光度法进行测定,测试仪器为哈希公司DR3900 多参数水质分析仪;采用德国Bruker 生产的D8 Advance 型X 射线衍射仪对晶体组分进行表征;粒径分布借助Microtrac S3500型激光粒度仪测定。
3 结果与讨论
3.1 不同因素对MAP结晶过程的影响
图2 为温度、搅拌速度、pH 和离子摩尔比对MAP 晶体生长动力学的影响。由图2 可见,随着反应时间的推移,溶液浓度快速下降后逐渐趋于平衡浓度。但各因素变化对平衡浓度的影响各有差异。
如图2(a)为MAP在不同温度下的晶体生长动力学曲线。由图可看出,同一时间内MAP 过饱和水溶液浓度的下降趋势加快,并且随着温度的提高,MAP 晶体的生长速率加快。但40 min 后,平衡浓度与温度变化成反比,这可能是温度对溶解度的影响所产生的变化[26-27]。
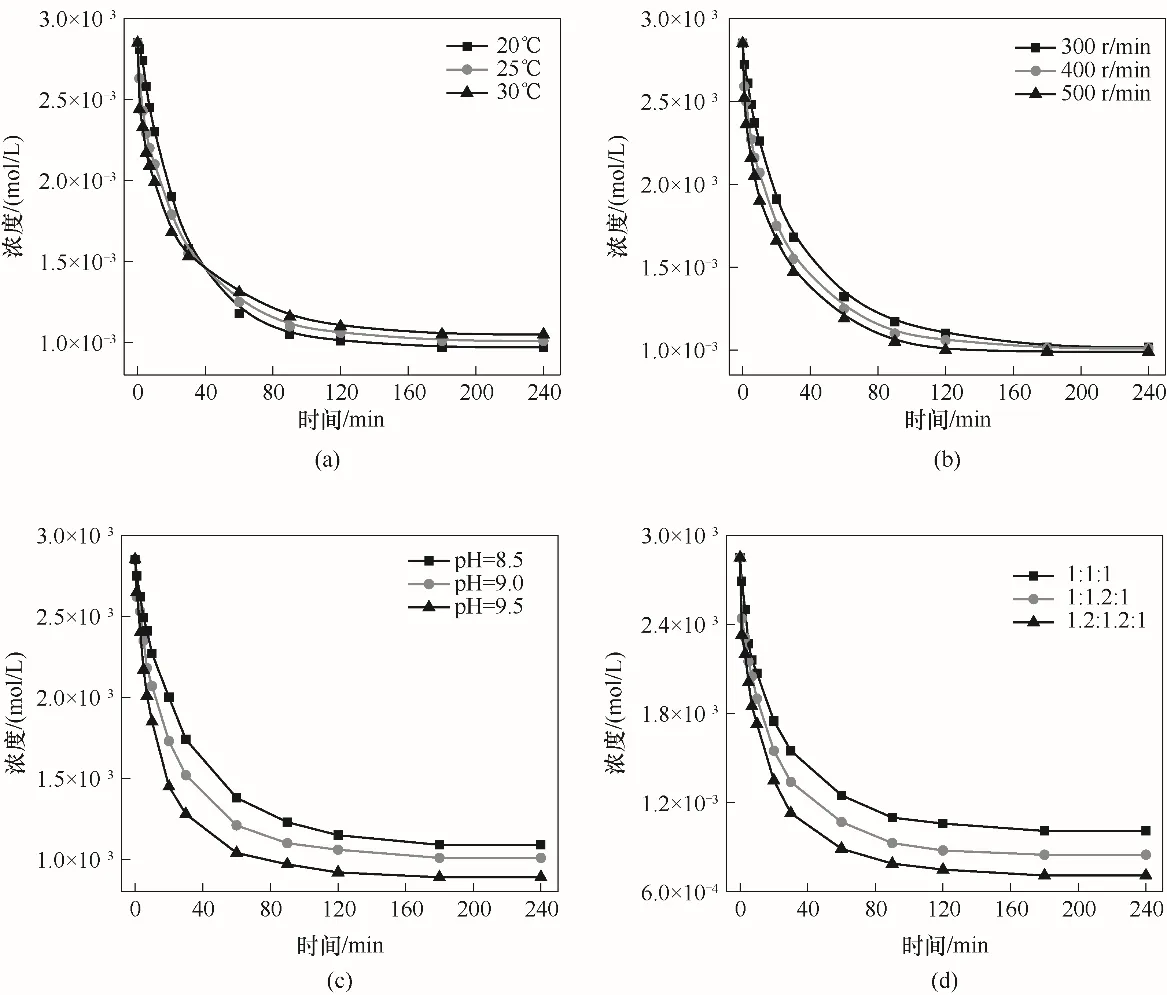
图2 不同因素对MAP晶体生长动力学的影响(a)温度;(b)搅拌速度;(c)pH;(d)离子摩尔比Fig.2 Effect of different factors on the kinetics of MAP crystal growth(a)temperature;(b)stirring speed;(c)pH;(d)ion molar ratio
MAP 在不同搅拌速度下的晶体生长动力学如图2(b)所示。从图2(b)可以看出,同一时间下,随着搅拌速度的提高,MAP 过饱和水溶液浓度下降速率明显加快,即生长速率加快,更快地到达平衡浓度。这可能是由于更高的混合速率加速了溶质离子的移动,从而增加了溶质离子和晶体表面的碰撞概率[28],从而提高了晶体的生长速率。最终不同搅拌转速下的MAP 平衡浓度趋于一致,这是由于溶解度不受搅拌速率影响,在足够长的时间内就能达到相同的平衡浓度。
MAP 在不同pH 水溶液中的晶体生长动力学曲线如图2(c)所示。从图中可以看出,同一时间下,随着溶液pH 的增加,MAP 晶体的生长速率明显加快,这是因为pH 增加,MAP 晶体的溶解度减小[29],形成沉淀的推动力增强。同时,pH 对的解离有较大影响,H2和消耗了OH-,将其转化为更多的,从而加速反应[30]。
图2(d)展示了不同离子摩尔比对MAP晶体生长动力学的影响,由图2(d)可以看出,随着摩尔比的增大,相同时间下MAP 生长速率也加快。这是由于MAP 理论上三种构晶离子的反应计量比为1∶1∶1[31],当相同条件下增加计量比,则反应推动力增强,化学反应必然向正向移动。
3.2 化学势梯度模型在MAP 晶体生长过程中的研究
3.2.1 不同因素对生长速率常数kt的影响 利用基于黏附型生长机制建立的化学势梯度模型计算MAP 在不同条件下的晶体生长动力学。根据式(4)~式(6)得到不同条件影响下MAP 晶体的生长速率常数kt,表2 中序号对应的实验条件与表1 一致。可见,随着温度的升高,MAP 的生长速率常数升高,这是由于温度增加,溶液中溶质离子运动速率加快[32];搅拌速度的提升导致传质速率加快[33],从而增大了MAP 的动力学生长速率常数。但当搅拌速度提升至400 r/min 后,生长速率常数提升幅度减缓,推测溶液临近全混状态,晶体生长将由传质控制变为反应控制。
pH 和离子摩尔比的升高对MAP 晶体的生长速率常数产生了更为显著的影响,从表2看出,生长速率常数kt随着pH的升高而提高,当pH从8.5提升至9.5 时,体系的生长速率常数由2.95×10-4mol/min 提高到5.00×10-4mol/min。pH 的升高有助于晶体的生长,高pH 下,晶体表面电荷运动加快,进而溶质沉积到晶体表面的速度加快[34]。离子摩尔比也极大地影响了体系中MAP 生长速率常数kt。当增加体系中磷酸盐的投加量时,生长速率常数提高近2倍,进一步增加镁盐比例时,生长速率常数提高至近3倍,即离子摩尔比[Mg2+]∶[PO3-4]∶[NH4+]从1∶1∶1 提 升至1.2∶1.2∶1 时,生长速率常数最终达到9.68×10-4mol/min。
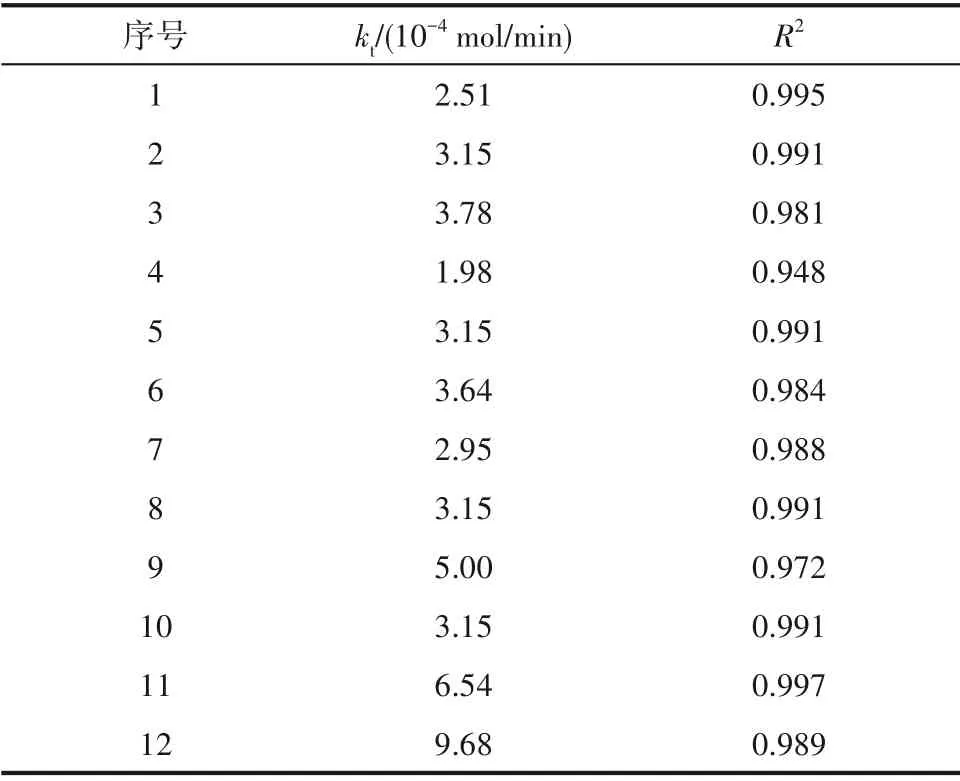
表2 不同因素影响下的生长速率常数ktTable 2 Growth rate constant kt under the influence of different factors
体系中的生长速率常数kt越大,说明晶体生长速率越快。上述结果表明,温度、搅拌速度、pH以及离子摩尔比的提高能够使MAP 晶体的动力学生长速率常数kt有不同程度的提高。其中,离子摩尔比对生长速率常数的影响最大,pH影响次之。
3.2.2 不同因素对MAP 结晶热力学推动力Δμ的影响 图3 进一步探究了不同因素对热力学推动力Δμ的影响。图3(a)为不同温度条件下热力学推动力随时间的变化,可见结晶温度对MAP 晶体的Δμ有着显著影响。实验初始阶段,相同时间下,温度越高,初始推动力越低。如在反应进行至20 min 时,随温度提升,热力学推动力Δμ1、Δμ2和Δμ3减小,分别为85.1、76.4 和70.7;但生长速率随着温度的升高而加快,利用式(2)计算出对应温度下的生长速率G分别为8.77×10-6、9.70×10-6和1.06×10-5mol/min。可见,MAP 晶体在较高结晶温度下生长速率加快的重要原因是动力学因素kt,而不是热力学因素Δμ。随着时间的推移,不同温度下Δμ下降速率均有所减缓,差异性减小并逐渐趋近于零,这表明体系慢慢趋于平衡。
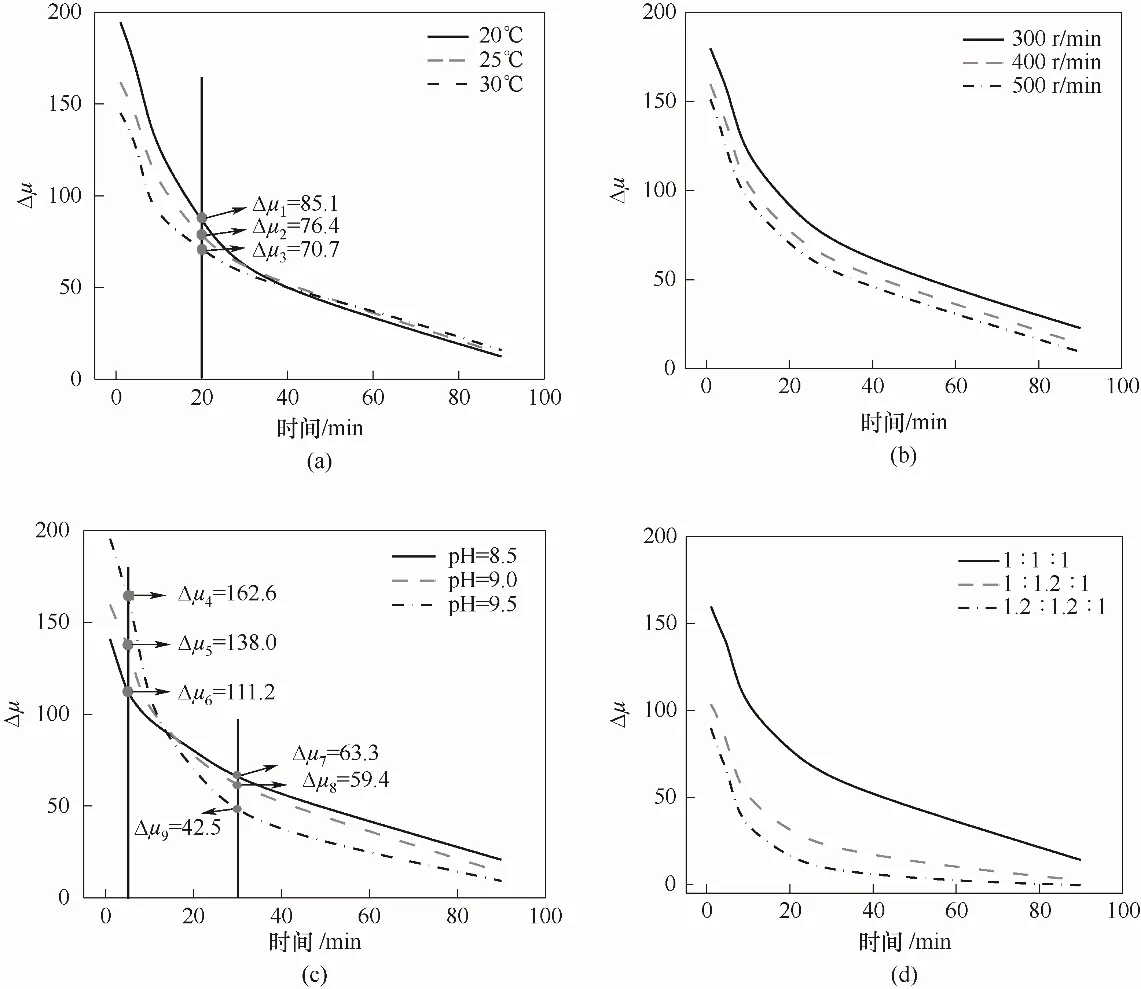
图3 不同因素对热力学推动力Δμ的影响:(a)温度;(b)搅拌速度;(c)pH;(d)离子摩尔比Fig.3 Influence of different factors on thermodynamic driving force Δμ:(a)temperature;(b)stirring speeds;(c)pH;(d)ion molar ratio
同样,搅拌速度和离子摩尔比也有类似的现象。如图3(b)所示,随着搅拌速度的提高,初始Δμ不断降低,随着反应的进行,推动力在逐步衰减,具有更高搅拌速度体系中的Δμ要始终低于较低搅拌速率体系中的Δμ。搅拌速度的提升加快了溶液中的传质速率,这也意味着,传质速率的增强最终导致动力学生长速率常数kt增加,进而使MAP 晶体的生长加快。图3(d)表明随着离子摩尔比的增加,推动力衰减极为迅速,体系到达平衡的时间明显缩短,生长速率的加快也是由动力学生长速率常数kt的极大增强导致。
除了动力学生长速率常数kt的提高可以加快生长速率外,热力学推动力的提高也可能使生长速率加快。图3(c)为pH 对热力学推动力Δμ的影响。初始推动力随pH 的升高而升高,如5 min 时,Δμ4>Δμ5>Δμ6,分别为pH=9.5、9.0、8.5 时的热力学推动力;其对应的生长速率分别为3.28×10-5、1.75×10-5、1.32×10-5mol/min。基于表2 的数据和式(2),说明在反应初期,MAP 晶体生长速率的上升不仅是因为生长速率常数kt的提高,也得益于热力学推动力Δμ的增强。
然而,图3(c)也表明,Δμ在pH 9.5比在pH 8.5时要衰减得快。如反应进行到30 min时,得到不同pH条件下的热力学推动力Δμ7>Δμ8>Δμ9,此时晶体的生长速率分别为7.53×10-6、7.55×10-6、8.58×10-6mol/min,依旧呈现上升趋势。基于表2 的数据和式(2),说明此阶段尽管反应过程中热力学推动力不断衰减,但生长速率常数kt的提高使得生长速率仍然不断加快。
3.3 晶体表征
3.3.1 晶种表征 图4 为晶种的相关表征结果,晶种证实为MAP晶体[35],主体粒径分布在31 μm。
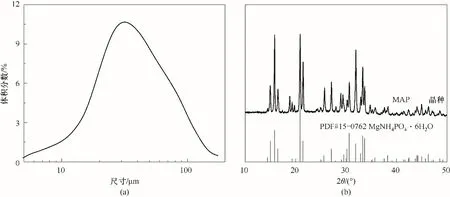
图4 晶种的粒径分布图(a)和XRD衍射图(b)Fig.4 Grain size distribution(a)and XRD diffraction(b)of crystal seed
3.3.2 产物的表征 对不同实验条件下所得产物进行XRD 表征,说明沉淀产物的主要成分为MAP,与文献报道的结果一致[35-36]。
通过激光衍射分析了晶体在不同实验条件下的粒径分布,结果如图5所示。从图中可发现,所有实验条件下得到的MAP 产物的粒径都比晶种要大。随着温度的升高,MAP 的主体粒径基本不变,搅拌速度的提高导致晶体主体粒径右移,开始增大。在提高pH 和离子摩尔比过程中,右移趋势显著增强,在pH 由8.5 上升到9.5 时,晶体的主体粒径增幅近30 μm,离子摩尔比由1∶1∶1 提高至1.2∶1.2∶1 时,主体粒径增幅达到了50 μm。

图5 不同因素影响下MAP晶体的粒径分布图:(a)温度;(b)搅拌速度;(c)pH;(d)离子摩尔比Fig.5 Size distribution of MAP crystals under the influence of different factors:(a)temperature;(b)stirring speeds;(c)pH;(d)ion molar ratio
表3为不同实验条件下根据式(11)计算所得的晶体平均生长速率r,同样,对应序号实验条件与表1 所列一致。结果表明,MAP 的主体粒径生长速率在10-9~10-8m/s 之间。特别当pH=9.5 时,晶体的平均生长速率为1.02×10-8m/s;离子摩尔比1.2∶1.2∶1时,晶体的平均生长速率达到1.29×10-8m/s,与其他条件相比提高了近10 倍,主体粒径达到124.4 μm。基于表3 中的平均生长速率计算发现,离子摩尔比影响最大,其次是pH,搅拌速度和温度影响较小。

表3 不同实验条件下晶体的平均生长速率Table 3 Average growth rate of crystals under different experimental conditions
4 结 论
本文利用化学势梯度模型研究了MAP 在不同条件下的晶体生长动力学,定量分析了不同条件对MAP 动力学生长速率常数kt和热力学推动力Δμ的影响。分析结果表明:MAP 的生长速率随着温度、搅拌速度以及离子摩尔比的提升而提高,其主要原因是动力学生长速率常数kt的提高;pH 的提高对kt和热力学推动力均有影响,最终导致结晶速率的上升。离子摩尔比和pH 对MAP 结晶过程影响较大,使得生长速率提高了近10倍,而温度和搅拌速度的改变对生长速率的影响并不显著。
