术前炎症指标对肝细胞癌肝切除术患者的预后预测价值
2021-11-26冯晴方吉陈雪丹
冯晴 方吉 陈雪丹
肝细胞癌(HCC)是炎症相关性恶性疾病,约90%以上的HCC患者有肝损伤或肝炎症背景[1]。肝切除术是HCC主要的治疗手段,但术后并发症多且复发风险高[2],因此准确评估术后预后具有重要意义。近年来,肿瘤微环境和炎症相关细胞对HCC患者预后的影响受到广泛关注[3⁃4]。多项研究表明术前炎症指标中性粒细胞与淋巴细胞比值(NLR)、血小板与淋巴细胞比值(PLR)和预后营养指数(PNI)可较好地评估HCC患者的总生存期[4⁃6]。但是这些炎症指标目前仍没有明确的临床截断值,不同研究采用的截断值存在较大差异[7⁃8]。将连续数据转换为分类变量进行多因素分析,虽然可在一定程度上提高临床实用性,但仍不能反映连续变量细微变化时研究结局的情况,甚至还会导致统计效能低下,致使得出不合理结果。限制性立方样条模型将样条函数与广义线性模型(Cox回归等)结合,可把连续变量微小的数量改变对应研究结局效应值的影响用连续性曲线的形式直观地呈现出来,是描述连续性暴露与结局剂量反应关系的分析方法之一[9]。本研究基于限制性立方样条使用连续变量,探讨术前炎症指标NLR、PLR和PNI预测肝细胞癌患者肝切除术的预后价值,以期提供更准确、更个体化的预后评估指标。
1 资料与方法
1.1 研究对象
本研究为回顾性队列研究。选择2015年6月—2018年3月于本院行肝切除术的HCC患者为研究对象。患者纳入标准:⑴经组织病理学确诊为HCC;⑵年龄18~80岁;⑶初次行肝切除术,术前未接受任何抗肿瘤治疗;⑷Child⁃Pugh分级A级或B级;⑸临床病理资料完整。排除标准:⑴合并其他肿瘤者;⑵合并远处转移者;⑶术后3个月内死亡者。本研究经本院伦理委员会审查通过。
1.2 资料收集与定义
术前通过本院电子病历系统收集患者一般资料和临床资料,包括年龄、性别、乙肝表面抗原(HBsAg)、甲胎蛋白(AFP)、血清白蛋白(ALB)、天门冬氨酸氨基转移酶(AST)、丙氨酸氨基转移酶(ALT)、总胆红素(TBiL)、是否肝硬化、肿瘤大小、肿瘤数目、肿瘤分化程度、肿瘤包膜是否完整、巴塞罗那(BCLC)分期、Child⁃Pugh分级、中性粒细胞计数、淋巴细胞计数以及血小板计数等。计算NLR、PLR和PNI,其中NLR=中性粒细胞计数/淋巴细胞计数,PLR=血小板计数/淋巴细胞计数,PNI=ALB+5×淋巴细胞计数。
1.3 研究结局与随访
以电话或门诊复查等方式进行随访,术后3个月内每个月随访1次,之后每3个月随访1次,2年后半年随访1次,随访患者生存情况,随访截至2021年1月。本研究将患者总生存期(OS)作为研究终点。OS定义为患者术后到死亡或随访截止的时间。
1.4 统计学方法
计量资料以均数±标准差()表示;分类数据以n(%)表示;Kaplan⁃Meier法计算累积生存率,Log⁃rank检验行单因素分析,采用逆Kaplan⁃Meier法计算中位随访时间。Cox比例风险回归分析影响OS的因素,计算风险比(HR)及其对应的95%可信区间(CI),其中采用限制性立方样条模型分析NLR、PLR和PNI与HCC患者死亡风险的剂量反应关系,回归样条设置3个节点,位于肿瘤大小的5%、50%和95%上。构建2个列线图模型用于判断患者预后,模型1仅包括NLR、PLR和PNI,模型2在模型1的基础上结合影响OS的因素建立模型,预测结局为1、3年总生存率。采用时间依赖的受试者工作特征(ROC)曲线评估本NLR、PLR、PNI、模型1和模型2的预测效能,ROC曲线下面积(AUC)比较采用Delong′s检验。采用R 3.6.1软件(https://www.r⁃project.org/)进行数据分析,其中survival程序包用于Cox比例风险回归模型分析,rms程序包用于限制性立方样条模型分析以及列线图模型构建,以双侧P<0.05为差异有统计学意义。
2 结果
2.1 一般资料
共77例患者符合标准纳入分析,其中男性59例,女性18例;中位年龄51岁(范围:33~79岁)。77例患者中位随访30个月(范围:3~62个月),随访期间死亡22例,失访5例。肿瘤分化程度中高分化的1年总生存率大于低分化,肿瘤包膜不完整的1年总生存率低于完整者,差异有统计学意义(均P<0.05),见表1。
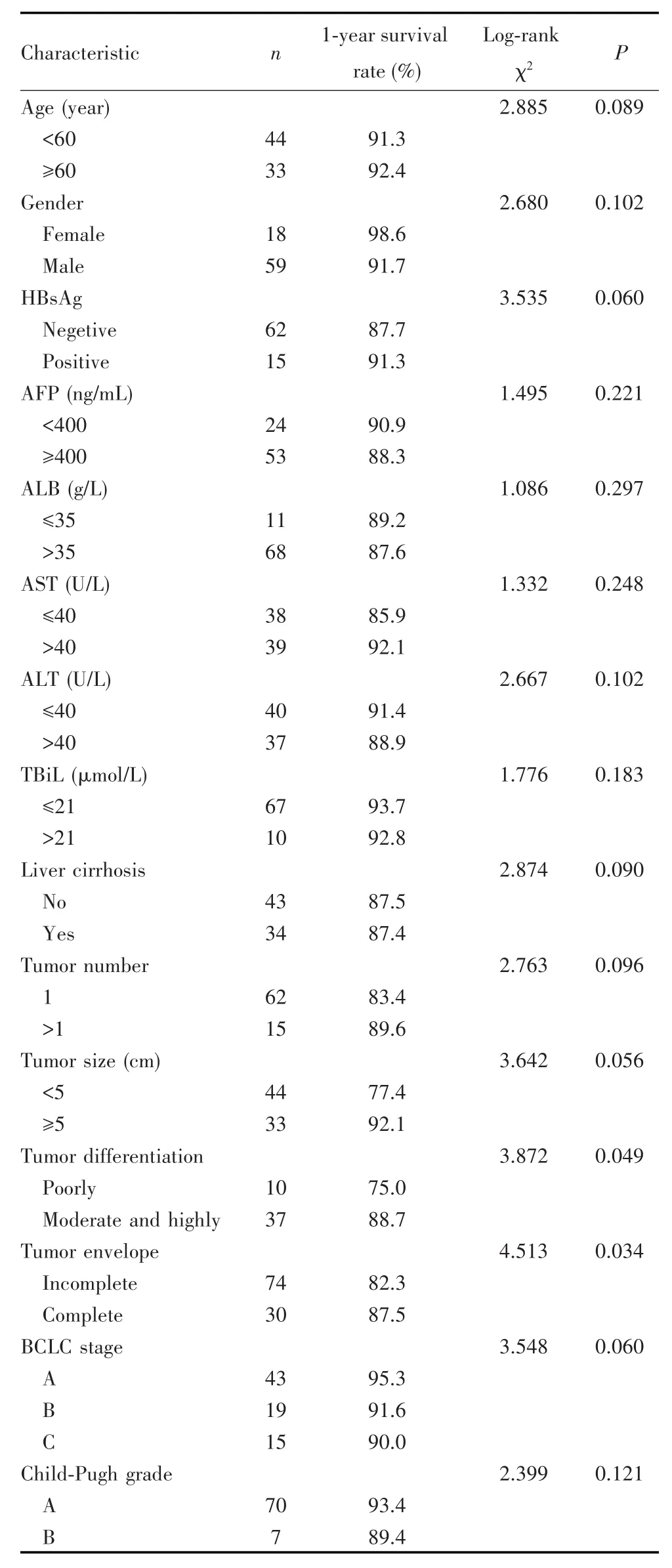
表1 HCC患者OS的单因素分析Tab.1 Univariable analysis of OS in HCC patients
2.2 Cox比例风险回归分析影响HCC患者OS的因素
限制性立方样条分析结果显示,NLR、PLR、PNI与HCC患者的死亡风险均呈线性关系(非线性P>0.05),即本研究范围内随着NLR、PLR、PNI比值升高,患者死亡风险亦升高。将NLR、PLR、PNI、肿瘤分化程度以及肿瘤包膜是否完整纳入多因素Cox比例风险回归,并对NLR、PLR、PNI进行限制性立方样条分析,结果显示NLR、PLR、PNI、肿瘤分化程度以及肿瘤包膜均是影响HCC患者OS的因素,见表2。
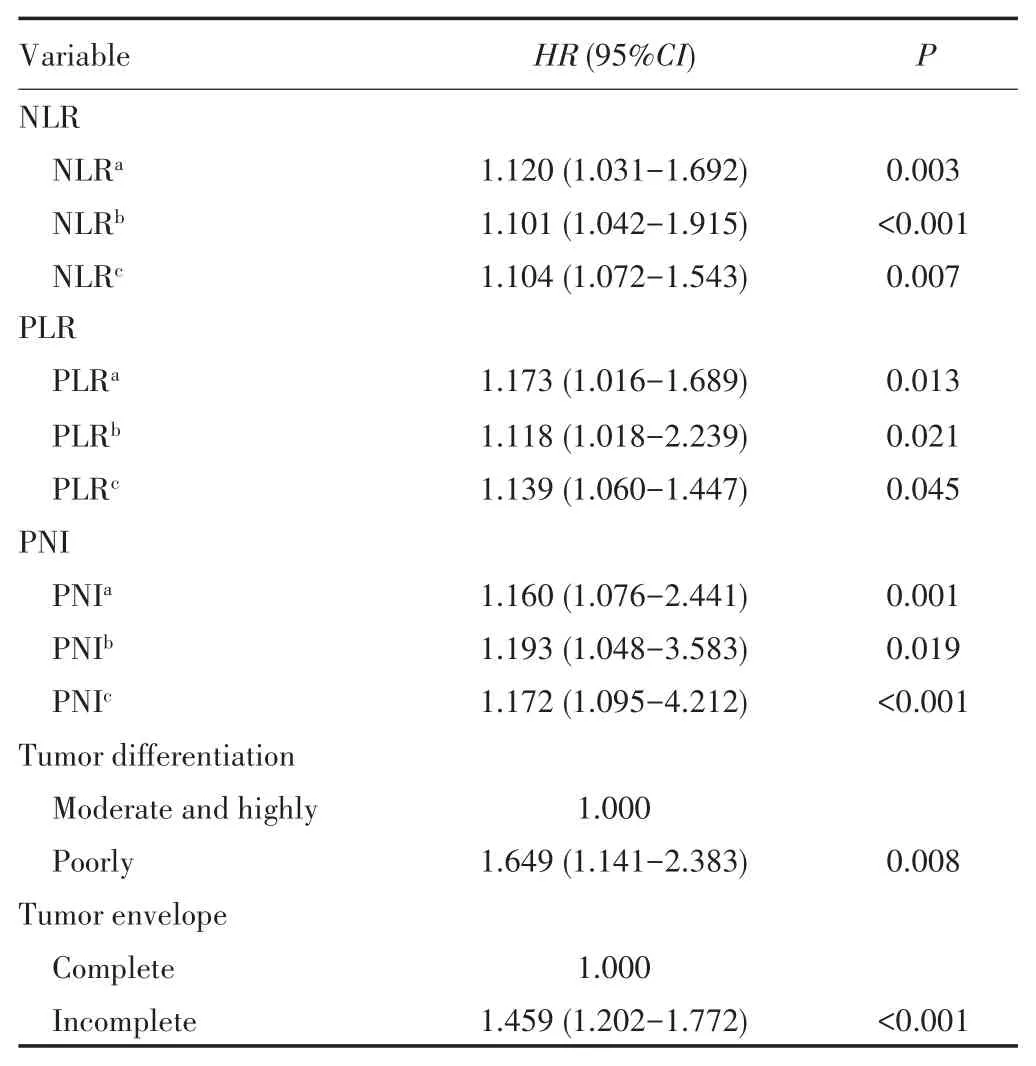
表2 影响HCC患者OS的Cox比例风险回归分析Tab.2 Cox proportional hazards regression analysis for OS
2.3 NLR、PLR、PNI评估HCC患者预后的价值
本研究首先采用NLR、PLR、PNI等炎症指标构建列线图模型1(图1A),然后进一步采用NLR、PLR、PNI、肿瘤分化程度以及肿瘤包膜是否完整等因素构建列线图模型2(图1B)。根据列线图可以得到每个预测指标对应的分数值,这些分数值之和被记录为总分,与总分相对应的则为1、3年总生存概率。

图1 预测HCC患者总生存率的列线图模型Fig.1 Nomogram models for predicting the overall survival rate of HCC patients
时间依赖的ROC曲线结果显示,NLR、PLR、PNI、模型1和模型2预测1年总生存率的AUC分别为0.729、0.699、0.703、0.796和0.822,见图2A;预测3年总生存率的 AUC分分别为0.698、0.617、0.677、0.748和 0.797,见图2B。Delong′s检验显示,模型 1预测1年及3年总生存率的AUC均大于NLR、PLR、PNI(均P<0.05),模型2预测1年及3年总生存率的AUC均大于NLR、PLR、PNI、模型1(均P<0.05)。
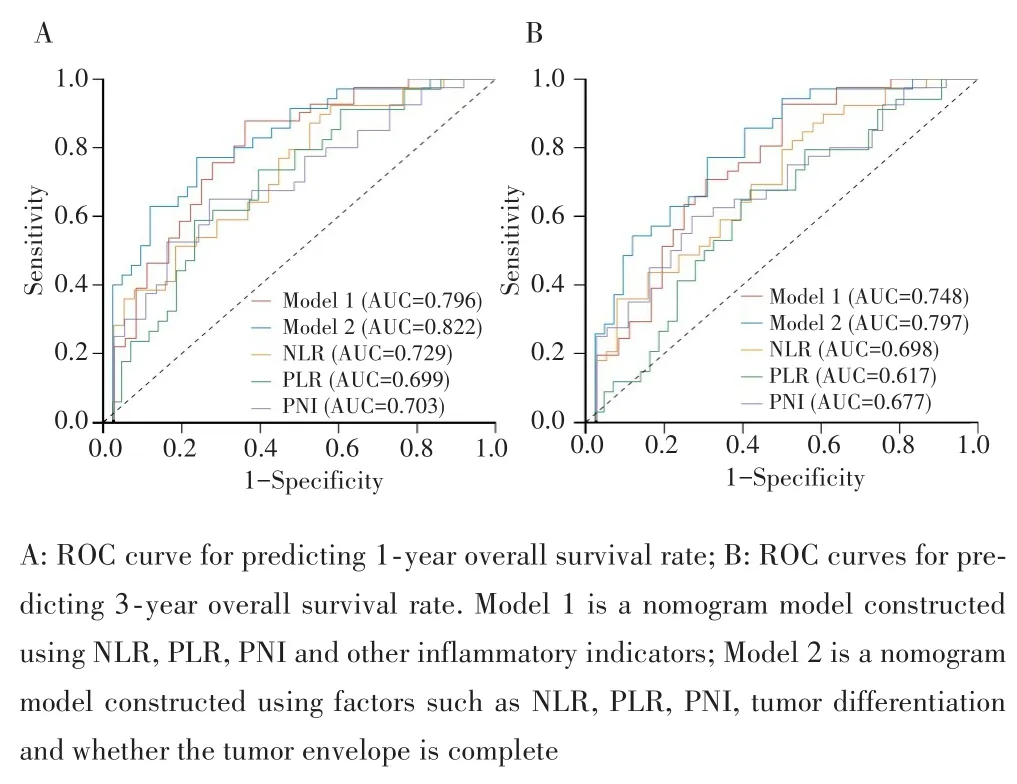
图2 时间依赖的ROC曲线评估模型的预测效能Fig.2 Time⁃dependent ROC curves to evaluate the predictive performance of model
3 讨论
BCLC分期、TNM分期等是评估肝癌患者预后常用的分期系统,但这些分期更多考虑的是肿瘤负荷等物理指标对患者预后的影响[10]。然而即使分期相同的患者,预后也往往存在较大差异,因此值得进一步探索更准确、更个体化的预后评估指标。肝癌是炎症相关性疾病,炎症也在肝癌的发生、侵袭、转移等过程中发挥重要作用[11]。既往多项研究[4⁃6]也已表明NLR、PLR和PNI是HCC患者的预后因素,但患者术前炎症指标的截断值存在较大差异,可能与计算截断值的统计学方法有关。将连续资料离散化忽略了连续性变化与HCC患者死亡风险关联强度的变化轨迹,不仅可能损失信息量,还会导致统计效能低下,最终得到不准确的结果[11⁃12]。因此,本研究采用限制性立方样条,分析连续变量NLR、PLR和PNI与HCC患者预后的关联性,结果发现NLR、PLR和PNI均与HCC患者的死亡风险呈线性关系,多因素Cox比例风险回归亦发现NLR、PLR和PNI是影响预后的因素。
中性粒细胞可促进肿瘤发生发展和免疫逃逸等[13],而淋巴细胞具有抗肿瘤作用[14]。血小板通过激活内皮细胞和募集白细胞影响肿瘤的炎症反应,进而促进肿瘤转移[15]。NLR升高能导致淋巴细胞相对降低和中性粒细胞相对升高,PLR升高提示血小板相对升高和淋巴细胞相对减少,可见PLR及NLR是反映系统性炎症平衡的指标。营养状态也是影响预后的重要因素。ALB产生于肝脏,是反映营养状态的常用指标,同时也与炎症相关[16]。PNI是基于ALB和淋巴细胞的综合指标,可反映患者的营养和免疫状态。本研究结果发现NLR、PLR和PNI均可预测HCC患者预后,但AUC均较低,提示单一的炎症指标预测效能较低。故本研究采用限制性立方样条和列线图基于Cox比例风险回归将NLR、PLR、PNI等3个炎症指标联合预测患者的预后,结果显示联合指标的AUC均高于单一指标,进一步将炎症指标与影响预后的因素肿瘤分化程度及肿瘤包膜是否完整联合预测患者预后,其效能进一步提高。
本研究采用限制性立方样条模型拟合两者之间的剂量反应关系,避免了分组对结果产生的可能影响,保证结果可靠性。但本研究也存在以下局限性:⑴本研究为回顾性队列研究,因此无法避免回顾性偏倚以及随访依从性等造成的偏倚。⑵本研究样本量较小,预测效能尚需大样本量验证。⑶肿瘤数目、BCLC分期、Child⁃Pugh等常见的预后因素在本研究中未显示预后价值,也考虑与样本量较小有关。⑷本研究缺少外部验证,这可能限制了模型的外推性,因此后期仍需多中心研究进行验证。
综上所述,本研究发现术前NLR、PLR、PNI与HCC肝切除术患者的OS有关联,且这种关系呈线性关系。NLR、PLR、PNI等炎症指标构建的列线图模型可准确预测HCC肝切除术患者1年、3年总生存率,联合临床因素可提高预测效能。但鉴于本研究仍存在前文所述局限性,因此相关结论仍需后续开展前瞻性、多中心研究进行验证。
