糖皮质激素对视神经脱髓鞘大鼠S1PR1、S1PR3表达及视觉功能的影响①
2021-11-25王继光衡水市人民医院神经内二科衡水053000
王 智 李 静 王继光 高 倩 魏 琰 (衡水市人民医院神经内二科,衡水053000)
视神经脊髓炎(neuromyelitis optica,NMO)为脊髓和视神经相继或同时损伤的一种中枢神经系统自身免疫性疾病,疾病早期多表现为视神经脱髓鞘等病变,患者多伴随视力变差、意识障碍、眼球颤动等,严重可导致失明,若受损神经持续缺血变性可进展为多发性硬化症(multiple sclerosis,MS),威胁患者生命[1-2]。糖皮质激素具有免疫抑制和抵抗炎症等功能,为临床治疗NMO等自身免疫性疾病的首选药物,国内外研究发现,高剂量糖皮质激素冲击疗法可有效改善NMO患者临床症状,但作用机制尚未阐明[3-4]。既往研究认为,NMO与机体免疫失调相关,但免疫失调如何导致神经病变尚未明确。近年研究发现,1-磷酸鞘氨醇(sphingosine 1-phosphate,S1P)可结合其受体(S1P receptor,S1PR),激活的S1P-S1PR 信号系统在淋巴细胞转运和维持血管完整性方面发挥重要作用,从而参与复杂炎症过程调节[5]。另有研究发现,星形胶质细胞(astrocytes,AST)表面 S1PR1、S1PR3 与 S1P 结合是其激活的关键,而 NMO 发病与 AST 细胞激活密切相关[6-7]。本研究推测S1PR1、S1PR3 可能是NMO 所致视神经脱髓鞘的治疗靶标,通过建立NMO视神经脱髓鞘大鼠模型,观察糖皮质激素对NMO大鼠视神经脱髓鞘及视觉功能的改善作用,并分析其对视神经组织S1PR1、S1PR3 蛋白表达的影响,以初步探究其治疗NMO的作用机制。
1 材料与方法
1.1 材料
1.1.1 实验动物 6 周龄雄性健康SD 大鼠45 只,体重(220±5)g,许可证号:SCXK(粤)2018-0002,购自广东省医学实验动物中心,常规饲养于我院动物房,实验设计经我院动物伦理委员会批准,遵守动物保护3R原则。
1.1.2 主要试剂及仪器 注射用甲泼尼龙琥珀酸钠(40 mg/支)购自常州四药制药有限公司;S1PR1、S1PR3、β-actin、钙结合适配器分子1(Iba-1)、胶质纤维酸性蛋白(GFAP)、POU 4级同源框1(POU4F1,又称Brn3a)、巨噬细胞标记物ED-1 兔源抗体(货号:ab77076、ab108370、ab8227、ab178847、ab4674、ab273099、ab31630)、驴抗兔IgG Alexa Fluor®647 抗体(货号:ab150075)、羊抗兔IgG Alexa Fluor®488 抗体、DAPI 溶液(货号:ab150077、ab104139)购自美国Abcam 公司;Tunel细胞凋亡绿色荧光试剂盒(货号:C1088)购自上海碧云天有限公司;透射电子显微镜(型号:109T)购自美国Carl Zeiss Microscopy 公司;荧光显微镜(型号:BX50)、光学显微镜(型号:BX63)购自日本奥林巴斯公司。
1.2 方法
1.2.1 模型制备及分组 参照文献[8-9]并稍加改动,采用视神经鞘内注射人NMO-IgG(1 μl,20 mg/μl)法制备NMO大鼠,即为视神经脱髓鞘大鼠,术后14 d瞳孔收缩度明显降低表明模型制备成功。造模过程中3 只大鼠未观察到瞳孔收缩度明显改变,共造模成功42 只,随机分为:NMO 组、糖皮质激素组,每组14 只,另取14 只健康大鼠作为对照组。造模成功后14 d,糖皮质激素组大鼠尾静脉输注0.5 g/ml甲泼尼龙溶液(生理盐水溶解),0.1 m/lmin,60 min,1 次/d,对照组、NMO 组输注等量生理盐水,连续给药3 d。
1.2.2 视动实验及瞳孔反射实验评估大鼠视觉功能 末次给药后12 h,随机取10 只大鼠,参考WANG 等[10]方法进行视动实验,将大鼠放在四面各有1台显示器的平台上,黑暗环境中进行测试,显示器上显示垂直正弦波光栅(100%对比度),空间频率依次为0.05、0.1、0.2、0.3、0.4、0.5 和0.6 周/度(cpd),恒定速度为12 度/s。红外敏感相机监测头部运动图像,大鼠头部无明显跟踪运动时的最高空间频率即为大鼠视锐度值。瞳孔反射实验参考FERNANDEZ 等[11]方法,将大鼠置于黑暗中,采用高强度光刺激瞳孔30 s,红外敏感相机采集眼睛瞳孔图像(30帧/s),瞳孔收缩度(%)=(刺激前瞳孔直径-刺激后瞳孔直径)/刺激前瞳孔直径×100%。
1.2.3 大鼠视网膜及视神经组织样本采集及HE染色观察 1.2.2 结束后,100 mg/kg 戊巴比妥钠腹腔注射麻醉处死大鼠,各组随机取11 只,于眼科显微镜下取眼球(保留较长视神经),分离视网膜和视神经,含4%甲醛的PBS固定,制备石蜡切片(5 μm),部分切片采用HE 试剂盒染色,选取较完整切片置于光学显微镜下观察视网膜及视神经,剩余切片用于Tunel、免疫荧光及免疫组化实验;-80℃保存备用的视神经用于提取RNA 和蛋白。各组剩余3 只大鼠取眼球(保留较长视神经)后,分离视神经,含2%戊二醛和4%甲醛的PBS 中固定,制备超薄切片(70 nm)用于电镜观察。
1.2.4 透射电镜检测大鼠视神经脱髓鞘情况 取1.2.3 中超薄切片,70%乙醇溶液(含2%乙酸铀酯)和柠檬酸铅溶液染色,铜网固定,透射电镜下观察。
1.2.5 Tunel 法检测视网膜RGC 细胞凋亡情况 取1.2.3中视网膜石蜡切片,按照Tunel试剂盒说明书依次处理切片,采用Brn3a 标记凋亡视网膜神经节细胞(retinal ganglion cell,RGC),DAPI 复染,荧光显微镜下观察,计算凋亡RGC 细胞比例。其中Brn3a 阳性(红色荧光)为RGC 细胞;Tunel 阳性(绿色)为凋亡细胞;DAPI 阳性(蓝色)为细胞核,Merge中呈黄色为凋亡RGC 细胞,每组10 片视网膜,每片视网膜取5个视野计算平均值。
1.2.6 免疫荧光法观察视神经中巨噬细胞、小胶质细胞和AST 细胞 取1.2.3 中视神经石蜡切片,脱蜡,柠檬酸盐缓冲液修复抗原,固定,含0.1%Triton X-100 PBS 溶液通透,2%山羊血清封闭,分别加入 Iba-1、GFAP 及 ED1 一抗 4℃ 孵育过夜,洗片,加入荧光标记二抗室温避光孵育50 min,洗片,加入DAPI室温避光孵育5 min,含抗荧光猝灭剂封片,荧光显微镜下拍照并用ImagePro Plus 分析荧光强度,ED1 阳性(绿色荧光)为巨噬细胞;Iba1 阳性(红色)为小胶质细胞;GFAP 阳性(红色)为AST 细胞,每组10根视神经,每根取5个视野计算平均值。
1.2.7 免疫组化法检测视神经中S1PR1、S1PR3、IL-17 表达 取1.2.3 中视神经石蜡切片,脱蜡,柠檬酸盐缓冲液修复抗原,过氧化氢封闭,加入S1PR1、S1PR3及IL-17一抗室温孵育1.5 h,洗片,加入HRP 标记二抗室温避光孵育30 min,洗片,加入DAB 混合液室温避光孵育5 min,苏木精复染,光学显微镜拍照。
1.2.8 RT-qPCR 和Western blot 法检测视神经中S1PR1、S1PR3 mRNA 和蛋白表达 取 1.2.3 中视神经冷冻样品,液氮研磨,提取RNA 和蛋白。RNA 经反转录后作为RT-qPCR 反应模板,以β-actin 作为内参进行RT-qPCR 扩增反应,检测S1PR1、S1PR3 mRNA 表达,引物序列见表1。各组蛋白样品采用BCA 法测定浓度,分别取15 g 上样,依次进行SDS-聚丙烯酰胺凝胶电泳、转印记、5%牛奶封闭,加入一抗 S1PR1、S1PR3 和 β-actin 抗体 4℃ 孵育过夜,加入二抗室温孵育1.5 h,增强化学发光液显影,TANON成像系统拍照并分析条带灰度。
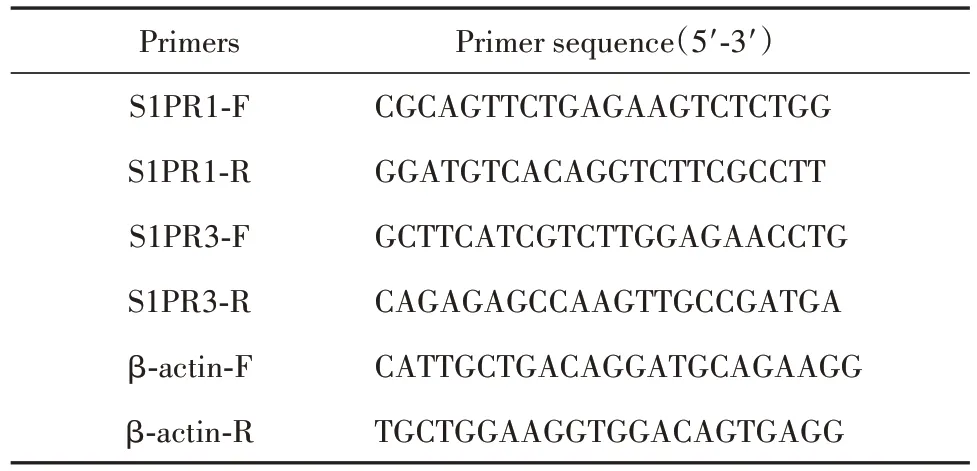
表1 引物序列Tab.1 Primer sequences
1.3 统计学分析 采用SPSS25.00 软件进行统计学分析,计量数据采用表示,多组间比较采用单因素方差分析,进一步比较采用SNK-q检验。P<0.05表示差异有统计学意义。
2 结果
2.1 糖皮质激素对NMO大鼠视觉功能的影响 与对照组相比,NMO 组及糖皮质激素组大鼠视锐度、瞳孔收缩度降低(P<0.05);与NMO 组相比,糖皮质激素组大鼠视锐度、瞳孔收缩度增高(P<0.05,表2)。
表2 3组大鼠视锐度、瞳孔收缩度比较(,n=10)Tab.2 Comparison of visual acuity and pupil contraction of rats in three groups(,n=10)
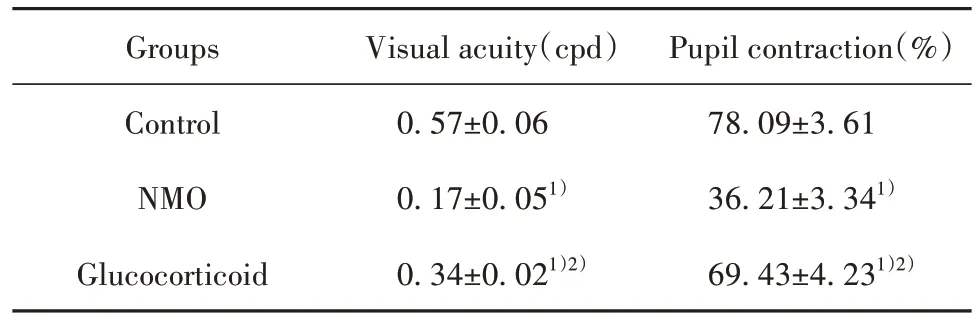
表2 3组大鼠视锐度、瞳孔收缩度比较(,n=10)Tab.2 Comparison of visual acuity and pupil contraction of rats in three groups(,n=10)
Note:1)P<0.05 vs Control;2)P<0.05 vs NMO.
Pupil contraction(%)78.09±3.61 36.21±3.341)69.43±4.231)2)Groups Control NMO Glucocorticoid Visual acuity(cpd)0.57±0.06 0.17±0.051)0.34±0.021)2)
2.2 糖皮质激素对NMO大鼠视神经组织的影响 对照组大鼠视神经结构正常,轴索纤维及神经元均匀着色,排列整齐;NMO 组大鼠视神经可见神经元体积变大、排列混乱、核染色较深,轴索纤维中呈空泡及炎症细胞浸润病变;糖皮质激素组上述病变明显缓解,形态接近对照组(图1)。
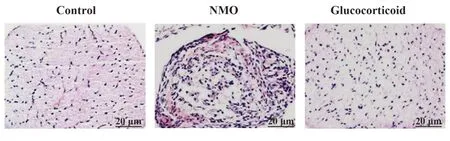
图1 大鼠视神经组织HE染色(×400)Fig.1 HE staining of optic nerve tissue in rats(×400)
2.3 糖皮质激素对NMO大鼠视神经脱髓鞘程度的影响 对照组大鼠视神经髓鞘结构正常,均可见黑色髓鞘;NMO 组大鼠大部分视神经可见轴突退化、脱髓鞘、板层小体等病变;糖皮质激素组脱髓鞘程度明显减轻,形态接近对照组(图2)。

图2 大鼠视神经组织透射电镜图(×100 000)Fig.2 Transmission electron microscope of optic nerve tis⁃sue in rats(×100 000)
2.4 糖皮质激素对NMO大鼠视网膜形态及细胞凋亡的影响 对照组大鼠视网膜结构正常,凋亡RGC细胞较少;相较于对照组,NMO 组、糖皮质激素组大鼠视网膜厚度降低,RGC 细胞数减少,凋亡RGC 细胞比例增高(P<0.05);相较于NMO 组,糖皮质激素组视网膜厚度升高,RGC 细胞数增多,凋亡RGC 细胞比例降低(P<0.05,图3、表3)。
表3 大鼠视网膜厚度、RGC细胞数及凋亡RGC细胞比例比较(,n=10)Tab.3 Comparison of retinal thickness,number of RGC cells and proportion of apoptotic RGC cells of rats(,n=10)

表3 大鼠视网膜厚度、RGC细胞数及凋亡RGC细胞比例比较(,n=10)Tab.3 Comparison of retinal thickness,number of RGC cells and proportion of apoptotic RGC cells of rats(,n=10)
Note:1)P<0.05 vs Control;2)P<0.05 vs NMO.
Proportion of apoptotic RGC cells(%)3.05±0.95 37.50±3.341)19.35±1.961)2)Groups Control NMO Glucocorticoid Retinal thickness(μm)263.11±7.51 159.23±6.951)196.67±8.021)2)RGC cells number(individual)91.05±6.15 45.75±4.331)71.15±4.921)2)
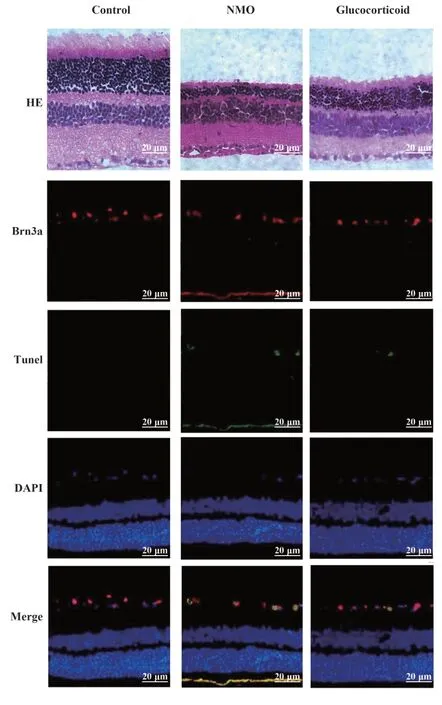
图3 大鼠视网膜HE染色及Tunel检测(×400)Fig.3 HE staining and Tunel examination of rat retina(×400)
2.5 糖皮质激素对NMO 大鼠视神经巨噬细胞、小胶质细胞和AST 细胞的影响 相较于对照组,NMO组、糖皮质激素组大鼠视神经巨噬细胞、小胶质细胞和AST 细胞增多(P<0.05);相较于NMO 组,糖皮质激素组视神经巨噬细胞、小胶质细胞和AST 细胞减少(P<0.05,图4、表4)。
表4 3 组大鼠视神经中巨噬细胞、小胶质细胞和AST 细胞比例比较(,n=10)Tab.4 Comparison of proportions of macrophages,mi⁃croglia and AST cells in optic nerve of rats in three groups(,n=10)

表4 3 组大鼠视神经中巨噬细胞、小胶质细胞和AST 细胞比例比较(,n=10)Tab.4 Comparison of proportions of macrophages,mi⁃croglia and AST cells in optic nerve of rats in three groups(,n=10)
Note:1)P<0.05 vs Control;2)P<0.05 vs NMO.
Groups Control NMO Glucocorticoid ED1+region 0.00±0.00 12 752.42±296.481)Iba1+region 3 091.05±126.15 10 745.75±144.321)GFAP+region 9 823.05±150.72 19 643.50±183.391)5 194.67±108.021)2)5 671.15±114.811)2)11 079.35±1.751)2)
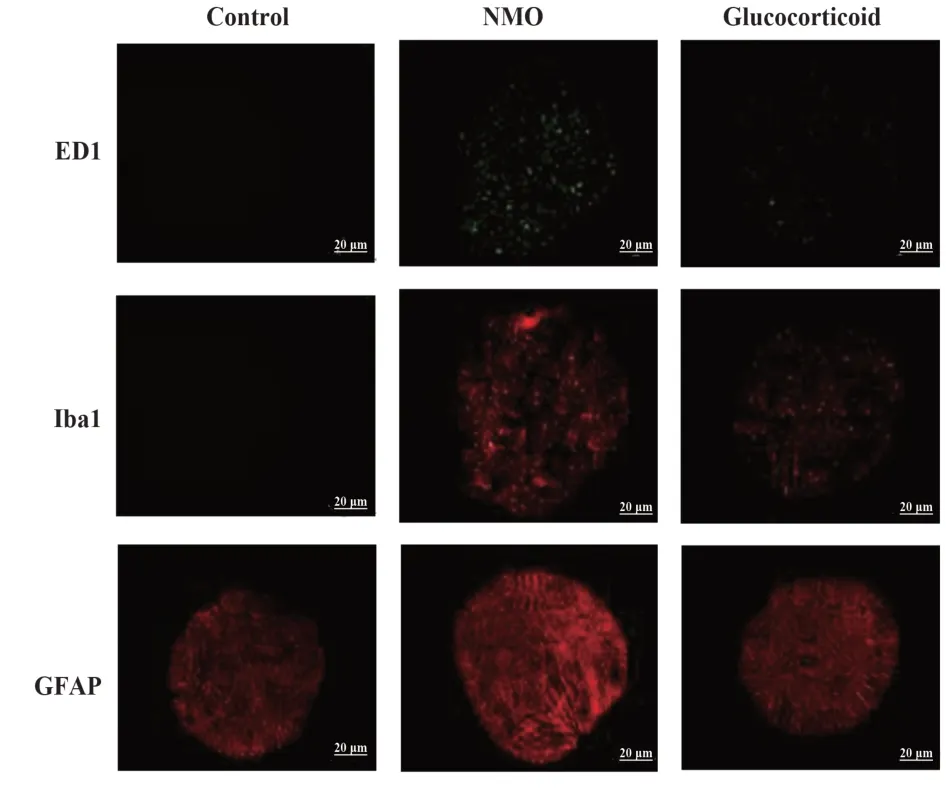
图4 大鼠视神经组织免疫荧光图(×400)Fig.4 Immunofluorescence of rat optic nerve tissue(×400)
2.6 糖皮质激素对NMO 大鼠视神经中S1PR1、S1PR3、IL-17表达的影响 相较于对照组,NMO 组、糖皮质激素组大鼠视神经中S1PR1、S1PR3、IL-17表达增多(P<0.05);相较于NMO 组,糖皮质激素组视神经中 S1PR1、S1PR3、IL-17 表达减少(P<0.05,图5)。
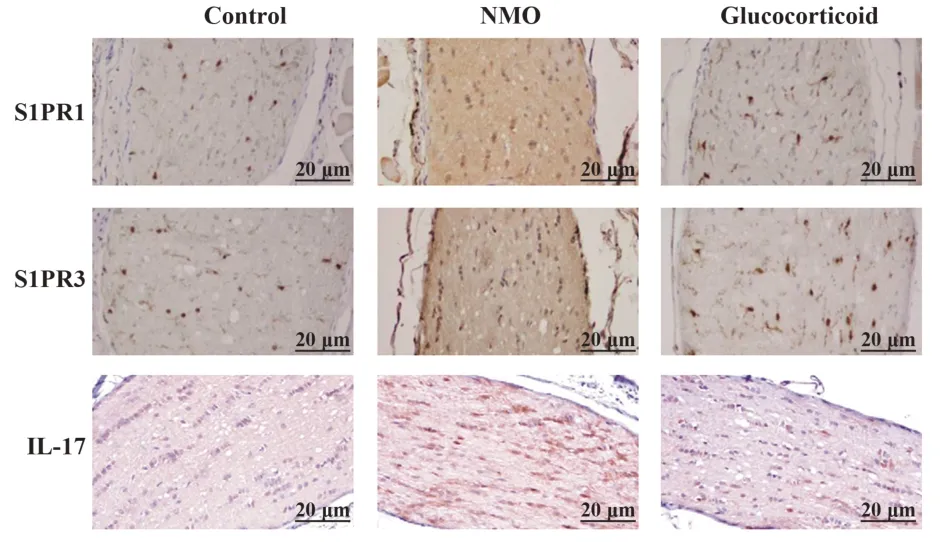
图5 大鼠视神经组织免疫组化图(×400)Fig.5 Immunohistochemistry of optic nerve tissue in rats(×400)
2.7 糖皮质激素对NMO 大鼠视神经中S1PR1、S1PR3 mRNA 及蛋白表达的影响 相较于对照组,NMO 组、糖皮质激素组大鼠视神经中S1PR1、S1PR3 mRNA 及蛋白表达增多(P<0.05);相较于NMO 组,糖皮质激素组视神经中S1PR1、S1PR3 mRNA及蛋白表达减少(P<0.05,图6、表5)。
表5 3 组大鼠视神经中S1PR1、S1PR3 mRNA 及蛋白表达比较(,n=10)Tab.5 Comparison of mRNA and protein expression levels of S1PR1,S1PR3 in optic nerve of rats in three groups(,n=10)
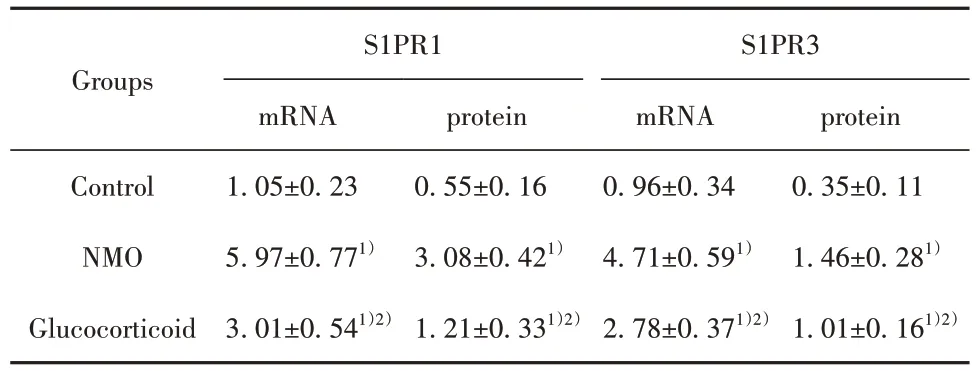
表5 3 组大鼠视神经中S1PR1、S1PR3 mRNA 及蛋白表达比较(,n=10)Tab.5 Comparison of mRNA and protein expression levels of S1PR1,S1PR3 in optic nerve of rats in three groups(,n=10)
Note:1)P<0.05 vs Control;2)P<0.05 vs NMO.
Groups protein 0.35±0.11 1.46±0.281)1.01±0.161)2)S1PR1 mRNA 1.05±0.23 5.97±0.771)3.01±0.541)2)Control NMO Glucocorticoid protein 0.55±0.16 3.08±0.421)1.21±0.331)2)S1PR3 mRNA 0.96±0.34 4.71±0.591)2.78±0.371)2)
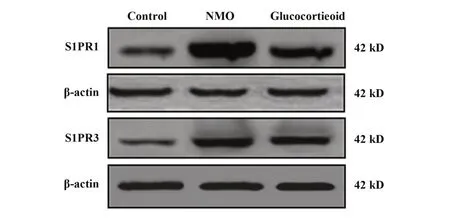
图6 Western blot检测大鼠视神经中S1PR1、S1PR3表达Fig.6 Western blot of S1PR1 and S1PR3 expressions in optic nerve of rats
3 讨论
多数NMO 患者均检测到血清自身抗体NMO 免疫球蛋白G(NMO-IgG)存在,为揭示NMO 发病机制提供了方向。由于NMO-IgG 与NMO 的相关性,NMO-IgG 被动转移已被用于建立NMO 啮齿动物模型[12-13]。大鼠视神经鞘内注射人NMO-IgG 建立的NMO 模型可直接反映视神经病变对视觉功能的影响,有利于评估药物对视神经病变的治疗作用[8-9]。本研究发现,相较于对照组,NMO 组大鼠视锐度、瞳孔收缩度降低,视神经现脱髓鞘、神经元体积变大、排列混乱、轴突退化、巨噬细胞、小胶质细胞和AST细胞增多等病变,视网膜厚度及RGC 细胞数减少,凋亡RGC 细胞比例增高,表明视神经注射NMO-IgG可成功诱导NMO 病变,引起视神经脱髓鞘、小胶质细胞/巨噬细胞活化、胶质增生、视觉功能变差,提示模型制备成功。随着对NMO 发病机制研究的深入,对其治疗药物的研发也逐渐增多,对现有药物治疗机制的挖掘可能为寻找新药物提供思路。临床研究发现,高剂量(500 mg/d)糖皮质激素可加速急性期 MS 或 NMO 患者康复,减轻视神经炎症[14]。本研究发现,输注糖皮质激素后,大鼠视锐度、瞳孔收缩度均增高,视神经脱髓鞘、神经元体积变大、巨噬细胞、小胶质细胞和AST 细胞增多等病变减轻,视网膜厚度及RGC细胞数增加,凋亡RGC细胞比例降低,表明糖皮质激素可减轻视神经脱髓鞘程度,抑制小胶质细胞/巨噬细胞活化及胶质增生,改善NMO大鼠视觉功能。
S1P-S1PR 信号系统可启动AST 细胞活化,与神经组织中炎症密切相关,其中S1PR1、S1PR3 为S1PR 家族中与MS 等自身免疫病相关的2 种受体,除可通过激活AST 细胞活化、诱导胶质增生外,还可促进神经细胞中小胶质细胞/巨噬细胞活化,诱导IL-17 等炎症介质释放,加速神经损伤[15]。研究发现,S1P-S1PR 信号系统可引起脑组织等中枢神经系统反应性胶质增生,促进炎症反应,与MS 等疾病相关[16-17]。研究报道,MS 与 AST 细胞 S1PR3 高表达有关,细胞实验亦发现,上调S1PR3,激活S1P-S1PR信号系统可促进AST 细胞激活、胶质增生及炎症反应[18-19]。由于 NMO 和 MS 具有广泛相似的症状,且均为免疫介导的神经退行性疾病,可能具有潜在分子机制,本研究对此进行初步探究,结果与MS 一致,相较于对照组,NMO 组及糖皮质激素组大鼠视神经中 S1PR1、S1PR3 及 IL-17 蛋白表达均增高,表明NMO 所致视神经脱髓鞘大鼠视神经组织中S1P-S1PR 系统被激活,且下游IL-17 等炎症因子水平升高。研究发现,小檗碱可通过降低S1P 水平抑制S1P 与S1PR 结合,降低炎症水平,改善MS 小鼠神经功能缺失,减轻脱髓鞘等病变[20-21]。TSAI 等[22]进一步证实,S1PR1 在中枢神经系统自身免疫和神经炎症中起重要作用。本研究发现,给予糖皮质激素治疗后,大鼠视神经中 S1PR1、S1PR3 及 IL-17 蛋白表达降低,推测糖皮质激素对NMO所致视神经脱髓鞘大鼠视觉功能的改善作用可能与抑制S1PR1、S1PR3 表达,降低视神经炎症水平有关,S1PR1、S1PR3 表达降低可阻断S1P-S1PR 信号系统,进而抑制视神经中AST 细胞及小胶质细胞/巨噬细胞激活,减轻视神经炎症,具体机制有待进一步研究。
综上所述,高剂量糖皮质激素可降低视神经中S1PR1、S1PR3 蛋白表达,抑制 IL-17 等释放,降低视神经中炎症细胞比例,改善NMO所致视神经脱髓鞘大鼠视觉功能,可能为寻找治疗NMO的新药物提供参考。另外,高剂量糖皮质激素可能引起心动过速、代谢紊乱、电解质失调等副作用,治疗时应密切关注患者生命体征,以确保治疗效果。
