硫化氢对过氧化氢损伤的内皮细胞eNOS和NO表达的影响①
2021-11-25张海波李平平宋志明河南大学第一附属医院开封475001
张海波 焦 洁 李平平 宋志明 (河南大学第一附属医院,开封 475001)
冠状动脉硬化性心脏病(冠心病)是威胁人类健康的主要疾病。尤其随着人口老龄化及城镇化进程的加速,心血管病危险因素明显增多,导致冠心病的发病人数持续增加。据最新发布的《中国心血管健康与疾病报告2019》显示,推算心血管病现患人数约3.3 亿,其中冠心病患者1 100 万,给患者家庭、社会以及国家社保带来了巨大的经济负担[1]。内皮功能障碍为心血管疾病的始动环节,早于动脉粥样硬化形态学改变[2]。因此,寻找到针对内皮细胞损伤的干预措施将成为治疗动脉粥样硬化相关性疾病的关键点。
既往研究证实一氧化氮(NO)系统参与了内皮细胞损伤的发病,而本课题组前期研究发现硫化氢(H2S)对高糖诱导的内皮细胞损伤具有保护作用[3]。本研究旨在观察外源性H2S对H2O2诱导的内皮细胞损伤的保护作用及其对NO系统的影响。
1 材料与方法
1.1 材料 H2O2、MTT 和 NaHS(161527)购自 Sigma-Aldrich;Ⅰ型胶原酶购自Invitrogen;无血清培养基(SFM)、M199 培养基和胎牛血清(FBS)购自Gibco;内皮细胞生长因子(ECGS)购自 BD 公司;抗eNOS 抗体(9586)购自Cell Signaling Technology;抗GAPDH 抗体(10494-1-AP)购自Proteintech;小鼠Ⅱ抗(BM3895)及兔Ⅱ抗(BM3894)购自武汉博士德;细胞裂解液和蛋白定量试剂盒(BCA)购自南京凯基;预染蛋白 marker 购自 Fermentas;NO 测试试剂盒购自南京建成。
1.2 方法
1.2.1 细胞培养 本研究采用原代人脐静脉内皮细 胞(human umbilical vein endothelial cells,HUVECs),其分离培养依据既往报道进行[3]。研究所用细胞为1~3代。本研究经河南大学第一附属医院伦理委员会讨论并批准,符合Helsinki原则。
1.2.2 流式细胞检测 收取第1代内皮细胞,交由河南大学第一附属医院实验室检测细胞表面标志物CD31。
1.2.3 内皮细胞损伤模型的建立 取对数生长的细胞按1×104个/孔分别接种于6 孔培养板中,待细胞生长至60%~70%时,换用含不同浓度H2O(20、20、40、80、160 μmo/lL)的培养基,继续培养24 h 后分别进行细胞形态和活力检测。
1.2.4 H2S 对H2O2损伤细胞的干预 取对数生长的细胞按1×104个/孔分别接种于6 孔培养板中,待细胞生长至60%~70%时,换用含2%胎牛血清的DMEM 培养基饥饿细胞8 h,加入含不同浓度NaHS(0、50、100、200、500 μmo/lL)的DMEM 培养基作用1 h,添加80 μmo/lL H2O2继续培养24 h。
1.2.5 细胞活力的测定 内皮细胞接种于96孔板中,4 000 个/孔,24 h 后根据实验需要进行不同处理,每个处理因素设5个复孔。处理结束后,每孔加入20 μl 5 mg/ml MTT 培养4 h;去除培养基后,每孔加入150 μl DMSO,用锡箔纸遮盖后置于摇床上15 min 充分摇匀。最后在490 nm 处,用酶标仪读取各孔的吸光度值(A490)。
1.2.6 免疫蛋白印迹
1.2.6.1 蛋白提取和定量 细胞经过处理后,按照试剂盒说明进行蛋白的提取,大致过程如下:每孔加50 μl 细胞裂解液,冰上孵育10~20 min,细胞裂解液移入1.5 ml EP 管,13 200/rmin 4℃ 离心15 min;吸取上清,分装保存于-80℃冰箱备用。具体定量过程详见南京凯基说明书(BCA法)。
1.2.6.2 Western blot 经BCA 定量,取等量蛋白进行SDS-PAGE 电泳,转移到PVDF 膜上。5%脱脂奶粉室温封闭1 h,加入抗体,4℃过夜孵育;弃去Ⅰ抗,TBST 洗3 次,加入小鼠或兔Ⅱ抗,室温孵育1 h,TBST 洗 3 次 ECL 曝光;Quantity One 软件分析蛋白条带。
1.2.7 NO 含量测定 采用试剂盒测定细胞培养液中NO含量,操作过程严格按照说明书进行。
1.3 统计学处理 采用SPSS19.0统计软件进行分析,定量资料用表示,均数比较采用方差分析(One-way ANOVA),P<0.05为差异有统计学意义。
2 结果
2.1 HUVECs 鉴定 采用流式细胞仪检测,第1 代内皮细胞CD31 抗原阳性率99.9%,符合内皮细胞特性(图1)。
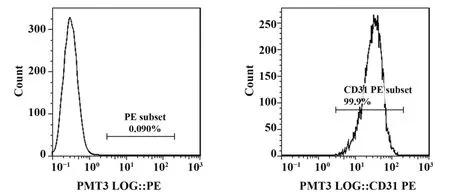
图1 流式细胞术检测细胞表面CD31Fig.1 Detection of CD31 on surfaces of cells by flow cy⁃tometry
2.2 H2O2损伤模型的建立 内皮细胞生长至60%~70%时,加入不同浓度的H2O2培养基,结果发现含20、40、80、160 μmol/L H2O2培养基加入后细胞生长缓慢,且随浓度增加,贴壁细胞数明显减少(图 2)。MTT 结果提示 80 和 160 μmol/L H2O2处理组细胞活力分别减低至(49.7±11.5)%和(18.9±9.4)%,较正常对照组差异有统计学意义(图3)。以80 μmol/L H2O2作用24 h对总体细胞数影响较小且能有效诱导细胞损伤,故作为损伤模型浓度继续应用。

图2 不同浓度H2O2处理后HUVECs细胞形态(×100)Fig.2 Representative cell morphology of HUVECs after treatment with various concentrations of H2O2(×100)
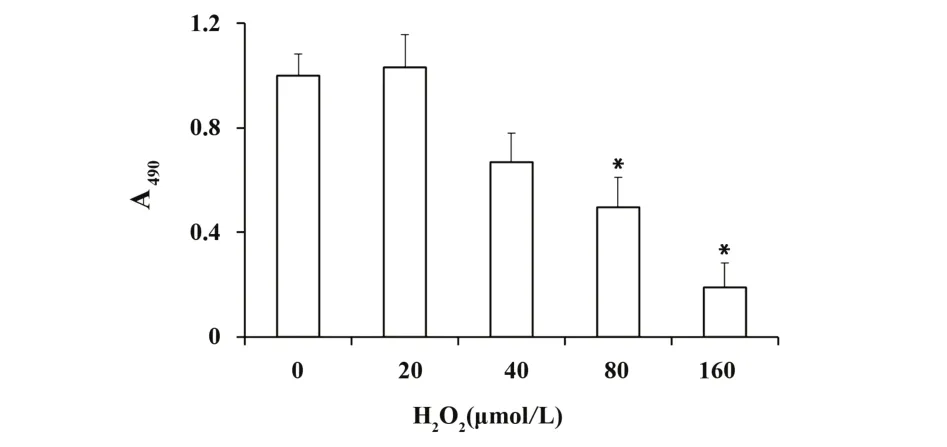
图3 不同浓度H2O2处理对HUVECs细胞活力的影响Fig.3 Cell viability of HUVECs treated with various con⁃centrations of H2O2
2.3 不同浓度NaHS 对细胞活力的影响 内皮细胞接种于 96 孔板,生长 24 h 后,分别给予 50、100、200、500 μmo/lL NaHS,继续培养 24 h 后对细胞进行 MTT 活性检测。500 μmo/lL NaHS 组细胞活力为(80.3±4.6)%,与对照组存在统计学差异。而其他浓度对内皮细胞的生长均无明显影响(图4)。为避免NaHS 自身损伤作用,后续实验选用50、100、200 μmo/lL 3个浓度对细胞进行干预。
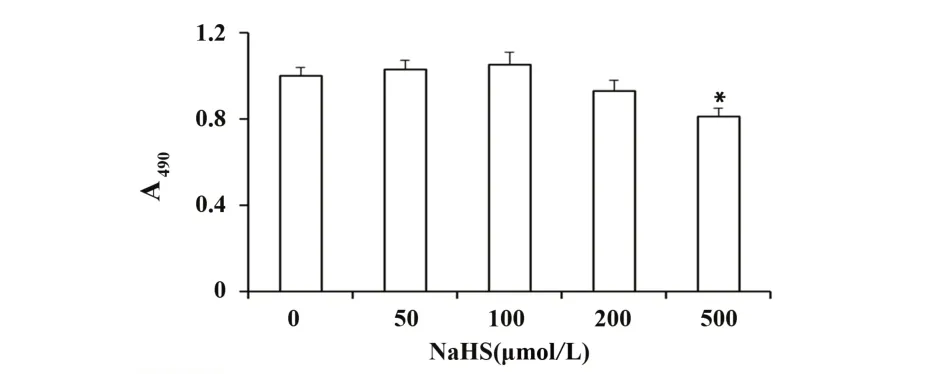
图4 不同浓度NaHS处理对HUVECs细胞活力的影响Fig.4 Effect of different concentrations of NaHS on cell viability
2.4 NaHS 对H2O2损伤细胞活力的影响 内皮细胞接种于 96 孔板,生长 24 h 后,分别给予 50、100、200 μmo/lL NaHS,共同孵育1 h 后,加入80 μmo/lL H2O2,培养 24 h。100 μmo/lL 和 200 μmo/lL NaHS组内皮细胞活力分别为(77.3±8.2)%和(70.6±7.4)%,与H2O2组比较差异均有统计学意义(图5)。
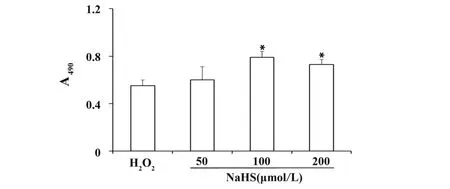
图5 NaHS对H2O2损伤HUVECs细胞活力的影响Fig.5 Effect of NaHS on cell viability in H2O2-injured HU⁃VECs
综合以上NaHS 对内皮细胞活力的影响结果,100 μmo/lL NaHS 为研究外源性H2S 对内皮细胞损伤作用的最优浓度。后续研究将以100 μmo/lL NaHS探讨其对内皮损伤的保护作用。
2.5 NaHS 对H2O2损伤的内皮细胞NO 系统的影响 通过Western blot 检测蛋白发现,与对照组相比,H2O2组细胞eNOS 蛋白的表达水平和NO 的浓度均明显降低。与H2O2组相比,NaHS 组细胞eNOS 蛋白的表达和NO的浓度均明显升高(图6)。

图6 NaHS 对 H2O2 损伤 HUVECs 细胞内 eNOS 表达及 NO浓度的影响Fig.6 Effect of NaHS on eNOS expression and NO con⁃centration in HUVECs injured by H2O2
3 讨论
本课题研究发现,80 μmol/L H2O2能够诱导原代人内皮细胞损伤模型;NaHS 部分拮抗H2O2对NO系统的影响,改善内皮细胞损伤。
内皮细胞损伤模型是阐明内皮损伤机制的重要工具[4]。目前,用于损伤模型制备的内皮细胞类型有原代培养的内皮细胞和内皮细胞株。原代内皮细胞,需分离培养且传代次数有限。内皮细胞株大多为商品化的肿瘤细胞株,如EA. hy926 和HUVEC-12。引起内皮细胞损伤的因素有多种,如H2O2、氧化型低密度脂蛋白(oxidized low density lipoprotein,ox-LDL)和细菌脂多糖(lipopolysaccharide,LPS)[5-7]。应用原代细胞诱导的疾病模型无论从临床上还是生理上都更接近人类疾病,鉴于此本研究选择了原代人脐静脉内皮细胞作为研究对象。同时H2O2来源方便、价格低廉、损伤效果明显,其诱导的内皮细胞损伤模型为目前广泛应用的研究内皮损伤的工具药物[4]。H2O2在过氧化条件下可分解成氧自由基,通过对生物膜中不饱和脂肪酸的过氧化反应引起细胞损伤,是内皮细胞损伤的理想模型[8]。综合以上因素,本研究选用了H2O2诱导的原代HUVECs损伤模型。
H2S 是继 CO 和 NO 之后在人体内发现的第 3 种内源性气体信号分子,在心血管系统稳态中发挥重要作用[9]。在哺乳动物细胞中,H2S由L-半胱氨酸在胱硫醚-β-合成酶(CBS)和胱硫醚-γ-裂解酶(CSE)的作用下合成,而在血管系统中其合成主要受CSE 调控。在高血压患者中,CSE 的表达及其合成H2S 的活性明显减低,导致了微血管内皮功能障碍[10]。XIAO 等[11]研究者发现给予 20 周 NaHS 处理能够明显改善高血压大鼠的内皮功能。此外,有研究提示H2S 通过增加 NO 生物利用度改善内皮细胞功能[12]。在本研究中,H2S 增强了H2O2损伤的内皮细胞的活力,增加了eNOS 蛋白表达,并最终增加了NO 的合成。本研究结果与既往研究结果保持一致。
本研究结果提示,H2S 改善H2O2诱导的内皮细胞损伤,这可能与其增加eNOS 表达和NO 合成有关。后续的研究将进一步阐述H2S 对于eNOS/NO具体的调控机制,以丰富和深化H2S 在内皮细胞功能乃至心血管系统中的作用和靶点。
