柴胡加龙骨牡蛎汤加减通过p38 MAPK通路改善CKD小鼠PFC突触可塑性及抑郁行为研究
2021-11-25李凡肖波飞宋敏熊维建雷蕾王开振龙梅丁伟森
李凡,肖波飞,宋敏,熊维建,雷蕾,王开振,龙梅,丁伟森
(1.重庆市中医院肾内科,重庆 400021;2.湖南省中医药研究院附属医院,湖南 长沙 410006;3.重庆医科大学第二附属医院,重庆 400010)
慢性肾脏病(Chronic kidney disease,CKD)是指由于各种原因导致肾脏结构和功能的慢性不可逆损害[1]。CKD全球患病率为8%~16%[2],我国患病率约10.8%[3]。CKD的高患病率不仅严重威胁人类健康,还给社会和经济带来沉重负担。此外,由于肾小球滤过率降低导致的代谢紊乱和毒素蓄积,还常继发其他脏器或系统损害,这些并发症又进一步促进了肾脏病病情进展。因此,CKD的治疗目标不仅是延缓肾脏损害进展,同时也包括对其并发症的控制。
神经系统是CKD常见的受累部位之一,抑郁是CKD患者,尤其是终末期患者[4]最常合并的精神症状。有研究显示,CKD患者抑郁的终生患病率可高达100%[5]。抑郁症状不仅严重影响患者生存质量,也显著增加患者的住院率、死亡率[6]。CKD患者由于存在药物代谢障碍和其他合并症,常规抗抑郁药物的治疗受到了限制。其特有的病理差异,使得在其他人群中被证明有效的干预措施,在CKD患者中疗效并不显著[7]。因此,CKD合并抑郁患者的治疗成为目前临床上具有挑战性的难题,针对CKD合并抑郁进行药物研发的需求日渐迫切。
柴胡加龙骨牡蛎汤源于张仲景的《伤寒杂病论》[8],有研究显示,柴胡加龙骨牡蛎类方可恢复慢性不可预知性应激大鼠低单胺神经递质水平,并上调脑源性神经营养因子(BDNF)表达[9],缓解束缚应激诱导的抑郁症状[10]。我们根据CKD患者临床病症特点,对原方进行加减(加川芎,去生姜、铅丹,党参易人参)组成柴胡加龙骨牡蛎汤加减(CLMD),以平肝潜阳、疏肝解郁、宁心安神为治法,在临床中用于治疗睡眠障碍和抑郁症,其安全性和有效性已被很好地证明[11]。因此,本研究拟通过CLMD治疗腺嘌呤饮食诱导的CKD模型小鼠,深入研究CLMD对CKD合并抑郁的作用及可能机制,以期为CLMD的临床运用提供研究依据。
1 材料
1.1 实验动物
SPF级3月龄雄性C57BL/6小鼠60只,购于重庆医科大学实验动物中心,许可证号:SCXK(渝)2018-0003,均饲养于重庆市中医院实验动物中心,温度(22±2)℃,相对湿度(60±5)%,小鼠自由进食进水,12 h明暗交替,实验经重庆市中医院动物伦理委员会批准,批号:2020-DWSY-LF。
1.2 实验药物
CLMD由柴胡10 g,生龙骨15 g,生牡蛎15 g,黄芩10 g,党参15 g,桂枝6 g,茯苓15 g,法半夏10 g,熟大黄6 g,大枣10 g,川芎15 g组成。所有药材均购于重庆市中医院药剂科,在水中浸泡30 min,煎煮2 h,药物浓缩后生药含量为1 g·mL-1,通过小鼠体质量计算用药体积灌胃给药。氟西汀购于礼来苏州制药有限公司,每片20 mg,用无菌生理盐水配制成1 mg·mL-1药液备用。
1.3 主要仪器与试剂
1.3.1 主要仪器 SDS凝胶电泳及转印装置(Bio-Rad公司),凝胶图像处理系统(Bio-Rad公司),CM1860冰冻切片机(Leica公司),Observer.Z1倒置荧光显微镜(Zeiss公司),BX53光学显微镜(Olympus公司),HI650离心机(湖南湘仪实验室仪器开发有限公司),XM-650T超声破碎仪(上海净信实业发展有限公司)。
1.3.2 主要试剂 一抗突触后致密蛋白95(PSD95)、突触素(SYN)、生长相关蛋白43(GAP43)、突触囊泡膜蛋白(SYP)、环磷腺苷效应元件结合蛋白(CREB)、磷酸化CREB[p-CREB(Ser133)]、BDNF、p38丝裂原活化蛋白激酶(p38 MAPK)、磷酸化p38 MAPK[p-p38 MAPK(Thr180/Tyr182)]购于美国Cell Signaling Technology公司(货号:36233s、5297s、8945s、12270s、9197s、9198s、47808s、8690s、4511s),一抗β-actin购于武汉三鹰生物技术有限公司(货号:66009-1-Ig),化学二抗羊抗鼠、羊抗兔购于美国Jackson ImmunoResearch公司(货号:115-005-003、111-005-003),AF555购于SouthernBiotech公司(货号:6441-32),DAPI、BCA试剂盒、BSA、ECL显影液购于上海碧云天生物技术有限公司(货号:C1006、P0012、ST023、P0018AM),中性树脂购于国药集团化学试剂有限公司(批号:10004160),IL-1β、IL-6、TNF-α、肌酐、尿素氮ELISA试剂盒购于南京建成生物工程研究所(货号:H002、H007、H052、C011-2-1、C013-2-1);Hito Golgi-Cox OptimStain Prekit试剂盒购于Hitobiotec公司(货号:HTKNS1125NH)。
2 方法
2.1 实验模型及分组
2.1.1 CKD模型 参照文献[12],选取50只C57BL/6小鼠给予含0.2%腺嘌呤饮食喂养。
2.1.2 实验分组 腺嘌呤饮食2周后,取尾静脉血进行肌酐、尿素氮检测:造模组肌酐为(397±50)μmol·L-1,约为正常组1.3倍,尿素氮为(26.68±4.5)mmol·L-1,约为正常组1.5倍,与现有文献报道基本一致[13-14]。将造模后小鼠随机分为模型组、氟西汀组、CLMD低剂量(CLMD-L)组、CLMD中剂量(CLMD-M)组和CLMD高剂量(CLMD-H)组,每组10只。继续嘌呤饮食喂养,根据人体用药量与小鼠体表面积换算,结合质谱分析药物原液相对于生药含量的产率,计算得出CLMD低、中、高剂量组分别给予2.36、4.725、9.45 g·kg-1·d-1CLMD灌胃,氟西汀组给予10 mg·kg-1·d-1灌胃,模型组给予生理盐水灌胃。另取10只正常饮食小鼠为对照组,给予生理盐水灌胃。灌胃6周。
2.1.3 动物处理 小鼠行为学检测结束后,每组随机取6只小鼠,麻醉后心脏取血,用于血清肌酐、尿素氮、TNF-α、IL-6、IL-1β水平的检测,随后断头取脑,右侧半脑用于组织蛋白检测,左侧半脑中随机选取3个半脑,用于Golgi-Cox染色。各组剩余4只小鼠,用于免疫荧光染色检测。
2.2 检测方法
2.2.1 强迫游泳实验 强迫游泳测试工具为透明亚克力塑料圆筒(20 cm×10 cm),水面高10 cm,温度(23±2)℃,实验开始时将小鼠放入水中,测试持续时间为6 min,视频记录整个过程,统计每只小鼠后4 min内的累积不动时间。在测试结束后,将小鼠从水中移出放回笼中。
2.2.2 糖水偏好测试 测试前训练小鼠适应含糖饮水:每笼同时放置2个水瓶,前1个24 h内,2瓶均为1%蔗糖水,随后的24 h内,1瓶盛1%蔗糖水,另1瓶为纯水。正式测试时,首先禁食禁水24 h,再予每只小鼠事先定量好的1瓶1%蔗糖水和1瓶纯水,测试期间每6 h更换水瓶位置,24 h后,取2瓶水称量,计算小鼠糖水偏好指数=糖水消耗量/总液体消耗量×100%。
2.2.3 ELISA试剂盒指标检测 小鼠用1%戊巴比妥钠腹腔麻醉后心脏取全血,静置1 h,4 000 r·min-1低温离心15 min,取上层清液,按ELISA试剂盒说明书检测血清中肌酐、尿素氮及炎性因子TNF-α、IL-6和IL-1β表达水平。
小鼠心脏取血后,迅速在冰上断头取脑,分别取右侧前额叶皮层(Prefrontal cortex,PFC)部分组织,蛋白匀浆后测蛋白浓度,配平后根据ELISA试剂盒说明书检测PFC组织中TNF-α、IL-6和IL-1β表达水平。
2.2.4 Western blot法检测蛋白表达水平 分别取小鼠右侧半脑PFC部分组织进行蛋白提取,通过BCA法计算各样品浓度,配平后按每孔20 μg上样,凝胶电泳、转膜、室温封闭2 h后按不同比例稀释一抗4 ℃过夜(p-p38 MAPK、p38 MAPK、BDNF、p-CREB、CREB和PSD95均按1∶1 000稀释,SYN按1∶2 000稀释,SYP按1∶500稀释,β-actin按1∶20 000稀释);TBST洗3次,每次5 min;二抗(羊抗兔1∶10 000,羊抗鼠1∶10 000)室温下孵育2 h;TBST洗3次,每次10 min;ECL发光液使条带可视化。使用Image Pro Plus 6.0软件测量条带灰度值后进行统计分析。
2.2.5 Golgi-Cox染色方法 按试剂盒说明书步骤,提前24 h取等量溶液1、溶液2混匀静置。每组随机取3只左侧半脑,冠状面切取PFC部分,置入混合液中14 d(初始浸泡12 h后更换1次)。随后将脑组织转移到溶液3中,4 ℃避光保存2 d(初始12 h后更换1次)。振荡切片,厚度80 μm,贴于明胶包被的载玻片。片干后,溶液4、溶液5按步骤染色,梯度酒精脱水、二甲苯透明后封片,光学显微镜采集图像并分析树突棘密度。每只小鼠取3个树突进行树突棘密度统计。
2.2.6 免疫荧光染色 小鼠用1%戊巴比妥钠腹腔注射麻醉,4%多聚甲醛灌注取脑,蔗糖梯度脱水,OCT包埋冰冻切片,取各组小鼠PFC切片进行免疫荧光染色,脑片0.5%Triton破膜40 min,5%BSA封闭1 h,一抗(p-CREB 1∶200)4 ℃过夜,PBS洗3遍,二抗(AF555 1∶500)室温下4 h,PBS洗3遍,DAPI封片,倒置荧光显微镜下拍照。每只小鼠取3个脑片进行统计。
2.3 统计方法

3 结果
3.1 CLMD对CKD小鼠抑郁行为表型的影响
强迫游泳实验结果显示:与对照组相比,模型组小鼠不动时间增加(P<0.01),给予中、高剂量CLMD干预后,小鼠不动时间显著缩短(P<0.01);与氟西汀组相比,中、高剂量组无显著性差异(P>0.05)。糖水偏好测试结果显示:与对照组相比,模型组小鼠糖水偏好指数下降(P<0.01);与模型组相比,CLMD中、高剂量组糖水偏好指数显著增加(P<0.05,P<0.01);CLMD各剂量组与氟西汀组比较,差异无统计学意义(P>0.05)。见图1。

注:与对照组比较,##P<0.01;与模型组比较,*P<0.05,**P<0.01;与氟西汀组相比,图1 CLMD对CKD小鼠抑郁状态的影响
3.2 CLMD对CKD小鼠PFC炎症状态的影响
与对照组相比,模型组小鼠PFC炎性因子TNF-α、IL-1β、IL-6水平均显著提高(P<0.01);与模型组比较,氟西汀组,CLMD中、高剂量组TNF-α、IL-1β、IL-6水平均显著下降(P<0.05,P<0.01);中药干预组与氟西汀组之间无统计学差异(P>0.05)。见图2。
3.3 CLMD对CKD小鼠p-p38 MAPK/p38 MAPK、BDNF和p-CREB/CREB蛋白表达的影响
与对照组相比,模型组小鼠PFC内p-p38 MAPK/p38 MAPK蛋白表达上调(P<0.01),BDNF、p-CREB/CREB蛋白表达下调(P<0.01);与模型组相比,给予药物干预后,小鼠PFC内p-p38 MAPK/p38 MAPK不同程度表达下调(P<0.05,P<0.01),BDNF、p-CREB/CREB蛋白表达水平上调,低剂量组无显著性差异(P>0.05),中、高剂量组及氟西汀组差异显著(P<0.01);与氟西汀组相比,CLMD中、高剂量组差异无统计学意义(P>0.05)。见图3。

注:与对照组比较,##P<0.01;与模型组比较,图2 CLMD对CKD小鼠PFC炎症状态的影响

注:与对照组比较,##P<0.01;与模型组比较,*P<0.05,**P<0.01;与氟西汀组相比,图3 各组小鼠PFC内p-p38 MAPK/p38 MAPK、BDNF、p-CREB/CREB蛋白相对表达水平比较
3.4 CLMD对CKD小鼠PFC脑区核内p-CREB表达的影响
免疫荧光结果显示:与对照组相比,模型组小鼠p-CREB表达减少(P<0.01);与模型组相比,氟西汀组,CLMD中、高剂量组PFC脑区核内p-CREB表达明显增加(P<0.05,P<0.01);与氟西汀组相比,CLMD高剂量组p-CREB表达显著升高(P<0.01)。见图4。
3.5 CLMD对CKD小鼠PFC突触相关蛋白表达的影响
Western blot检测结果显示:与对照组相比,CKD小鼠PFC内突触相关蛋白PSD95、SYN、GAP43和SYP表达下调(P<0.01);与模型组相比,给予氟西汀,中、高剂量CLMD干预后,CKD小鼠PFC内PSD95、SYN、GAP43和SYP表达明显上调(P<0.01);与氟西汀组相比,CLMD低剂量组突触蛋白表达水平仍较低,有显著性差异(P<0.01),中、高剂量组无显著性差异(P>0.05)。见图5。
3.6 CLMD对CKD小鼠PFC树突棘密度的影响
Golgi-Cox染色结果显示:与对照组相比,模型组小鼠存在树突棘丢失(P<0.01);与模型组相比,CLMD中、高剂量组,氟西汀组树突棘密度增加(P<0.01);CLMD中、高剂量组与氟西汀组比较无显著性差异(P>0.05)。见图6。

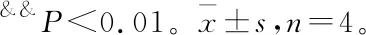



3.7 CLMD对CKD小鼠外周炎性因子水平的影响
与对照组相比,模型组小鼠TNF-α、IL-1β、IL-6水平有不同程度的增加(P<0.01);给予药物干预后,氟西汀组,CLMD中、高剂量组TNF-α、IL-1β、IL-6水平显著下降(P<0.05,P<0.01);CLMD各剂量与氟西汀组比较差异无统计学意义(P>0.05)。见图7。

3.8 CLMD对CKD小鼠肾功能的影响
与对照组相比,模型组小鼠肌酐、尿素氮水平明显增加(P<0.01);与模型组比较,CLMD中、高剂量组小鼠肌酐、尿素氮水平有所下降(P<0.05,P<0.01),氟西汀组无显著性差异(P>0.05)。见图8。

4 讨论
抑郁症状在CKD患者中十分常见,一项涉及55 982例CKD患者的大型横断面荟萃研究显示,CKD患者抑郁症状发生率为26.5%[4],是一般人群的3~4倍[15],其抗抑郁药处方率比普通人群高出近1.5倍[16]。本研究中CKD小鼠强迫游泳实验的不动时间显著高于对照组,糖水偏好指数显著低于对照组,提示CKD小鼠存在行为绝望和快感缺失表型。而给予CLMD干预后,CKD小鼠不动时间减少,糖水偏好率增加。这一效应与氟西汀干预相似,证实CLMD可以改善CKD小鼠抑郁行为表型。
炎症指标水平升高是CKD的重要病理特征[5]。炎症会弱化中枢对行为奖励的反应,使积极情绪受到抑制,从而导致抑郁行为发生[17]。抑郁症患者外周血中TNF-α、IL-6、IL-13、IL-18、IL-12等炎性因子水平明显升高[18],而抗抑郁治疗可以降低外周及中枢的炎性因子水平[19]。在腺嘌呤喂养或5/6肾切除术引起的CKD啮齿动物模型中可观察到神经炎症的激活[20-21]。本研究亦发现,腺嘌呤诱导CKD小鼠PFC炎性因子表达水平显著增加。PFC参与高级认知功能,负责调节情绪、做出判断与决策,是与抑郁症状密切相关的脑区,PFC中炎症相关趋化因子异常与抑郁患者发生自杀的机制有关[22]。一项针对CKD患者的静息态功能性磁共振成像研究发现,与非抑郁患者相比,抑郁患者表现出PFC功能连通性异常[23]。神经炎症导致的PFC功能连通性受损可能是CKD患者抑郁的原因。而CLMD干预后,可以降低CKD小鼠PFC的炎性因子水平,提示CLMD可能通过减轻CKD小鼠情绪脑区PFC炎症状态,改善其功能连通性,减轻抑郁行为表型。
有研究显示,CKD小鼠PFC中存在突触蛋白的合成障碍[23]。突触可塑性异常导致的神经环路功能连通性改变被认为是负性情绪反应的核心要素[24]。在这个过程中,MAPK是连接炎症与突触可塑性中多个信号转导途径的关键分子。炎性因子通过激活p38 MAPK途径抑制BDNF依赖的突触可塑性[25-26],BDNF表达下调会降低CREB磷酸化水平,进而影响下游突触活动响应元件的转录,造成突触可塑性受损。本研究检测了PFC中通路蛋白p-p38 MAPK/p38 MAPK、BDNF、p-CREB/CREB以及突触相关蛋白PSD95、SYN、GAP43和SYP表达水平的变化。结果显示,CKD小鼠存在p38 MAPK磷酸化激活及CREB磷酸化水平降低,同时BDNF和突触相关蛋白表达水平下调;而CLMD干预可部分逆转这一病理过程。这一结果在PFC组织切片的p-CREB免疫荧光染色和Golgi-Cox染色中也得到进一步印证。CLMD通过p38 MAPK/BDNF/CREB通路改善PFC突触可塑性,可能是其改善CKD小鼠抑郁行为表型的重要机制。
本研究还发现,6周的CLMD干预显著降低了CKD小鼠外周血清炎性因子水平,延缓了肌酐、尿素氮水平增加,其机制可能与神经-免疫通信有关[27-28],CLMD可能通过对CKD小鼠抑郁状态的控制,交互改善了全身炎症水平,从而延缓肾功能恶化。其深入的机制仍需进一步验证。
CKD属于中医“水肿”“关格”范畴,主要病机为脾肾亏虚,湿毒瘀内蕴。由于CKD患者往往心境愁郁,致枢机不利,郁热内生,进而阻碍气化,痰湿与郁火加重郁结,致患者出现心神不宁,抑郁失眠,烦躁多梦等神志症状,重者甚至萌生自杀之念。基于CKD患者肾元本虚,中运失健的体质特点,湿、痰、瘀、毒胶结的邪实特点,本团队提出“扶正袪毒,复畅枢机”治疗CKD抑郁,选用柴胡加龙骨牡蛎汤加减获得较好疗效。方中柴胡疏散少阳经中之邪,和解少阳气郁,黄芩苦寒,清少阳胆腑郁火,二药相合火郁得发,气郁得解,枢机调达通利;龙骨、牡蛎敛心安神;桂枝通阳达邪以利三焦,川芎行气活血化瘀,二者合用,气血通调;半夏辛温,燥湿化痰又可助柴胡疏通气郁;大黄泻热排浊;党参、大枣补益中焦,强健脾胃枢纽,茯苓健脾利水渗湿,兼有宁心安神之功。柴胡加龙骨牡蛎汤加减在原方基础上加川芎增活血行气之效,去生姜“助火伤阴”之嫌,去铅丹减毒,易人参为党参。党参与人参同具有补益脾肺、益气生血之功,但较人参味甘性平,作用缓和,更适宜CKD慢性疾病患者。全方补泻兼施,寒温并用,疏利少阳枢机,化痰泄浊,宁心安神。综上所述,CLMD不仅对CKD抑郁状态表现出复方的多靶点治疗效应,也在CKD这一特殊患者亚群中显示了延缓肾功能损害的保护优势,值得在临床中进一步研究和推广应用。
