不同灭菌方法对地麦活性糖中4种糖类成分及微生物的影响*
2021-11-24张建伟刘海燕邓龙飞沈婷婷乔哥娣蒋洁莹
张建伟,刘海燕,刘 瑾,邓龙飞,刘 力,沈婷婷,乔哥娣,蒋洁莹
(上海中医药大学附属曙光医院,上海 200021)
生地低聚糖和麦冬多糖组合物(以下称地麦活性糖)由生地低聚糖和麦冬多糖组成,其中生地低聚糖主要由蔗糖、棉子糖和水苏糖组成[1];麦冬多糖主要由35分子果糖和1分子葡萄糖通过化学键连接而成[2]。课题组前期药效学研究发现,生地低聚糖能显著改善慢性阻塞性肺疾病(chronic obstructive pulmonary diseases,COPD)的气道病理变化,减轻气流受阻,有效延缓和逆转COPD的发生[3];麦冬多糖能够保护心肌细胞,抑制心肌缺血造成的自由基生成增加,并清除氧自由基[4]。2020年版《中华人民共和国药典》中,地黄和麦冬均可用于内热消渴等症,而中医学认为糖尿病属于“消渴”范畴,课题组进一步研究发现地麦活性糖可以降低糖尿病患者血糖,具有良好的临床应用前景。地麦活性糖分别由生地黄和麦冬经水煎煮、除杂、膜分子截留分离等制得,制备工艺较复杂,糖是微生物的一种营养来源,在生产、储存过程中极容易被微生物污染、霉变,从而影响药品的安全性和质量控制[5]。灭菌是保证中药临床安全的有效途径。不同灭菌方法的灭菌效力与制剂种类和微生物限度标准密切相关,灭菌可影响制剂中化学成分的含量[6-7]。因此,考察不同的灭菌方法对地麦活性糖中指标成分果糖、蔗糖、棉子糖及水苏糖含量,以及微生物数量的影响,旨在为地麦活性糖和其他糖类制剂的灭菌方法提供依据。
1 仪器与材料
1.1 主要仪器 Agilent 1100型液相色谱仪(美国安捷伦科技有限公司);SEDEX75型蒸发光散射检测器(法国SEDERE公司);TG332A型微量电子分析天平(上海精密科技仪器有限公司);FA2004B型电子分析天平(上海精密科技仪器有限公司);KQ-500DB型超声波清洗器仪(昆山市超声仪器有限公司);XGL.DW型脉动真空灭菌器(山东新华医疗器械股份有限公司);60Co-γ辐照源(上海核铭辐射科技有限公司);CA-1390-1型超净工作台(上海上净净化设备有限公司)。
1.2 材料 果糖对照品(批号:100231-201606,纯度:99.7%)、蔗糖对照品(批号:111507-201704,纯度:100%)、水苏糖对照品(批号:112031-201701,纯度:90.5%)均购于中国食品药品检定研究院;棉子糖对照品(批号:19042322,纯度:99.6%)购于上海同田生物技术有限公司;蛋白胨(批号:180716)、胰酪大豆胨琼脂培养基(批号:190424)、沙氏葡萄糖琼脂培养基(批号:190529)、胰酪大豆胨液体培养基(批号:181228)、麦康凯液体培养基(批号:180619)、麦康凯琼脂培养基(批号:180420)均购自上海中科昆虫生物技术开发有限公司;生地低聚糖(批号:20180911,20190418)、麦冬多糖(批号:20180514,20180524,20180528)由上海中医药大学制剂实验室制备;乙腈(色谱纯)由上海安谱实验科技股份有限公司提供;其余试剂均为分析纯。
2 方法与结果
2.1 地麦活性糖灭菌 按照饮片生地黄-麦冬(1∶1),分别精密称取生地低聚糖(由生地黄经过水提、浓缩、HPD100大孔吸附树脂分离、截留分子量为1 000 Da和150 Da的膜分离等制得)[1]和麦冬多糖(由麦冬经过水提、浓缩、80%乙醇两次醇沉、截留分子量为10 000 Da和1 000 Da的膜分离等制得)[8],加水超声溶解,定容,配置成浓度为0.28 g/mL的地麦活性糖水溶液。
2.1.1 煮沸灭菌 分别量取地麦活性糖[麦冬多糖(批号:20180524)+生地低聚糖(批号:20180911)]水溶液于烧杯中,称质量后,加热煮沸30、60、90、120 min,放至室温,用水补质量,混匀,备用。
2.1.2 100 ℃流通蒸汽灭菌 分别量取地麦活性糖[麦冬多糖(批号:20180514)+生地低聚糖(批号:20180911)]水溶液于口服液体药用高密度聚乙烯瓶,置脉动真空灭菌器中,100 ℃流通蒸汽灭菌60、120 min,备用。
2.1.3 加防腐剂100 ℃流通蒸汽灭菌 分别量取地麦活性糖[麦冬多糖(批号:20180528)+生地低聚糖(批号:20180911)]水溶液,加入适量防腐剂,配制成苯甲酸钠(3‰)-地麦活性糖水溶液、羟苯乙酯(0.5‰)-地麦活性糖水溶液、山梨酸(2‰)-地麦活性糖水溶液、苯甲酸钠(3‰)-羟苯乙酯(0.5‰)-地麦活性糖水溶液,置脉动真空灭菌器中,100 ℃流通蒸汽灭菌30 min,备用。
2.1.4 120 ℃流通蒸汽灭菌 分别量取地麦活性糖[麦冬多糖(批号:20180524)+生地低聚糖(批号:20190418)]水溶液于灭菌锥形瓶中,置脉动真空灭菌器中,120 ℃流通蒸汽灭菌15 min,备用。
2.1.560Co-γ射线辐照灭菌 地麦活性糖[麦冬多糖(批号:20180514)+生地低聚糖(批号:20180911)]粉末分装于铝箔袋,10 kGy60Co-γ射线辐照12 h,备用。
2.2 微生物限度检查[9]参照2020年版《中华人民共和国药典》非无菌产品微生物限度检查,采用“微生物计数法”(通则1105)项下平皿法测定灭菌前后各地麦活性糖中需氧菌总数、霉菌与酵母菌总数;采用“控制菌检查法”(通则1106)项下平皿法测定样品中的大肠埃希菌,检查标准为非无菌药品微生物限度标准(通则1107),结果见表1。
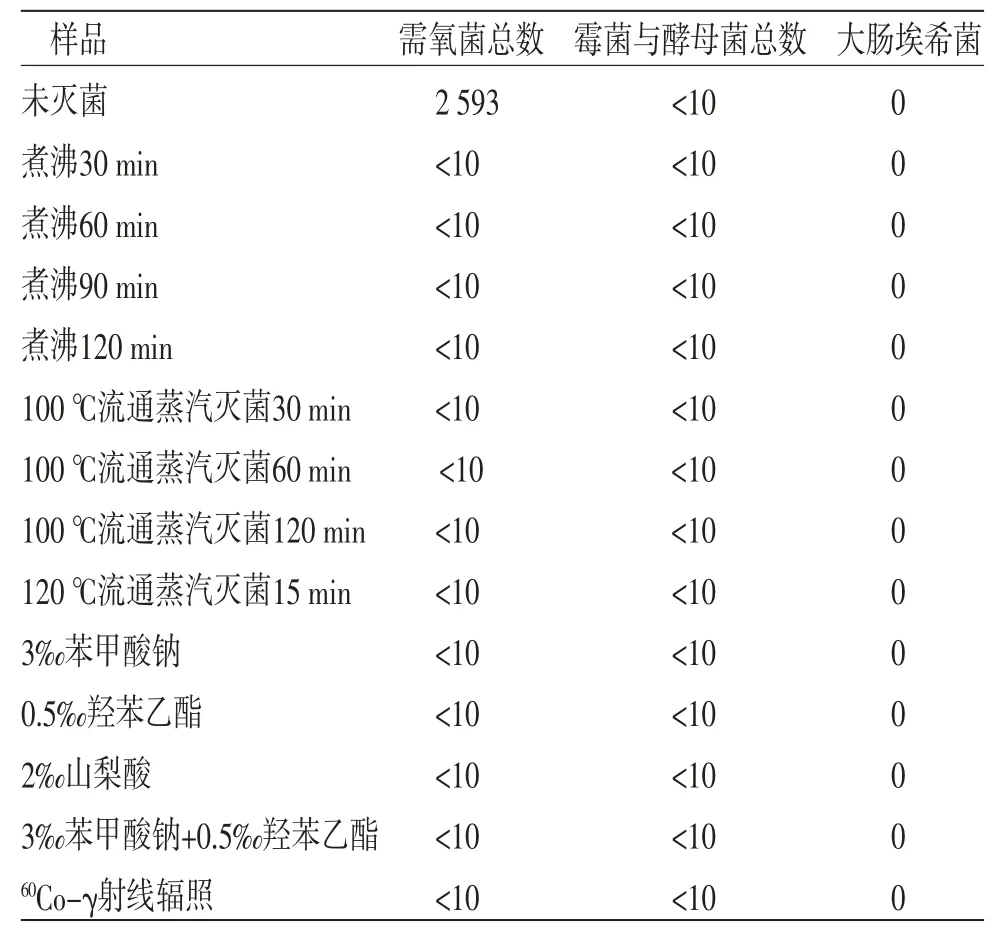
表1 灭菌对微生物限度检查结果的影响(cfu/mL)
由表1知,地麦活性糖在制备过程中未污染霉菌、酵母菌、大肠埃希菌;煮沸、100 ℃流通蒸汽、120 ℃流通蒸汽、60Co-γ射线辐照及加防腐剂后100 ℃流通蒸汽灭菌均可明显降低地麦活性糖需氧菌总数,且灭菌时间越长灭菌效力越好,进一步结合灭菌前后地麦活性糖中果糖、蔗糖、棉子糖和水苏糖的含量变化,确定最佳灭菌方法。
2.3 果糖、蔗糖、棉子糖和水苏糖含量测定
2.3.1 溶液配制
2.3.1.1 对照品溶液的制备 分别精密称取适量果糖、蔗糖、棉子糖及水苏糖对照品于2 mL容量瓶中,超声溶解后定容,摇匀,上述对照品的质量浓度分别为0.9、0.9、1.0、2.0 mg/mL。再分别量取果糖、蔗糖、棉子糖及水苏糖对照品溶液300、300、350、600 μL于2 mL容量瓶中,加水定容,摇匀,即得质量浓度分别为0.13、0.13、0.18、0.59 mg/mL果糖、蔗糖、棉子糖及水苏糖混合对照品溶液。
2.3.1.2 供试品溶液的制备 精密移取120 μL灭菌前后的地麦活性糖水溶液于10 mL容量瓶中(或精密称量0.15 g左右辐射前后的地麦活性糖于50 mL容量瓶,加适量水超声至溶解),加水定容,摇匀,过0.45 μm水性滤膜,续滤液供HPLC分析。
2.3.2 色谱条件 色谱柱:Shodex NH2P-50 4E(4.6mm×250mm,5 μm);流动相:乙腈-水;梯度洗脱(0~15 min,75%~45%乙腈;15~30 min,45%乙腈);柱温:30 ℃;流速:1.0 mL/min;蒸发光散射器检测温度:40 ℃,采集频率:3.125 Hz。以对照品质量(μg)的对数为横坐标(X),峰面积值的对数为纵坐标(Y)绘制标准曲线,经方法学考察,所建方法中果糖、蔗糖、棉子糖和水苏糖的线性范围分别为分别0.525~10.508 μg(r=0.999 3)、0.614~12.284 μg(r=0.999 2)、0.636~12.727 μg(r=0.999 4)、0.755~15.102 μg(r=0.999 3),精密度、24 h稳定性和加样回收率等均符合含量测定要求。4种对照品、地麦活性糖及麦冬多糖的色谱图见图1~3。
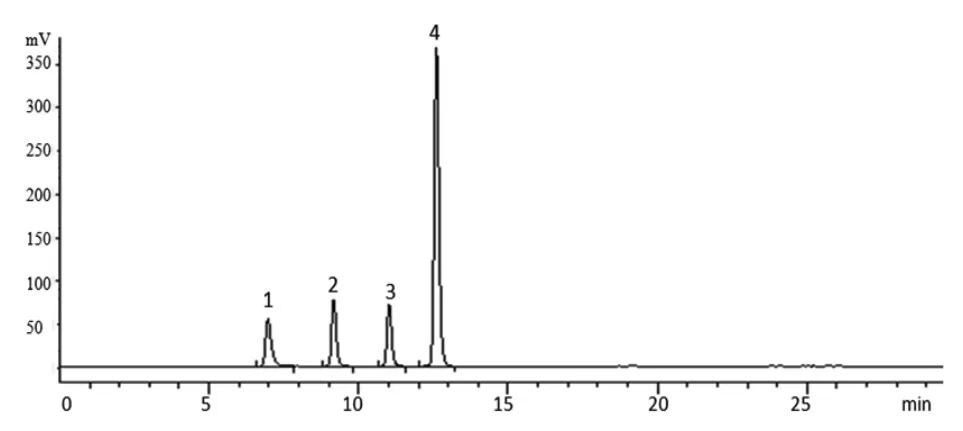
图1 果糖、蔗糖、棉子糖和水苏糖的HPLC 色谱图
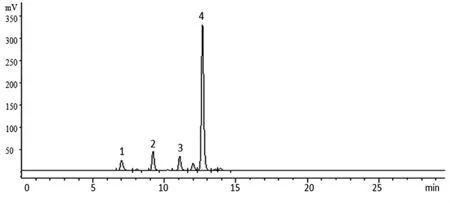
图2 地麦活性糖的HPLC 色谱图
图3 麦冬多糖的HPLC 色谱图
2.3.3 煮沸灭菌样品含量 分别精密量取加热煮沸0、30、60、90、120 min地麦活性糖溶液,按“2.3.1”项下方法制备供试品溶液,按“2.3.2”项下色谱条件分析样品,计算果糖、蔗糖、棉子糖和水苏糖含量,结果见表2。
表2 煮沸灭菌对4 种糖含量的影响(,n=3,mg/mL)
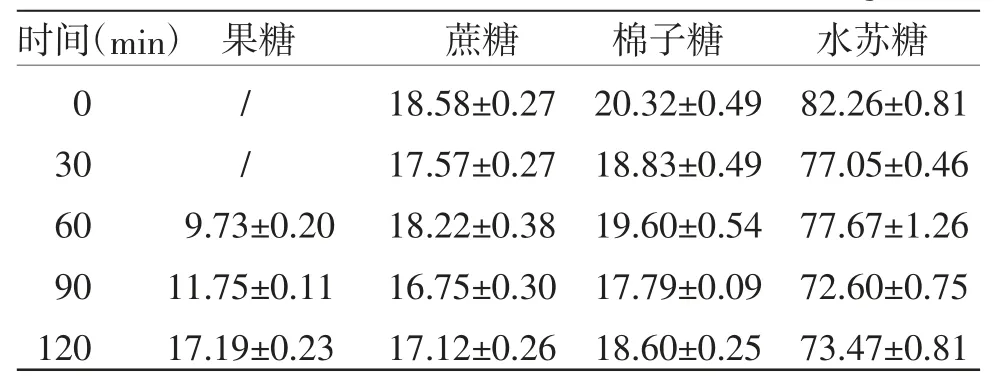
表2 煮沸灭菌对4 种糖含量的影响(,n=3,mg/mL)
注:/表示低于线性范围的最低浓度
由表2可知,与灭菌前(0 min)比较,随着煮沸灭菌时间的增加,地麦活性糖溶液颜色逐渐加深,果糖含量逐渐增加,且煮沸60 min时,果糖含量明显增加,蔗糖、棉子糖和水苏糖的含量变化均小于5.58%,说明果糖含量的增加可能由麦冬多糖分解引起。煮沸90 min时,果糖含量进一步增加,且蔗糖、棉子糖和水苏糖含量分别降低9.85%、12.45%和11.74%。结合“2.2微生物限度检查”结果,煮沸灭菌时间不长于60 min,地麦活性糖中微生物数量即符合《中华人民共和国药典》规定,地麦活性糖中果糖、蔗糖、棉子糖和水苏糖含量也无显著变化。
2.3.4 100 ℃流通蒸汽灭菌样品含量 分别精密量取100 ℃流通蒸汽灭菌0、60、120 min地麦活性糖溶液,按“2.3.1”项下方法制备供试品溶液,按“2.3.2”项下色谱条件分析样品,计算果糖、蔗糖、棉子糖和水苏糖含量,结果见表3。
表3 100 ℃流通蒸汽灭菌对4 种糖含量的影响(,n=3,mg/mL)
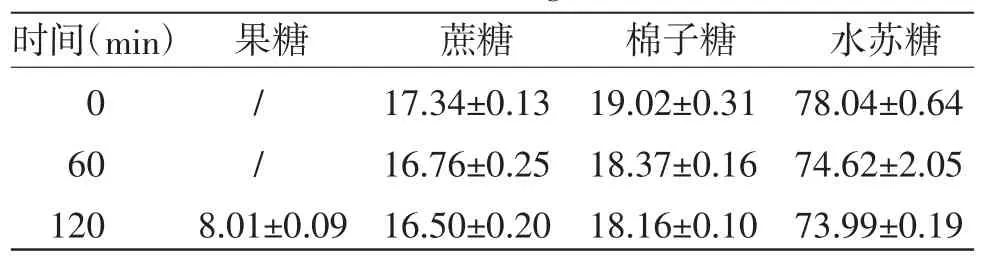
表3 100 ℃流通蒸汽灭菌对4 种糖含量的影响(,n=3,mg/mL)
注:/表示低于线性范围的最低浓度
由表3可知,与灭菌前(0 min)比较,100 ℃流通蒸汽灭菌60 min,果糖峰面积对数增加19.71%,灭菌120 min,果糖含量明显增加;灭菌后蔗糖、棉子糖和水苏糖含量变化均小于5%。说明果糖含量的增加可能由麦冬多糖分解引起。100 ℃流通蒸汽灭菌60 min,微生物限度符合《中华人民共和国药典》要求,进一步考察100 ℃流通蒸汽灭菌30 min对果糖、蔗糖、棉子糖和水苏糖含量的影响,结果见表1。
2.3.5 加防腐剂100 ℃流通蒸汽灭菌样品含量 分别精密量取添加或不添加防腐剂、100 ℃流通蒸汽灭菌30 min前后的地麦活性糖溶液,按“2.3.1”项下方法制备供试品溶液,按“2.3.2”项下色谱条件分析样品,计算果糖、蔗糖、棉子糖和水苏糖含量,结果见表4。
表4 4 种防腐剂对4 种糖含量的影响(,n=3,mg/mL)
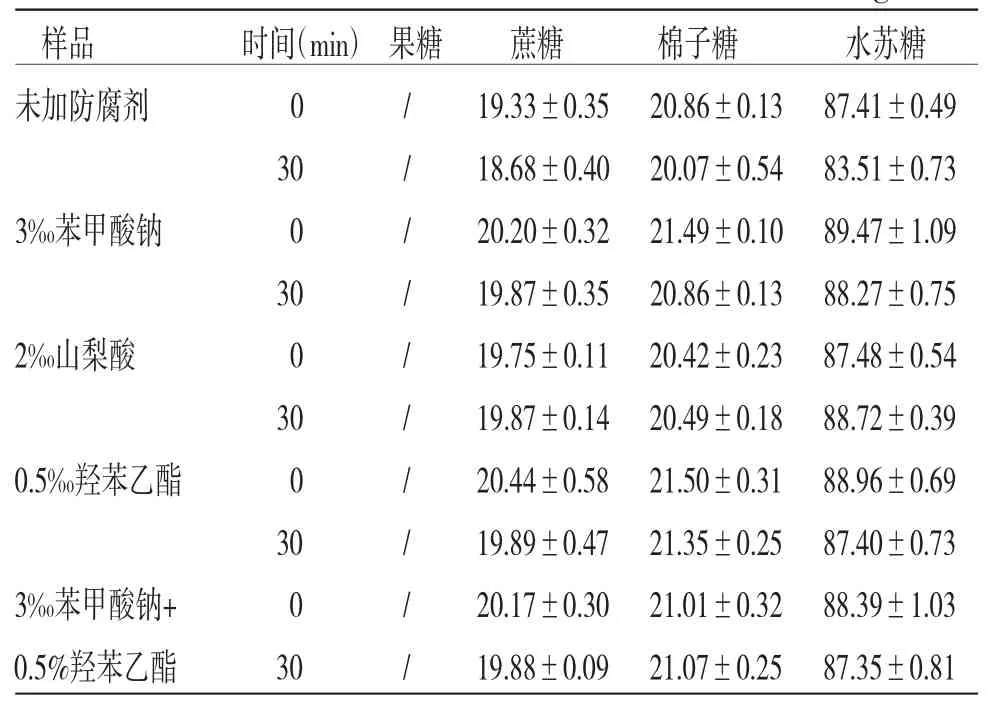
表4 4 种防腐剂对4 种糖含量的影响(,n=3,mg/mL)
注:/表示低于线性范围的最低浓度
由表4可知,与灭菌前(0 min)比较,100 ℃流通蒸汽灭菌30 min地麦活性糖中果糖、蔗糖、棉子糖和水苏糖的含量均无明显变化,且防腐剂3‰苯甲酸钠、0.5‰羟苯乙酯、2‰山梨酸、3‰苯甲酸钠+0.5‰羟苯乙酯对灭菌前后地麦活性糖中果糖、蔗糖、棉子糖和水苏糖的含量均无明显变化,但采用山梨酸为防腐剂在灭菌过程中,包装容器发生膨胀。结合“2.2”项下微生物限度检查结果,100 ℃流通蒸汽灭菌30 min可有效杀灭降低地麦活性糖需氧菌,而不影响4种糖类成分含量,防腐剂可选择3‰苯甲酸钠、0.5‰羟苯乙酯、3‰苯甲酸钠+0.5‰羟苯乙酯。
2.3.6 120 ℃流通蒸汽灭菌样品含量 分别精密量取120 ℃流通蒸汽灭菌0、15 min地麦活性糖溶液,按“2.3.1”项下方法制备供试品溶液,按“2.3.2”项下色谱条件分析样品,计算果糖、蔗糖、棉子糖和水苏糖含量,结果见表5。
表5 120 ℃流通蒸汽灭菌对4 种糖含量的影响(,n=3,mg/mL)

表5 120 ℃流通蒸汽灭菌对4 种糖含量的影响(,n=3,mg/mL)
注:/表示低于线性范围的最低浓度
由表5可知,与灭菌前(0 min)比较,120 ℃流通蒸汽灭菌15 min,地麦活性糖中果糖含量明显增加,蔗糖和棉子糖含量无明显变化,水苏糖含量降低9.29%,说明地麦活性糖中的生地低聚糖和麦冬多糖在120 ℃流通蒸汽条件下均发生分解,故不能采用120 ℃流通蒸汽灭菌。
2.3.760Co-γ射线辐照灭菌样品含量 分别精密量取10 kGy60Co-γ射线辐照前后的地麦活性糖溶液,按“2.3.1”项下方法制备供试品溶液,按“2.3.2”项下色谱条件分析样品,计算果糖、蔗糖、棉子糖和水苏糖含量,结果见表6。
表6 60Co-γ 射线辐照灭菌对4 种糖含量的影响(,n=3,mg/mL)
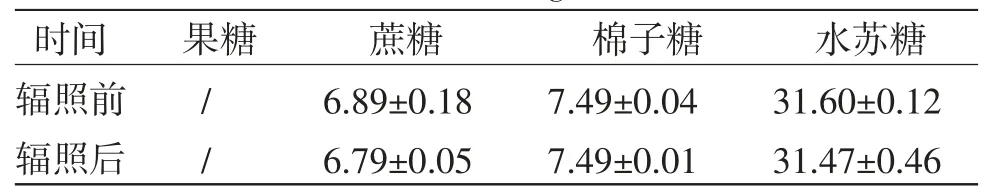
表6 60Co-γ 射线辐照灭菌对4 种糖含量的影响(,n=3,mg/mL)
注:/表示低于线性范围的最低浓度
由表6可知,辐照灭菌前后,地麦活性糖中果糖、蔗糖、棉子糖和水苏糖的含量无明显变化,说明10 kGy60Co-γ射线辐照12 h不影响果糖、蔗糖、棉子糖和水苏糖的含量,可用于地麦活性糖灭菌。
3 讨 论
近年来,有关糖类成分治疗慢性阻塞性肺疾病[3]、抗急性心肌缺血[4]、抗炎[10]及抗氧化[11]等药理活性研究越来越多。本课题组前期研究发现地麦活性糖具有良好的降低高血糖疗效。低聚糖、多糖类药物制备工艺复杂,在制备、储存过程中容易污染微生物而变质,而灭菌方法对低聚糖、多糖成分影响的研究报道较少。
目前,常用的物理灭菌方法有干热灭菌法、湿热灭菌法、射线灭菌法、微波灭菌法、过滤除菌法和60Co-γ射线辐照等。不同的灭菌方法对多糖含量产生不同程度的影响,如邱晓等[12]研究发现,当提取温度高于60 ℃时,党参总多糖可能在高温下分解,提取液中多糖含量下降。100 ℃流通蒸汽灭菌和煮沸灭菌,不能保证杀灭样品中所有细菌的芽孢,除制备过程尽量避免微生物污染,特别是制备成口服液、注射液等液体制剂时,可添加适宜的抑菌剂,故本实验同时考察添加或不添加防腐剂,100 ℃流通蒸汽灭菌对糖类成分和微生物的影响;国家食品药品监督管理总局发布的《中药辐照灭菌技术指导原则》(2015年版)建议中药最大总体平均辐照剂量原则上不超过10 kGy[13],本研究同时考察10 kGy60Co-γ射线辐照对地麦活性糖中4种糖类成分含量的影响。
多糖或低聚糖在浓硫酸和高温条件下,会水解成单糖,并脱水生成糠醛或糠醛衍生物,再与蒽酮或苯酚生成有色化合物,利用该原理,总糖主要通过苯酚-硫酸显色法和蒽酮-硫酸显色法法测定含量[14-15]。糖类成分在高温灭菌过程中可能分解为果糖或葡萄糖等,检测总糖含量,不足以反映地麦活性糖中生地低聚糖(指标成分为果糖、蔗糖、棉子糖和水苏糖)和麦冬多糖的含量变化。张文婷等[16]采用高效液相色谱-蒸发光散射检测器(high performance liquid chromatographyevaporative light scattering detector,HPLC-ELSD),以乙腈-水为流动相,梯度洗脱,检测生地黄在炮制过程中寡糖成分的变化,其中蔗糖受热分解成果糖与葡萄糖,棉子糖受热分解成蜜二糖、蔗糖和果糖,水苏糖受热主要分解成甘露三糖。XU Z等[17]采用超高效液相色谱(ultra high performance liquid chromatography,UHPLC)、HPLC、三重四极杆串联质谱和紫外光谱等快速定量分析技术,研究了3种苷类(梓醇、豆蔻苷和苦杏仁苷)和6种糖(鼠李糖、果糖、蔗糖、蜜二糖、水苏糖和毛蕊花糖)等含量测定方法。WANG X等[18]采用HILIC-UHPLC-TQ-MS/MS技术,以甲醇-水(60∶40)为流动相,建立了同时分析地黄中环烯醚萜苷(秋梨醇、梓醇)和低聚糖(蔗糖、蜜二糖、棉子糖、甘露糖和水苏糖)含量的方法。本研究通过HPLC-ELSD方法,检测不同灭菌方法对指标成分果糖、蔗糖、棉子糖和水苏糖含量影响,评价生地低聚糖在不同灭菌过程中的稳定性,并通过果糖含量变化间接反映以果糖组成为主的麦冬多糖的稳定性。
本研究发现,不同灭菌方法对不同批次地麦活性糖中微生物数量及果糖、蔗糖、棉子糖和水苏糖含量影响的考察结果一致,煮沸灭菌30 min、100 ℃流通蒸汽灭菌30 min(防腐剂可选择3‰苯甲酸钠、0.5‰羟苯乙酯、3‰苯甲酸钠+0.5‰羟苯乙酯)、10 kGy60Co-γ射线辐照12 h均可有效杀灭地麦活性糖中的需氧菌、霉菌和酵母菌,样品的微生物数量符合2020年版《中华人民共和国药典》四部中的微生物限度要求,同时不影响地麦活性糖中果糖、蔗糖、棉子糖和水苏糖含量。
4 结 论
本研究通过考察煮沸灭菌、100 ℃流通蒸汽灭菌、加防腐剂100 ℃流通蒸汽灭菌、120 ℃流通蒸汽灭菌、10 kGy60Co-γ射线辐照对地麦活性糖指标成分果糖、蔗糖、棉子糖和水苏糖含量及微生物数量的影响,发现煮沸灭菌60 min以上,100 ℃流通蒸汽灭菌30 min以上,120 ℃流通蒸汽灭菌15 min,虽然能有效杀灭地麦活性糖溶液中的微生物,但地麦活性糖中果糖含量明显升高、水苏糖含量明显降低。防腐剂3‰苯甲酸钠、0.5‰羟苯乙酯、3‰苯甲酸钠+0.5‰羟苯乙酯对地麦活性糖中4种糖含量无影响,可为地麦活性糖和其他糖类药物的灭菌方法提供参考。因缺乏麦冬多糖标准品,本研究主要考察了不同灭菌方法对不同批次地麦活性糖中生地低聚糖指标成分的影响,并通过果糖含量变化间接反映以果糖组成为主的麦冬多糖的变化,需要进一步研究麦冬多糖的含量测定方法。
