柱前衍生-高效液相色谱法比较使君子果实与种仁炮制前后使君子氨酸的含量*
2021-11-24廖佳慧楚洪军许诗怡游元元
廖佳慧,楚洪军,谢 瑞,许诗怡,游元元,2
(1.成都医学院药学院,四川 成都 610500;2.四川省高校结构特异性小分子药物研究重点实验室,四川 成都 610500)
使君子为使君子科植物使君子Quisqualis indica L.的干燥成熟果实,具有杀虫、健脾、止泻等功效,李时珍评价其为“小儿诸病要药”[1-2]。2020年版《中华人民共和国药典》(下简称《中国药典》)使君子项下有果实与种仁两个药用部位,有生用与炒用两种用法[3]。吕文海等[4]研究发现使君子的果实与种仁化学成分差异较大,而加热前后也有明显的含量及效用区别,提示使君子以不同部位及制法入药时其化学组分并不一致,进而影响临床疗效。现行《中国药典》仅以胡芦巴碱作为使君子的唯一含量测定指标,且无论果实或种仁、生品或炮制品皆为同一含量限度要求,但胡芦巴碱本身的生理活性与使君子的功效并不吻合[5],故现行使君子质量评价标准值得商榷。
使君子中含有的使君子氨酸(quisqualic acid,QA)有明确的驱杀蛔虫、蛲虫、绦虫等肠道寄生虫的作用[6-8],与药材的驱虫功效相符,可将QA作为质量标志物对药材进行品质评价。QA为非蛋白氨基酸,基本无紫外吸收,难以直接用HPLC-UV法进行检测,但被衍生化后则生成紫外吸收较强的衍生物,故可采用柱前衍生-高效液相色谱(Pre-column derivatization HPLC)法对QA进行分析[9-10]。本研究以2,4-二硝基氯苯为衍生剂,建立了使君子中QA的柱前衍生-高效液相色谱含量测定方法,并对15批市售使君子不同入药部位及炮制前后的QA含量进行测定和比较,以期为完善该药材的质量评价标准奠定基础。
1 仪器与试药
1.1 仪器 LC-20at高效液相色谱仪,包括紫外检测器、Lcsolution色谱工作站(日本岛津公司);XPE26电子分析天平(瑞士梅特勒-托利多公司);SK250H超声波清洗器(上海科导超声仪器有限公司);HH-4水浴锅(北京中兴伟业仪器有限公司);GL-16冷冻离心机(四川蜀科仪器有限公司)。
1.2 试药 使君子氨酸(南京沛微生物科技有限公司,批号:TRCW150707,纯度>97%);15批使君子药材分别购自于成都荷花池中药材市场、饮片公司及网络渠道,经成都医学院中药学教研室游元元教授鉴定为使君子科植物使君子Quisqualis indica L.的成熟果实,样品信息见表1。甲醇为色谱纯,水为超纯水,其他所用试剂均为分析纯。
表1 样品信息
2 方法与结果
2.1 使君子不同样品的制备 取15批市售使君子,每批部分去除果壳后得种仁。分别取果实与种仁适量,按2020年版《中国药典》四部“炮制通则”中清炒法与面煨法处理。得到15批药材两个药用部位(果实与种仁)各3种制品(生品、清炒品、煨制品),分别粉碎、过筛,备用。
2.2 色谱条件 采用Agilent Zorbax Eclipse XDB-C18色谱柱(4.6 mm×250 mm,5 μm),流动相为0.2%磷酸盐水溶液(A)-甲醇(B),以1 mL/min的流速进行梯度洗脱(0~8 min,5%B→15%B;8~15 min,15%B→20%B;15~22 min,20%B→30%B;22~30 min,30%B→38%B;30~35 min,38%B→38%B),检测波长为360 nm,柱温为30 ℃,进样量为10 μL。
2.3 对照品溶液的制备 取使君子氨酸对照品适量,精密称定,加水制成每1 mL含0.42 mg的对照品储备溶液。精密量取对照品储备溶液1 mL置试管中,加入0.05 mol/L 2,4-二硝基氯苯溶液3 mL,再加入0.01 mol/L硼砂缓冲液适量,摇匀,于80 ℃水浴条件下加热30 min,冷却至室温,转移至10 mL量瓶中,用硼砂缓冲液稀释至刻度,4 ℃9 000/min离心10 min,上清液用0.45 μm微孔滤膜滤过,取续滤液,即得。
2.4 供试品溶液的制备 取使君子样品粉末约0.25 g,精密称定,置具塞锥形瓶中,加入石油醚10 mL,浸泡15 min,滤去溶剂,于脱脂后的粉末中精密加入水10 mL,室温浸提30 min,离心10min,滤过,精密量取续滤液1mL置试管中,加入0.05 mol/L 2,4-二硝基氯苯溶液3 mL,再加入0.01 mol/L硼砂缓冲液适量,于80 ℃水浴条件下加热30 min,冷却至室温,转移至10 mL量瓶中,用硼砂缓冲液稀释至刻度,4 ℃9 000/min离心10 min,上清液用0.45 μm微孔滤膜滤过,取续滤液,即得。
2.5 阴性对照品溶液的制备 按本品处方比例,制备不含使君子氨酸的阴性对照品。
2.6 系统适用性试验 取对照品、供试品及阴性对照样品溶液,按照“2.2”项下色谱条件进样测定,结果见图1。使君子氨酸衍生物与相邻色谱峰分离良好,理论塔板数不低于20 000。
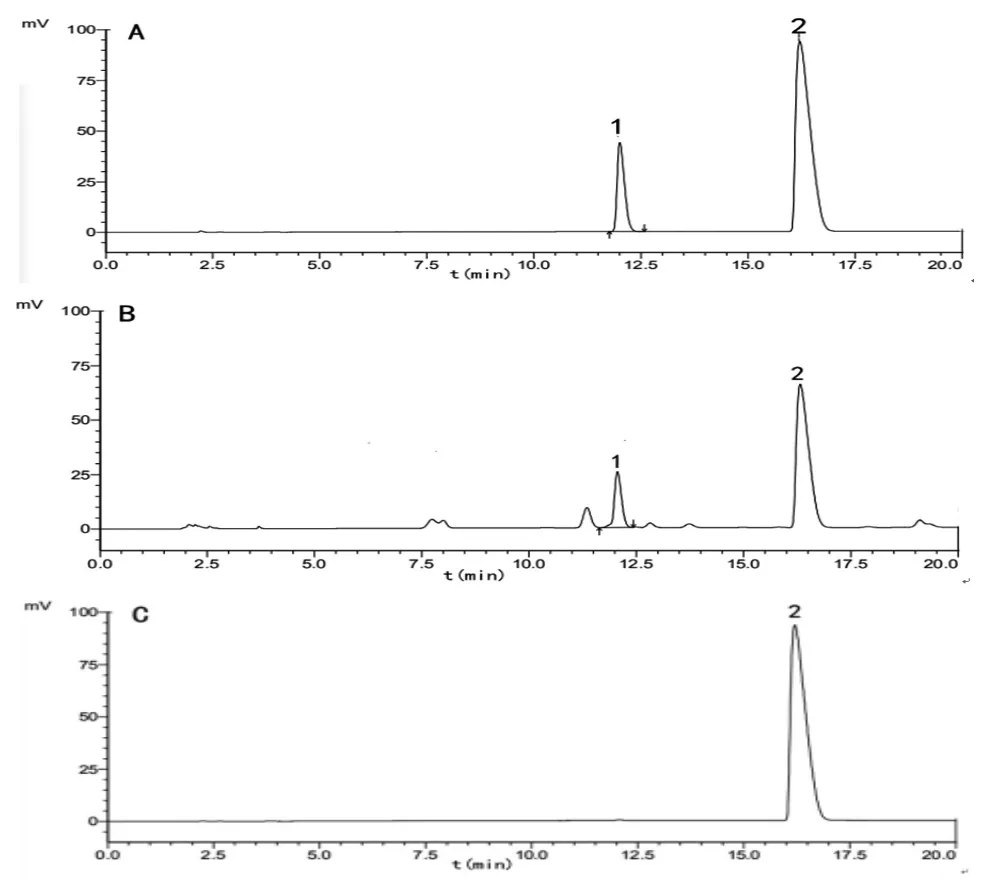
图1 各成分HPLC 图谱
2.7 线性关系考察 精密吸取“2.3”项下对照品储备溶液适量,按“2.3”项下方法自“置试管中,加0.05 mol/L 2,4-二硝基氯苯溶液3 mL”步骤起操作,依次配置8个不同浓度的系列浓度溶液,按“2.2”项下色谱条件进样,测定峰面积。分别以QA对照品峰面积Y为纵坐标,QA对照品浓度X为横坐标,绘制工作曲线,计算回归方程。结果显示QA在3.2~420.0 μg/mL范围内呈良好线性关系,回归方程为Y=1 367.4X-4 494.3(r=0.999 7)。
2.8 检测限和定量限的考察 取“2.3”项下对照品储备溶液适量,加水逐级稀释后按“2.3”项下方法从“置试管中,加0.05 mol/L 2,4-二硝基氯苯溶液3 mL”步骤起操作,按“2.2”项下色谱条件进样并记录色谱图。经计算QA的检测限(S/N=3)为1 μg,定量限(S/N=10)为3 μg。
2.9 精密度试验 精密吸取“2.3”项下对照品溶液,按“2.2”项下色谱条件连续进样6次,记录峰面积并计算其RSD。QA峰面积的RSD为0.14%,表明仪器精密度良好。
2.10 稳定性试验 取同一份使君子种仁生品供试品溶液,按“2.2”项下色谱条件分别于0、2、4、6、12、24 h进样测定,测定峰面积并计算RSD。QA峰面积的RSD为1.78%,表明样品溶液在24 h内稳定。
2.11 重复性试验 取同一批使君子种仁生品粉末5份,每份约0.25 g,精密称定,按照“2.4”项下方法制备供试品溶液,按“2.2”项下色谱条件进样测定,记录峰面积,按回归方程计算QA含量及RSD。QA的平均含量为1.43 mg/g,RSD为1.18%,表明该方法的重复性良好。
2.12 加样回收试验 取同一批使君子种仁生品粉末9份,每份约0.25 g,精密称定,置具塞锥形瓶中,分为低、中、高3组,分别加入5.26 mg/mL的QA对照品溶液150、300、400 μL,按照“2.4”项下方法制备供试品溶液,按色谱条件进样测定并计算回收率。QA的平均回收率为101.95%,RSD为2.21%,表明该方法的加样回收率良好,结果见表2。
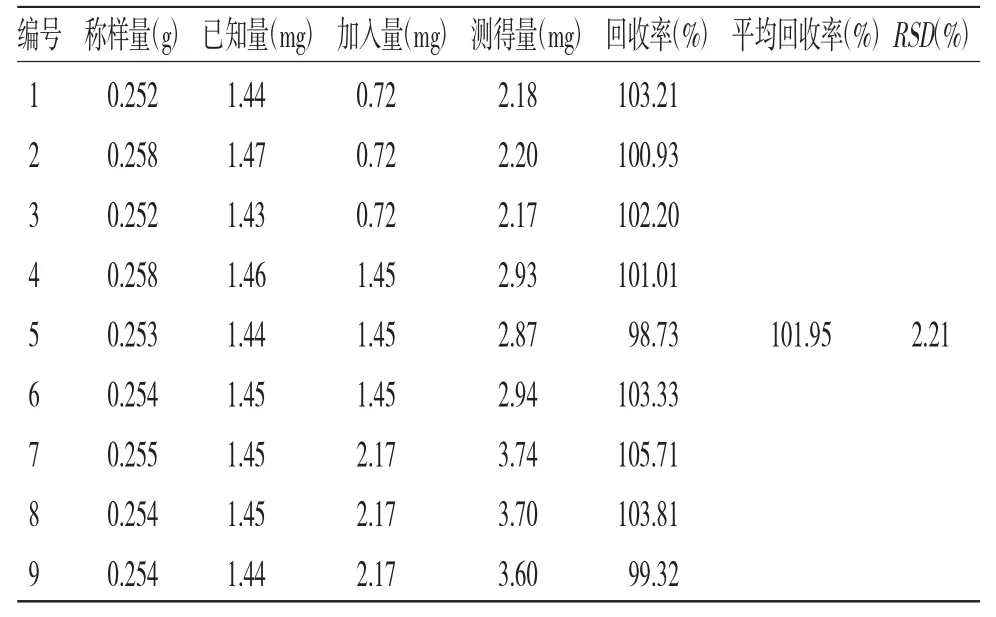
表2 加样回收率试验结果(n=9)
2.13 样品测定 取15批使君子果实与种仁的生品、清炒品及煨制品,按照“2.4”项下方法制备供试品溶液,按“2.2”项下色谱条件进样测定,按回归方程计算QA含量,结果见表3、图2~4。表明果实中QA含量均低于相同处理方式的种仁中QA含量,QA含量的趋势为生品>清炒品>煨制品。
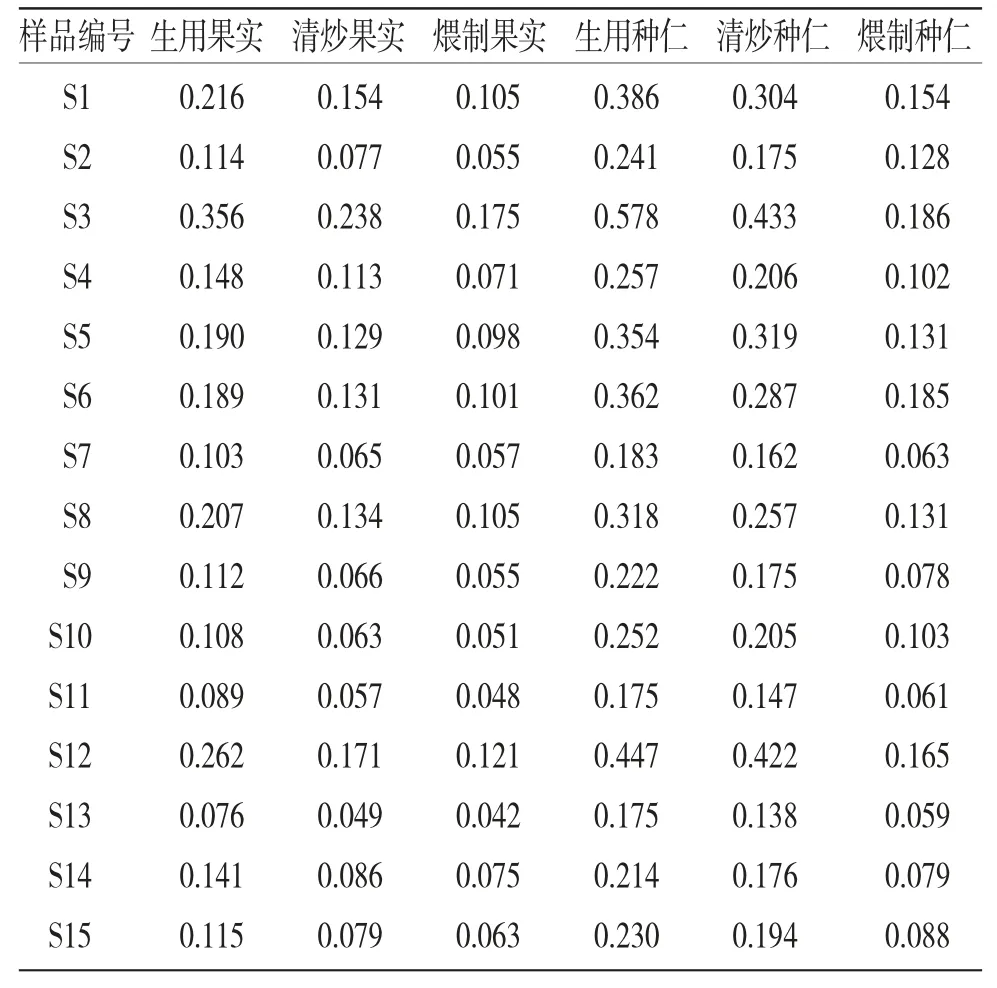
表3 使君子不同样品中QA 含量测定结果
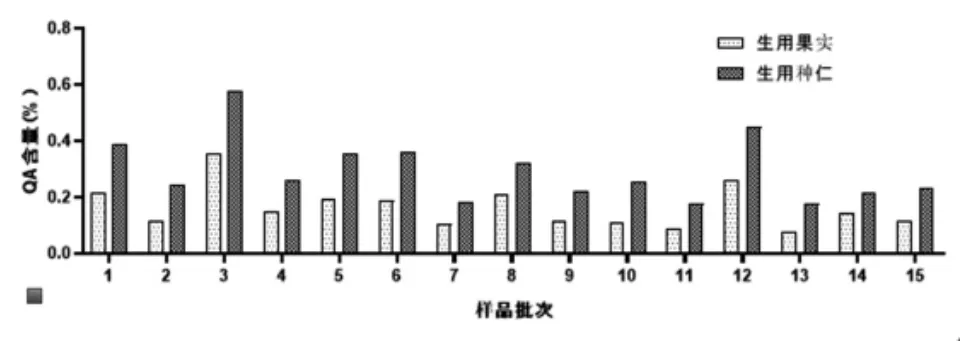
图2 生用果实与种仁QA 含量比较
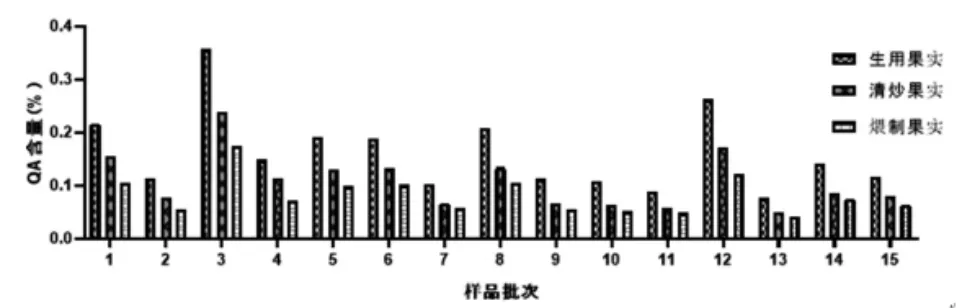
图3 果实炮制前后QA 含量比较
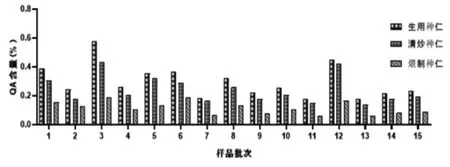
图4 种仁炮制前后QA 含量比较
3 讨 论
中药质量标志物是指存在于中药材和中药产品中固有的或加工制备过程中形成的,与中药的功能属性密切相关且能够反映中药安全性和有效性的标示性化学物质[11]。文献报道QA为使君子驱虫的主要有效成分,可以在一定程度上表征药材的品质,符合质量标志物的要求。
本实验采用了柱前衍生-高效液相色谱法对QA进行含量测定。在同样采用此法进行QA含量测定的文献报道中[12],使君子样品需回流法脱脂3次后再用水处理3 h,繁琐而费时,而本实验方法的样品前处理更简单方便。衍生过程中,文献方法需使用6种试剂进行衍生,按文献提示操作重复实验后发现衍生并不完全,而本法的衍生过程只需3种试剂,衍生效果较理想。文献方法的色谱条件中水相的pH值为9.2,不利于色谱柱的使用和保存,本法的水相pH值为7.6,适用于大多数C18柱。
15批市售使君子药材果实中的QA含量均低于种仁。《药性粗评》记载[13]:使君子以果实及种仁入药的情况均存在,但以种仁入药最为多见。本实验结果佐证了使君子种仁入药为主的合理性。无论果实或种仁,加热炮制后QA含量均有下降,且加热程度越剧烈,QA的下降程度越大。推测原因为药材中还存在其他种类的氨基酸,与QA共存时遇热会发生聚合反应[14];药材中的葡萄糖、果糖等还原糖还可能在加热条件下与QA发生美拉德反应[15]。故以驱虫为主要治疗目标时,使君子药材的炮制加热程度应注意掌握。
15批使君子样品中的QA含量有较明显差异,以生品果实为例,不同批次间QA含量可相差近5倍。推测是储存时间、储存条件的差异影响了药材的品质。
本研究将与使君子功效密切相关的化合物QA作为质量标志物,建立了测定其含量的柱前衍生-高效液相色谱法。该方法操作简便,衍生化完全,方法学考察结果良好,为完善使君子质量评价标准提供了参考。实验结果显示种仁中的QA含量高于果实,而经加热炮制后QA含量有所下降,这为使君子入药部位及制法的合理选择提供了依据。
