滇黄精多糖对低浓度链脲佐菌素所致的糖尿病肾病小鼠的影响
2021-11-23刘智君梁志敏杨慧瑜陈玉莲
刘智君,徐 锦,梁志敏,杨慧瑜,陈玉莲
(玉林市中西医结合骨科医院,广西 玉林 537000)
糖尿病肾病(diabetic nephropathy,DN)是糖尿病(diabetes mellitus,DM)一种常见的肾脏微血管损伤并发症,肾脏组织长期处于高血糖的环境中,因氧化应激反应而使肾组织受损,出现肾功能障碍[1]。由于糖尿病是一种终身的内分泌代谢紊乱疾病,故糖尿病患者后期多会出现DN并发症。目前对糖尿病肾病的治疗手段及药品不多,主要为患者出现肾功能不全或障碍后,在控制患者血糖的同时给予血管紧张素转化酶抑制剂和钙拮抗剂进行综合的调节[2]。因此,探索出治疗DN的药物对DN的防治具有十分重要的现实意义。
滇黄精Polygonatum kingianum Coll.et Hemsl为生长于云南的百合科黄精属植物的干燥根茎,是《中华人民共和国药典》规定作为黄精使用的3种原生药之一,具有养阴润肺、补脾益气的功效。滇黄精的主要成分为多糖、甾体皂苷、黄酮等物质,具有增强免疫力、降血糖、降血脂等药理作用[3]。链脲佐菌素(streptozotocin,STZ)对胰腺组织的损伤程度会随其浓度的增大而增大,高浓度的STZ易彻底造成胰腺组织丧失胰岛素分泌能力,而形成1型糖尿病模型。而低浓度STZ可诱导2型糖尿病的形成并随着时间的推移及病情的发展,出现糖尿病肾病的并发症。本研究采用低浓度链脲佐菌素多次诱导的糖尿病小鼠构建糖尿病肾病小鼠模型,探讨滇黄精多糖对DN小鼠的影响。
1 材料与方法
1.1 实验动物SPF级雄性昆明种小鼠60只,体质量18~22 g,购自广西医科大学实验动物中心,动物许可证号:SCXK(桂)2017-0005。小鼠饲养于通风良好的环境,室温18~25℃,相对湿度40%~70%,12 h光照昼夜循环。本研究严格按动物伦理要求进行研究实验。
1.2 药物与试剂药材滇黄精由广西医科大学药学院中药教研室朱丹副教授鉴定为百合科黄精属植物滇黄精Polygonatum kingianum Coll.et Hemsl的干燥根茎。滇黄精多糖由本实验室采用“水提醇沉法”制备所得。缬沙坦片(海南皇隆制药股份有限公司,批号:180125);链脲佐菌素(美国Sigma公司,批号:B1857);肿瘤坏死因子-α(TNF-α)ELISA试剂盒(晶美生物工程有限公司,批号:20190117);白介素-1β(IL-1β)ELISA试剂盒(晶美生物工程有限公司,批号:20181229);白介素-6(IL-6)ELISA试剂盒(晶美生物工程有限公司,批号:20190115);转化生长因子-β1(TGF-β1)ELISA试剂盒(南京建成生物工程研究所,批号:B1903C);纤维连接蛋白(FN)ELISA试剂盒(南京建成生物工程研究所,批号:B1901D)。
1.3 主要仪器罗氏卓越型血糖仪(瑞士ACCU-CHEK Performa);7100型全自动血生化分析仪(日本HITACHI);H-7650型透射电镜(日本HITACHI);9602A酶标仪(北京艾普生设备有限公司)。
1.4 造模与分组50只雄性小鼠适应性喂养1周后,将小鼠禁食不禁水12 h,用4℃的枸橼酸缓冲液(pH=7.4)所溶解的STZ溶液,对50只昆明种小鼠进行尾静脉注射STZ(40 mg/kg,STZ配制后需2 min内用完,超2 min的药物不留存使用),1次/d,连续注射3 d[4]。末次注射1周后,检测小鼠空腹血糖(FBG),以FBG≥11.1 mmol/L为糖尿病小鼠,继续予高脂高糖饮食饲料喂养90 d。通过检测小鼠24 h尿量、尿蛋白肾功能指标验证其损伤的存在,糖尿病肾病小鼠模型形成。将成模的小鼠随机分为模型组,缬沙坦组和滇黄精多糖低、中、高剂量组,每组10只。另取10只健康昆明种雄性小鼠设为空白对照组。
1.5 实验给药缬沙坦组小鼠灌胃予生理盐水配制的缬沙坦混悬液,20 mg/kg;滇黄精多糖低、中、高剂量组小鼠分别灌胃予生理盐水配制的滇黄精多糖混悬液,剂量分别为120、240、480 mg/kg;空白对照组和模型组灌胃等体积生理盐水;1次/d,连续给药90 d。
1.6 观察指标
1.6.1 空腹血糖及尿蛋白检测 末次给药1 d后,采集小鼠尾部末端血液,用血糖仪检测小鼠FBG;通过代谢鼠笼的尿漏斗装置收集各组小鼠尿液后,统计各组小鼠尿量,并采用全自动血生化分析仪将收集到的尿液进行24 h尿蛋白(UP)含量检测。
1.6.2 肾功能检测 小鼠拔眼球取血法取血,每只小鼠取0.8~1 mL血液,3 500 r/min高速低温离心机分离10 min,吸取上层血清存放于-80℃环境中备用。按试剂盒说明书操作测定血清中肌酐(Scr)、尿素氮(BUN)含量。
1.6.3 病理及超微组织观察 切取小鼠右侧少部分肾脏,置于10%福尔马林溶液中渗透固定。制蜡块,切片脱蜡,依次对标本使用二甲苯、无水乙醇、酒精、蒸馏透化及洗涤,HE染色法对其进行染色,观察糖尿病肾病小鼠肾脏的病理学变化。另切取小鼠右侧少部分肾脏,置于2.5%戊二醛溶液中渗透固定,制片,采用透射电镜观察肾脏组织超微结构的变化。
1.6.4 炎症因子及纤维化因子检测 将剩余的右侧肾脏组织与左侧肾脏组织一起制备成匀浆液后,采用ELISA法,按说明书操作分别检测肾脏组织中炎症因子TNF-α、IL-1β、IL-6的含量及纤维化因子TGF-β1、FN的含量。
1.7 统计学方法采用SPSS 25.0软件进行统计学分析,计量资料以“均数±标准差”表示。多组间比较采用单因素方差分析,若方差齐性,进一步采用Bonferroni法进行两两比较;若方差不齐,采用Kruska-Wallis H秩和检验。P<0.05为差异有统计学意义。
2 结 果
2.1 各组小鼠24 h尿量、尿蛋白含量比较模型组小鼠24 h尿量及尿蛋白含量明显高于空白对照组(P<0.01);缬沙坦组和滇黄精多糖高、中、低剂量组小鼠24 h尿量及尿蛋白含量明显低于模型组(P<0.05或P<0.01);滇黄精多糖中、低剂量组小鼠24 h尿量及尿蛋白含量明显高于缬沙坦组(P<0.05或P<0.01);滇黄精多糖高剂量组小鼠24 h尿量及尿蛋白含量高于缬沙坦组,但差异无统计学意义(P>0.05)。(见表1)
表1 各组小鼠24 h尿量、尿蛋白含量比较(±s)
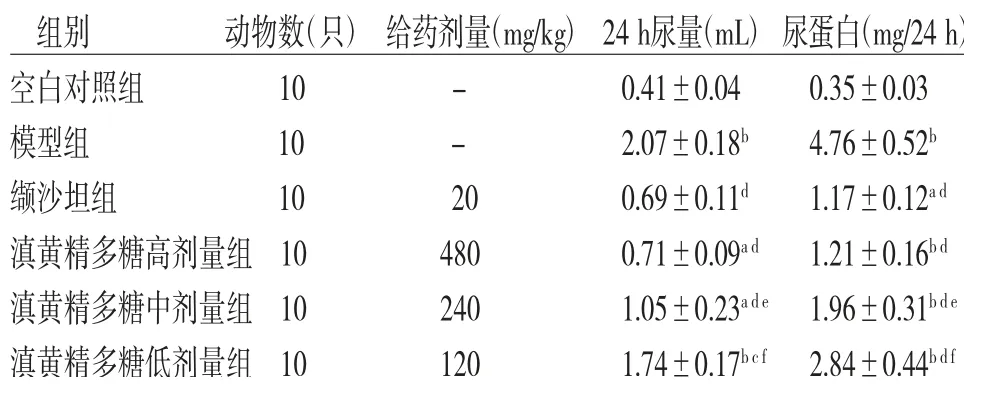
表1 各组小鼠24 h尿量、尿蛋白含量比较(±s)
注:与空白对照组比较,aP<0.05,bP<0.01;与模型组比较,cP<0.05,dP<0.01;与缬沙坦组比较,eP<0.05,fP<0.01
组别 动物数(只)给药剂量(mg/kg)24 h尿量(mL)尿蛋白(mg/24 h)空白对照组 10 - 0.41±0.04 0.35±0.03模型组 10 - 2.07±0.18b 4.76±0.52b缬沙坦组 10 20 0.69±0.11d 1.17±0.12a d滇黄精多糖高剂量组10 480 0.71±0.09a d 1.21±0.16b d滇黄精多糖中剂量组10 240 1.05±0.23a d e 1.96±0.31b d e滇黄精多糖低剂量组10 120 1.74±0.17b c f 2.84±0.44b d f
2.2 各组小鼠血清中Scr、BUN含量比较模型组小鼠血清中Scr、BUN含量明显高于空白对照组(P<0.01);缬沙坦组和滇黄精多糖高、中、低剂量组小鼠血清中Scr、BUN含量明显低于模型组(P<0.05或P<0.01);滇黄精多糖中、低剂量组小鼠血清中Scr、BUN含量明显高于缬沙坦组(P<0.05或P<0.01);滇黄精多糖高剂量组小鼠血清中BUN含量低于缬沙坦组(P<0.05),但Scr含量与缬沙坦组比较,差异无统计学意义(P>0.05)。(见表2)
表2 各组小鼠血清中Scr、BUN含量比较(±s,mg/dL)

表2 各组小鼠血清中Scr、BUN含量比较(±s,mg/dL)
注:与空白对照组比较,aP<0.05,bP<0.01;与模型组比较,cP<0.05,dP<0.01;与缬沙坦组比较,eP<0.05,fP<0.01
组别 动物数(只) 给药剂量(mg/kg)Scr BUN空白对照组 10 - 0.21±0.05 13.18±1.12模型组 10 - 0.64±0.08b 34.52±2.18b缬沙坦组 10 20 0.32±0.04a 19.49±1.93a滇黄精多糖高剂量组 10 480 0.31±0.05d 16.54±1.85ade滇黄精多糖中剂量组 10 240 0.46±0.04ace 24.83±2.67bce滇黄精多糖低剂量组 10 120 0.52±0.07ace 28.55±2.51bcf
2.3 各组小鼠空腹血糖比较给药前,模型组、缬沙坦组和滇黄精多糖高、中、低剂量组小鼠空腹血糖明显高于空白对照组(P<0.01)。给药后,模型组、缬沙坦组小鼠空腹血糖值增加;滇黄精多糖高、中剂量组小鼠空腹血糖值下降(P<0.05)。与缬沙坦组比较,滇黄精多糖高剂量组小鼠血糖明显下降(P<0.05)。(见表3)
表3 各组小鼠空腹血糖比较(±s,mmol/L)

表3 各组小鼠空腹血糖比较(±s,mmol/L)
注:与空白对照组比较,aP<0.05,bP<0.01;与模型组比较,cP<0.05,dP<0.01;与缬沙坦组比较,eP<0.05,fP<0.01
组别 动物数(只) 给药剂量(mg/kg) 给药前 给药后空白对照组 10 - 7.24±1.08 7.44±1.63模型组 10 - 16.28±2.73b 21.52±3.52b e缬沙坦组 10 20 16.47±2.34b 18.48±3.68b c滇黄精多糖高剂量组10 480 16.56±2.05b 12.79±3.83b d e滇黄精多糖中剂量组10 240 16.42±2.41b 15.72±2.49b c e滇黄精多糖低剂量组10 120 16.01±1.97b 17.35±2.15b c
2.4 各组小鼠肾脏的病理学观察HE染色结果显示,空白对照组小鼠肾小球结构完整饱满,细胞形态正常,组织中未有空泡出现,肾脏的包曼氏囊腔饱满;模型组小鼠肾小球空泡较多,细胞变形且有炎性细胞浸润,包曼氏囊腔呈皱缩变小;缬沙坦组小鼠肾组织空泡数量少且空泡较少,轮廓较饱满;滇黄精多糖各剂量组小鼠肾组织细胞变形有所缓解,肾小球结构相对完整,少有空泡出现,炎性细胞浸润减少,包曼氏囊腔轮廓皱缩程度减少。(见图1)
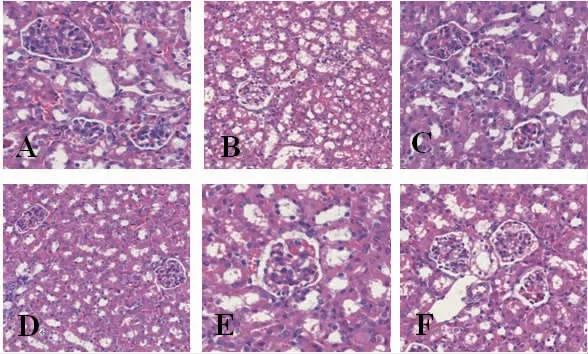
图1 各组小鼠肾脏的病理学观察(HE,×400)
2.5 各组小鼠肾脏超微结构的变化情况透射电镜观察结果显示,空白对照组小鼠肾小球基底膜无融合、增生、增厚现象,足突清晰且数量较多;模型组小鼠肾小球中基底膜增厚且融合现象明显,肾小球系膜增宽,足突数量较少;缬沙坦组小鼠基底膜融合现象少,足突数量较模型组多;滇黄精多糖各剂量组小鼠肾小球基底膜融合增厚得到缓解,足突数量有所增加。(见图2)

图2 各组小鼠肾脏超微结构的变化(×15 000)
2.6 各组小鼠肾脏中炎症因子TNF-α、IL-1β、IL-6的含量比较模型组小鼠肾组织中TNF-α、IL-1β、IL-6的含量明显高于空白对照组(P<0.05);缬沙坦组和滇黄精多糖高、中、低剂量组小鼠肾组织TNF-α、IL-1β、IL-6的含量均低于模型组(P<0.01);滇黄精多糖中、低剂量组小鼠肾组织中TNF-α、IL-1β、IL-6的含量明显高于缬沙坦组(P<0.01),滇黄精多糖高剂量组小鼠TNF-α含量低于缬沙坦组(P<0.05),而IL-1β、IL-6含量低于缬沙坦组,但差异无统计学意义。(见表4)
表4 各组小鼠肾脏中TNF-α、IL-1β、IL-6含量比较(±s,ng/L)

表4 各组小鼠肾脏中TNF-α、IL-1β、IL-6含量比较(±s,ng/L)
注:与空白对照组比较,aP<0.05,bP<0.01;与模型组比较,cP<0.05,dP<0.01;与缬沙坦组比较,eP<0.05,fP<0.01
组别 动物数(只) 给药剂量(mg/kg) TNF-α IL-1β IL-6空白对照组 10 - 65.61±5.76 6.09±1.42 11.95±1.69模型组 10 - 127.22±6.29b 14.27±2.78b 51.08±3.75b缬沙坦组 10 20 80.74±6.47bd 8.29±1.51bd 20.84±1.22bd滇黄精多糖高剂量组10 480 76.23±5.42bde 8.14±1.84ad 19.75±1.49bd滇黄精多糖中剂量组10 240 92.75±7.38bdf 10.85±2.09bdf 31.82±2.51bdf滇黄精多糖低剂量组10 120 105.91±8.14bdf 12.76±2.63bcf 40.78±2.37bdf
2.7 各组小鼠肾脏中纤维化因子TGF-β1、FN含量比较模型组小鼠肾组织中TGF-β1、FN的含量明显高于空白对照组(P<0.01);缬沙坦组和滇黄精多糖高、中、低剂量组小鼠肾组织中TGF-β1、FN的含量均低于模型组(P<0.05或P<0.01);滇黄精多糖中、低剂量组小鼠肾组织TGF-β1、FN的含量明显高于缬沙坦组(P<0.05或P<0.01),滇黄精多糖高剂量组小鼠肾组织中TGF-β1、FN含量低于缬沙坦组,但差异无统计学意义(P>0.05)。(见表5)
表5 各组小鼠肾脏中TGF-β1、FN的含量比较(±s,ng/mL)
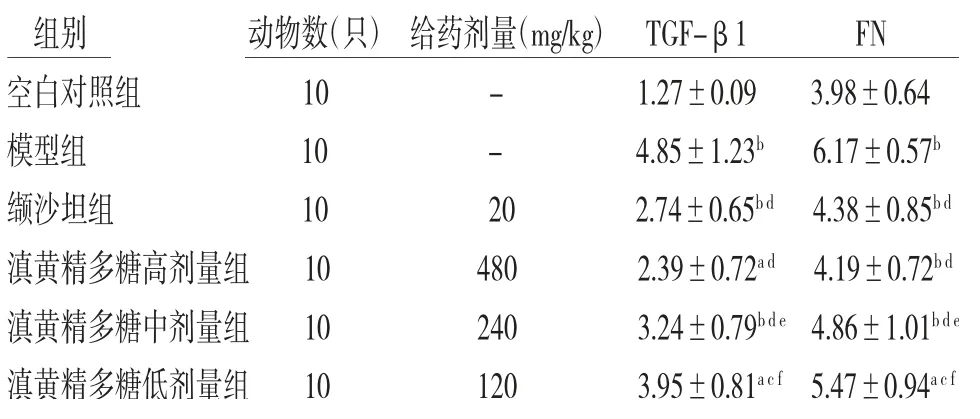
表5 各组小鼠肾脏中TGF-β1、FN的含量比较(±s,ng/mL)
注:与空白对照组比较,aP<0.05,bP<0.01;与模型组比较,cP<0.05,dP<0.01;与缬沙坦组比较,eP<0.05,fP<0.01
组别 动物数(只)给药剂量(mg/kg)TGF-β1 FN空白对照组 10 - 1.27±0.09 3.98±0.64模型组 10 - 4.85±1.23b 6.17±0.57b缬沙坦组 10 20 2.74±0.65b d 4.38±0.85b d滇黄精多糖高剂量组 10 480 2.39±0.72a d 4.19±0.72b d滇黄精多糖中剂量组 10 240 3.24±0.79b d e 4.86±1.01b d e滇黄精多糖低剂量组 10 120 3.95±0.81a c f 5.47±0.94a c f
3 讨 论
糖尿病肾病(DN)是因糖尿病血糖不稳定,长期处于高血糖状态下导致肾脏微血管受损的并发症。由于高血糖对肾脏的损伤需要较长的时间,DN一般高发于糖尿病后期患者,且会发展为终末期肾脏疾病,这也是糖尿病致死、致残的主要影响因素[5-7]。由于DN的发病漫长且发病机制复杂,目前对其治疗的药物较少,故研发新的治疗DN的药物具有重要意义。
肾脏组织中巨噬细胞大量分泌炎症因子TNF-α、IL-1β、IL-6[8-9]。在DN的发病机制中,炎症细胞的浸润及巨噬细胞自分泌出的炎症因子对肾脏的损伤起着关键的作用[10-11]。高血糖所引起的氧化应激反应,将进一步加重肾组织的炎症反应而加重肾脏的损伤,并启动肾组织中肾间质纤维化的进程,使纤维化因子TGF-β1、FN被活化,从而加速肾间质纤维化的进程[12-14]。
前期的研究中已证实滇黄精多糖具有良好的降血糖药理学效果[15]。本实验结果显示滇黄精多糖可降低糖尿病小鼠的血糖,同时能降低小鼠尿液中尿蛋白的含量及缓解小鼠多尿的情况。滇黄精多糖干预后,糖尿病肾病小鼠血清中Scr、BUN的含量下降,表明糖尿病肾病小鼠肾功能情况有所恢复。滇黄精多糖干预下,糖尿病小鼠肾脏组织中炎症因子TNF-α、IL-1β、IL-6和纤维化因子TGF-β1、FN的含量均有不同程度的降低。HE染色结果及透射电镜观察表明,糖尿病肾病小鼠在滇黄精多糖干预后,肾组织细胞变形有所缓解,肾小球结构相对完整,少有空泡出现,炎性细胞浸润减少,包曼氏囊腔轮廓皱缩程度减少,基底膜融合增厚得到缓解,足突数量有所增加。提示滇黄精多糖能有效地调节糖尿病肾病小鼠血糖,同时提高肾组织功能,缓解肾脏的受损情况。其作用机制可能为降低肾脏组织中炎症因子的含量,缓解肾脏组织中炎症反应,同时降低纤维化因子的含量,阻止肾间质纤维化进程的发生,从而达到缓解肾脏的受损情况,保护肾脏的作用。
