阳和汤对实验性自身免疫性甲状腺炎大鼠的治疗作用*
2021-11-23马丙娥王建华赵正平周国威马朝群
马丙娥,王建华,赵正平,周国威,王 琼,马朝群
(1.南京中医药大学附属中西医结合医院,江苏 南京 210028;2.南京中医药大学第一附属医院,江苏 南京 210029)
自身免疫性甲状腺炎又称桥本甲状腺炎(hashimoto’s thyroiditis,HT)和慢性淋巴细胞性甲状腺炎,是多发于中年女性的自身免疫性甲状腺疾病,患者数量约占全球总人口的5%[1]。HT的主要特征包括甲状腺组织弥散性淋巴浸润和甲状腺自身抗体显著升高,包括甲状腺球蛋白抗体(thyroglobulin antibody,TgAb)、抗甲状腺过氧化物酶抗体(anti-thyroperoxidase antibody,TPO-Ab),这也是引起甲状腺功能减退的主要原因[2]。甲状腺淋巴细胞的浸润和甲状腺组织的进行性损害进一步加重了疾病的进展[3]。西医目前对于该病治疗手段主要有激素治疗、免疫治疗等,但只能改善HT引起的甲状腺功能异常,无法有效降低患者血清中高度富集的甲状腺自身抗体,副作用大,疗效有限[4]。中药具有多靶点、副作用低、疗效稳定等优势,近年来成为研究治疗免疫性疾病的热点。阳和汤出自清代名医王洪绪《外科证治全生集》,本课题组前期临床研究[5]已经证实阳和汤对HT有良好的疗效。本研究利用实验性自身免疫性甲状腺炎(experimental autoimmune thyroiditis,EAT)大鼠模型,从分子水平检测阳和汤对EAT大鼠血清中甲状腺自身抗体TgAb、TPO-Ab水平及IL-35表达的影响,深入探究阳和汤对桥本甲状腺炎的治疗效果,以期为中药治疗桥本甲状腺炎(HT)提供理论依据。
1 材料与方法
1.1 实验动物10周龄SPF级雌性SD大鼠24只,体质量120~140 g,购于北京维通利华实验动物技术有限公司,动物合格证号:NO1908230043。于照明黑暗交替12h/12h、室温(22±1)℃、湿度50%~70%条件下饲养,本实验经江苏省中医院动物伦理委员会审批许可,伦理号:2020 DW-02-02。
1.2 药物与试剂
1.2.1 药物 阳和汤处方组成:熟地黄30 g,肉桂3 g,麻黄2 g,鹿角胶9 g,白芥子6 g,姜炭2 g,生甘草3 g。取自南京中医药大学第一附属医院中药房。将生药(除鹿角胶)用5倍体积量自来水浸泡2 h,煮沸40 min,过滤分离药液及药渣,药渣再加入3倍体积自来水煎煮20 min,过滤后留药液。合并两次药液于70℃水浴中浓缩至30 mL,再将鹿角胶烊化加入其中。用蒸馏水倍比稀释成浓度1 g/mL的水煎剂。
1.2.2 试剂 猪甲状腺球蛋白PTg(sigma,批号:018K7012);完全弗氏佐剂(sigma,批号:SLBW5971);不完全弗氏佐剂(sigma,批号:SLBW0366);卢戈氏液(江苏省中西医结合医院制剂室提供);甲状腺球蛋白抗体(TgAb)和甲状腺过氧化物酶抗体(TPO-Ab)、IL-35放射免疫检测试剂盒(北京华英生物技术研究所,批号:20190218);Anti-STAT3(Abcam,货号:ab68153);Anti-p-STAT3(Abcam,货号:ab76315);Anti-STAT1(Abcam,货号:ab31369);Anti-p-STAT1(Abcam,货号:ab29045);Anti-beta Tubulin(Invitrogen,货号:PA5-27108)。
1.3 主要仪器IX51-A12PH型显微镜(日本奥林巴斯);Scientific Sorvall ST 40离心机(Thermo公司);酶标仪(Thermo公司);NanoDrop 2000光度计(Thermo公司);SAGA-D超纯水仪(上海赛鸽);FE28-Standard酸度计(瑞士梅特勒托利多);ME155DU微量电子天平(瑞士梅特勒托利多)。
1.4 造模与分组24只SD雌性大鼠适应性饲养1周后,随机分为正常组、模型组、阳和汤治疗组、阳和汤预防组。除正常组外,其他大鼠复制EAT模型,造模方法参考文献[6],具体步骤如下:无菌PBS将PTg溶解,再与完全弗氏佐剂(CFA)等体积混合,配制成PTg(浓度8 mg/mL),充分震荡制成油包水乳剂(滴在水中不化开即乳化完全)。将PTg溶液与不完全弗氏佐剂(IFA)1∶1混匀配置PTg注射液,对造模组大鼠后足趾、背部、腹腔皮下多点注射(0.8 mg/只),共注射2次,间隔2 d,为初次免疫。初次免疫后每隔1周注射1次,连续6周,为加强免疫。第6周结束时检测大鼠血清中甲状腺过氧化酶抗体(TPO-Ab)、甲状腺球蛋白抗体(TgAb)明显升高,甲状腺组织内见淋巴细胞浸润即为造模成功。
1.5 实验给药阳和汤预防组大鼠在造模同时灌胃给予阳和汤浸膏,1.5 g/(100 g·d),连续给药6周;阳和汤治疗组在完成造模后次日开始给药,剂量同阳和汤预防组,连续给药6周;模型组在造模完成后次日给予生理盐水灌胃,1 mL/(100 g·d),持续6周;正常组大鼠常规饲养,饮用蒸馏水。除正常组外,其他3组大鼠造模期间饮用5%卢戈氏液(10 mL卢戈氏液加入1 180 mL自来水中,现配现用),其他饲养条件同正常组。
1.6 观察指标
1.6.1 甲状腺抗体检测 给药结束后,毛细玻璃管采集眶静脉血,常温凝血15 min后,2 000 r/min离心5 min,取上层血清。分别按照大鼠TgAb、TPO-Ab、IL-35检测试剂盒使用说明书操作步骤测定大鼠血清中TgAb、TPO-Ab、IL-35含量。
1.6.2 组织病理学检测 眼眶取血完成后用颈椎脱臼法处死所有大鼠,取大鼠甲状腺组织,并用10%中性甲醛固定、脱水、石蜡包埋,4 μm厚连续切片,行HE染色。光镜下观察甲状腺组织病理形态改变,包括滤泡大小、上皮形态、上皮及滤泡间的淋巴细胞浸润等。
1.6.3 Western blotting法检测STAT3、p-STAT3、STAT1、p-STAT1蛋白的表达情况 常规方法提取甲状腺组织总蛋白,调整蛋白浓度至2.5 g/L,以30 μg/孔上样经SDS-PAGE电泳、转膜、封闭,按照抗体说明书分别加入特异性一抗(STAT3,p-STAT3,STAT1,p-STAT1)4℃孵育过夜。次日,TBST漂洗15 min,更换为HRP偶联的二抗常温孵育2 h。弃二抗,TBST漂洗15 min后加入ECL发光液显影并采集图像分析。
1.7 统计学方法采用SPSS 25.0统计学软件进行分析,计量资料以“均数±标准差”表示,对各组进行正态性检验与方差齐性检验,采用单因素方差分析,P<0.05为差异有统计学意义。
2 结 果
2.1 各组大鼠血清中TgAb、TPO-Ab水平比较造模完成后,与正常组比较,模型组大鼠血清中TgAb和TPO-Ab水平明显升高(P<0.05)。而阳和汤预防组大鼠血清中TgAb和TPO-Ab水平与模型组比较,差异无统计学意义(P>0.05)。造模完成,继续给药6周后,与模型组比较,阳和汤治疗组和阳和汤预防组大鼠血清中TgAb和TPO-Ab水平明显降低,同时两组大鼠血清中TgAb和TPO-Ab水平比较,差异无统计学意义(P>0.05)。(见图1)
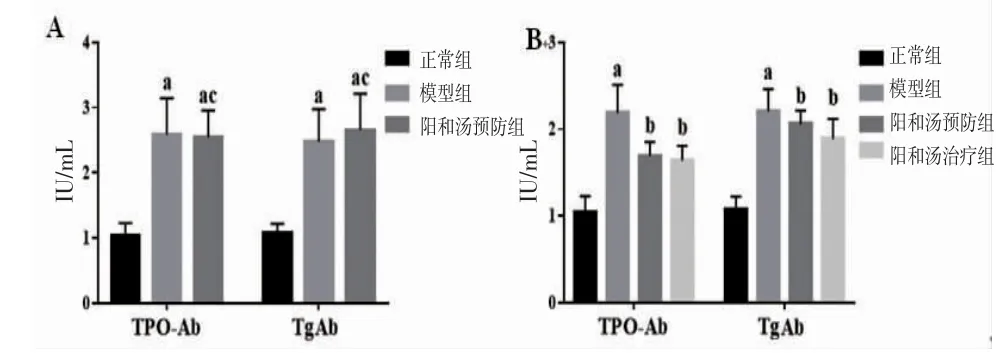
图1 各组大鼠血清中TgAb和TPO-Ab水平比较(±s,n=6)
2.2 各组大鼠甲状腺组织病理学形态观察正常组大鼠甲状腺滤泡呈类圆形或多边形,滤泡上皮细胞排列整齐,滤泡腔内充满淡红色的胶质,未见巨噬细胞和淋巴细胞炎症浸润;模型组大鼠甲状腺滤泡腔萎缩,胶质明显减少,大部分滤泡上皮组织增生,出现大量淋巴细胞及浆细胞浸润;阳和汤治疗组大鼠甲状腺滤泡形态较规则,与模型组比较,淋巴细胞炎症浸润有明显改善;阳和汤预防组大鼠甲状腺滤泡形态基本规则,含少量胶质,边间不清楚,少量淋巴细胞浸润,与阳和汤治疗组相比无明显区别。
2.3 各组大鼠血清炎症因子IL-35水平比较与正常组比较,模型组大鼠血清中IL-35表达明显降低,且IL-35与TPO-Ab表达水平呈密切负相关。而阳和汤治疗组大鼠体内该现象部分缓解,IL-35表达明显升高,同时阳和汤预防组大鼠血清IL-35表达水平与模型组比较,差异无统计学意义(P>0.05)。(见图3~4)

图3 各组大鼠血清炎症因子IL-35水平比较(±s,n=6)

图4 EAT大鼠外周血IL-35和TPO-Ab表达水平相关性分析
2.4 各组大鼠PBMC中STAT1/STAT3信号通路激活情况比较各组大鼠PBMC中STAT1和STAT3的表达无明显变化,而模型组大鼠PBMC中p-STAT1表达明显降低,p-STAT3明显升高。阳和汤治疗大鼠PBMC中p-STAT1表达高于模型组,而p-STAT3表达低于模型组,差异均有统计学意义(P<0.05)。这表明阳和汤治疗可以调控p-STAT1和p-STAT3的表达,有效干扰EAT大鼠体内STAT信号通路的异常激活。(见图5)
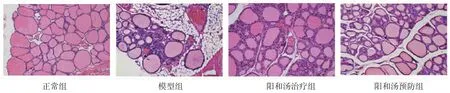
图2 各组大鼠甲状腺组织病理形态观察(HE,×200)
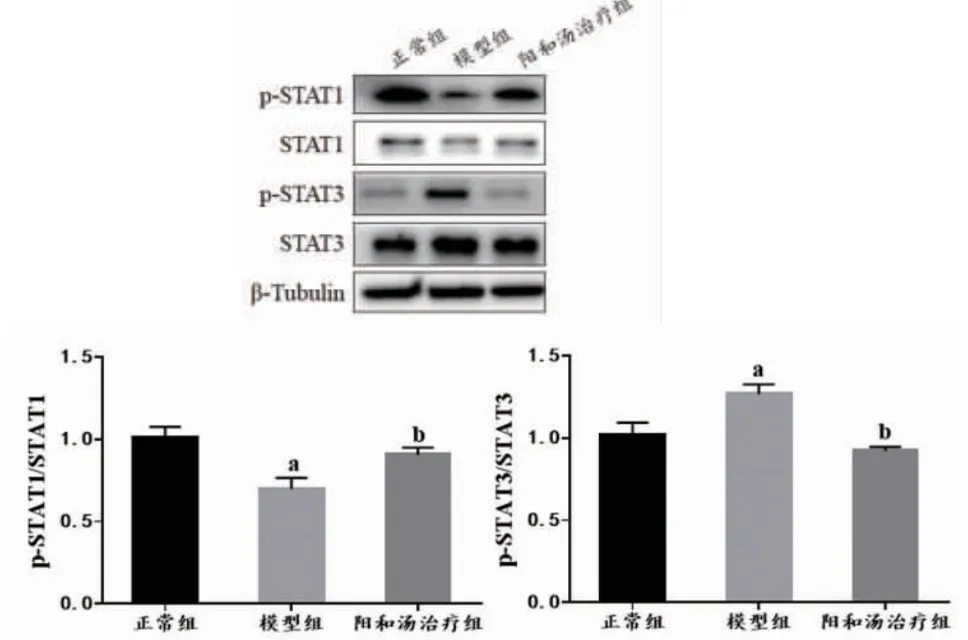
图5 各组大鼠PBMC中STAT信号通路激活情况(±s,n=6)
3 讨 论
近年来,桥本甲状腺炎(HT)发病率逐步上升且呈年轻化趋势[7]。该病的临床特点是甲状腺肿大,血清TgAb和TPO-Ab明显升高,其中TPO-Ab指标升高更为显著[4]。随着病情进展,甲状腺自身抗体过度合成,严重的自身免疫炎症损伤甲状腺滤泡细胞的结构和功能,引发成一系列恶性疾病,包括甲状腺功能亢进症、甲状腺功能减退、甲状腺结节甚至甲状腺癌[8-10]。HT起病较缓,早、中期患者因症状隐匿临床较少发现,后期患者确诊时常合并甲状腺功能减退,临床表现以代谢功能降低为特征,主要为甲状腺弥漫性或结节性肿大、质地韧。患者全身乏力,精神萎靡,表情淡漠;面色白光白,睑结膜苍白,皮肤粗厚脱屑,可有浮肿,腹部胀满,下肢呈非指凹性浮肿,手足清冷,腰膝酸痛,小便清长,下肢羸弱等。目前西医治疗HT的主要方法是甲状腺激素替代治疗(仅适用于甲状腺功能减退患者)、免疫抑制治疗、糖皮质激素治疗,但这些治疗均伴随不同程度的副作用。近几年来,中医药疗法逐渐成为研究热点。
祖国医学中无HT相应的中医病名记载,根据其症状表现,其前期属于“瘿病”“心悸”等范畴,后期则可以“虚劳”“水肿”“肤胀”等论之[11-12],诸多医家认为禀赋不足、情志内伤、风热邪毒损伤[13]、饮食失调及地理环境等是本病发生的主要原因。病位以肝脾肾三脏为主,与心相关。本病初起多实,病情迁延则因实致脾肾阳亏,从而形成本虚标实之证[5]。阳虚不运或是本病的病机核心[14]。后期出现脾肾阳虚、寒痰凝结的中医证候。
清代名医王洪绪创立了以阳和汤系列为代表的诸多治疗阴疽的名方。阳和汤由熟地黄、肉桂、麻黄、鹿角胶、白芥子、姜炭、生甘草组成。王氏认为:“阴疽治之之法,非麻黄不能开腠理,非肉桂、炮姜不能解其寒凝,此三味虽酷暑,不可缺一也。腠理一开,寒凝一解,气血乃行,毒邪随之消矣。”阳和汤全方有温阳补血、宣通血脉、散寒祛痰之功,用于阴疽之证,犹如离照当空,阴霾自散,可化阴凝而使阳和,故以“阳和”名之[15]。临床上用此治疗阴疽,疗效确切。近代外科名家马培之尝谓:“以阳和汤治阴疽,无出其右,用之得当,应手而愈”。
免疫诱导法是目前构建HT实验动物模型的最常用方法,建模成功的标准主要为出现甲状腺自身抗体及甲状腺组织有淋巴细胞浸润[16]。本研究结果表明,模型组大鼠血清中TPO-Ab和TgAb水平明显高于正常组(P<0.01),甲状腺组织滤泡形态皱缩,滤泡腔内胶质明显减少,可见大量淋巴细胞和浆细胞炎性浸润,表明EAT大鼠模型构建成功,该模型用于后续实验。阳和汤连续灌胃6周后,阳和汤治疗组较模型组大鼠血清中TPO-Ab、TgAb水平显著降低。而阳和汤预防组大鼠血清中TPO-Ab、TgAb水平与模型组大鼠比较,差异无统计学意义,说明在桥本甲状腺炎早期,阳和汤治疗无效。体现了中医辨证论治的精髓。以方测证,桥本甲状腺炎早期并非阳虚痰凝证,不能达到降抗体的作用。以上结果表明阳和汤对自身免疫性甲状腺炎有改善作用。
目前桥本甲状腺炎发病机制并不明确,TPO-Ab升高可引起多种免疫性疾病,增加流产风险。研究发现,长期血清TPO-Ab抗体升高伴随发生抑郁、焦虑等神经行为学改变。本研究发现,模型组大鼠血清中IL-35水平明显降低,说明EAT大鼠体内免疫抑制。阳和汤干预后,血清中IL-35表达水平升高,且IL-35表达与TPO-Ab水平呈密切负相关。以上结果提示阳和汤通过升高血清IL-35水平来降低TPO-Ab水平。IL-35作为刺激Treg细胞分化的免疫因子,其表达显著升高标志着EAT病理进程中Treg细胞比例显著升高。此外,许多研究证明STAT3信号通路异常与EAT进展密切相关,如何有效抑制STAT3通路激活可作为EAT治疗的切入点进行深入研究。EAT发病伴随着p-STAT3表达升高,而适量的依达拉奉和木犀草素均可有效抑制EAT大鼠体内p-STAT3的升高[17-18]。本研究表明阳和汤也有类似的功效,有效抑制了STAT3信号通路的激活。根据以上结果,我们猜想阳和汤通过促进血清中IL-35水平升高,刺激体内Treg细胞分化,进而降低自身免疫抗体表达水平,减少甲状腺淋巴细胞的浸润,缓解甲状腺功能。阳和汤中发挥功能的有效成分和上调IL-35的直接作用靶点是我们下一步的研究重点。
综上,针对方证相关的中医药学核心问题,以经典阳和汤方为研究的切入点,本研究应用现代分子生物学检测技术和方法,在阳和汤临床治疗有效的前提下,深入探究分子机制,为阳和汤治疗桥本甲状腺炎提供理论依据,提出并验证桥本甲状腺炎发病的实质为免疫失衡这一假说,而阳和汤的治疗基础亦在于可以纠正这种失衡状态。
