通关藤提取物通过线粒体途径诱导肝癌HepG2细胞凋亡研究*
2021-11-23黄争荣林锦培何火聪赖义勤
黄争荣,林 浩,林锦培,王 泳,何火聪,赖义勤
(福建省肿瘤医院/福建医科大学附属肿瘤医院,福建 福州 350014)
原发性肝癌(简称肝癌)是我国常见的恶性肿瘤之一,每年新发患者约占全球肝癌发病的55%[1]。肝癌起病隐匿,早期症状不明显,且恶性程度高,病情发展迅速,确诊时往往病情已进入晚期,而肝癌对放化疗不敏感,因此晚期肝癌临床治疗效果总体不佳。
通关藤为萝藦科牛奶菜属植物,别称通光藤、乌骨藤,始记载于《滇南本草》,味苦,性微甘、凉,具有清热解毒、止咳平喘、祛痰等功效[2]。研究表明,通关藤提取物治疗晚期原发性肝癌,具有较好的抗肿瘤疗效,能改善患者生活质量[3-4]。通关藤抗肿瘤作用的具体机制尚不明确,因此本实验以人肝癌细胞株HepG2为模型,探讨通关藤提取物促进肝癌细胞凋亡的作用及其相关机制,为更好地开发利用通关藤提供实验依据。
1 材 料
1.1 药物与试剂MTE(南京圣和药业有限公司,商品名:消癌平注射液,国药准字Z20025868,生药浓度为2.5 g/mL);胰蛋白酶-EDTA(美国Hyclone公司,批号:J170049);DMEM培养基(美国Hyclone公司,批号:NWM0534);Annexin V-FITC/PI双染法试剂盒(美国Becton Dickinson公司,批号KGA107);JC-1线粒体膜电位检测试剂盒(碧云天生物技术研究所,批号:C2006);BCA蛋白定量试剂盒(美国Thermo Fisher Scientific公司,批号:23235);ECL化学发光试剂盒(美国Thermo Fisher Scientific公司,批号:32132);一抗兔抗人Bcl-2、Bax、Cytochrome-c、Caspase-3、Caspase-9多克隆抗体及二抗辣根过氧化物酶(HRP)标记羊抗兔IgG(武汉赛维尔生物科技有限公司)。
1.2 主要仪器超净工作台(江苏苏州净化设备公司);3111型CO2培养箱(美国Thermo Electron公司);Mikro高速离心机(德国Hettieh公司);FACS Calibur流式细胞仪(美国Becton Dickinson公司);Tetra凝胶电泳仪(美国Bio-Rad公司);4000MM PRO凝胶成像分析系统(美国Carestream公司)。
2 方 法
2.1 细胞培养人肝癌HepG2细胞系由福建省肿瘤医院放射生物学研究室传代培养于含10%胎牛血清的DMEM培养基中,置37℃、5%CO2培养箱培养。取生长状态良好、处于对数生长期HepG2细胞进行实验。以不含MTE的DMEM培养基作为空白对照组,以不同浓度MTE处理的肝癌细胞为实验组。
2.2 MTT法检测细胞增殖情况将HepG2细胞按2×104个/孔接种于96孔培养板,培养24 h后待细胞贴壁,加入低、中、高剂量MTE(终浓度为15、20、30 mg/mL),同时设空白对照组(0 mg/mL)和调零组,每组3个复孔,置CO2培养箱中继续培养24 h后,加入MTT溶液10 μL/孔,再置培养箱中培养4 h后,吸去上层清液。每孔加入100 μL DMSO,放置振荡摇床上低速震荡10 min,待产生的蓝紫色结晶溶解后,用酶标仪在490 nm处测定各孔OD值。计算抑制率:抑制率=(1-药物处理组OD值/空白对照组OD值)×100%。
2.3 Annexin V-FITC/PI双染法检测细胞凋亡将HepG2细胞按5×104个/孔接种于6孔板中,培养24 h后实验组加入不同浓度MTE(终浓度分别为15、20、30 mg/mL)。作用24 h后,用胰酶消化收集细胞,并用预冷的PBS洗涤2次。根据Annexin V-FITC/PI双染细胞凋亡检测试剂盒说明书方法,收集1×106细胞至离心管,加入500 μL的Binding Buffer悬浮细胞。加入5 μL Annexin V-FITC和5 μL PI室温下避光反应15 min。使用流式细胞仪检测细胞的凋亡率。
2.4 JC-1染色法检测细胞线粒体膜电位细胞处理同“2.3”,作用24 h后取出细胞,用0.25%胰蛋白酶消化处理细胞,PBS冲洗2次,加入0.5 mL JC-1染色工作液,颠倒数次混匀,放置37℃孵育20 min后,加入JC-1 Buffer重悬细胞2次,离心沉淀细胞,加入适量PBS重悬沉淀,采用流式细胞仪检测。绿色荧光通过FL1通道检测,红色荧光通过FL2通道检测,以红、绿荧光强度的相对比值来衡量线粒体膜电位去极化程度。
2.5 Western blotting检测细胞相关蛋白表达将处于对数生长期的HepG2细胞按1×105个/孔接种于6孔板,24 h后加入不同浓度的MTE(终浓度分别为15、20、30 mg/mL)处理24 h。离心收集细胞,向各孔加入适量PMSF裂解液,收集上清液,用BCA试剂盒测定总蛋白浓度。将定量的蛋白经10%聚丙烯酰胺凝胶(SDS-PAGE)电泳,120 V恒压1 h转移至NC膜,3%BSA于4℃封闭过夜,TTBS(Tris-HCl 20 mmol/L,pH 7.2,NaCl 150 mmol/L,吐温-20 0.1%)洗膜,分别加入Bcl-2、Bax、Cytochrome-c、Caspase-3、Caspase-9一抗与膜上抗原结合,用相应HRP标记的二抗与其反应后加ECL化学发光试剂,多功能成像分析系统采集数据并分析。以目的蛋白与内参照β-actin蛋白电泳条带的吸光度比值表示蛋白的相对表达量。
2.6 统计学方法应用SPSS 24.0软件进行数据统计分析,每组实验平行重复3次。计量资料采用(±s)表示,多组间比较采用单因素方差分析,以P<0.05为差异有统计学意义。
3 结 果
3.1 MTE对HepG2细胞增殖的影响MTT实验结果显示,经不同浓度药物处理HepG2细胞24 h后,低、中、高浓度MTE对HepG2细胞增殖均表现明显抑制作用,与空白对照组比较,差异有统计学意义(P<0.01),抑制率随药物浓度的增加而增加,呈剂量依赖效应关系。(见表1)
表1 各组HepG2细胞增殖比较(±s,n=3)
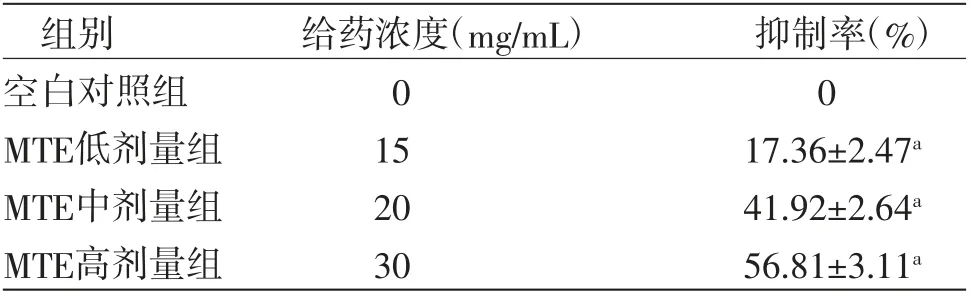
表1 各组HepG2细胞增殖比较(±s,n=3)
注:与空白对照组比较,aP<0.01
组别 给药浓度(mg/mL) 抑制率(%)空白对照组 0 0 MTE低剂量组 15 17.36±2.47a MTE中剂量组 20 41.92±2.64a MTE高剂量组 30 56.81±3.11a
3.2 MTE对HepG2细胞凋亡的影响随着MTE浓度的增加,HepG2细胞24 h后的凋亡率明显升高,并且凋亡程度呈浓度依赖性,各实验组与空白对照组比较,差异有统计学意义(P<0.01)。(见图1、表2)

图1 各组HepG2细胞凋亡情况
表2 各组HepG2细胞凋亡率比较(±s,n=3)
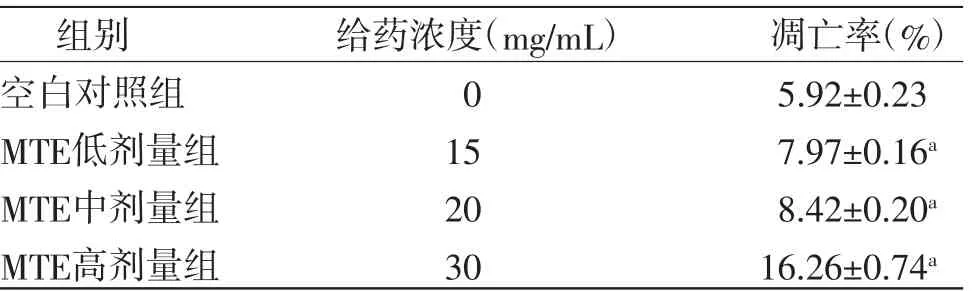
表2 各组HepG2细胞凋亡率比较(±s,n=3)
注:与空白对照组比较,aP<0.01
组别 给药浓度(mg/mL) 凋亡率(%)空白对照组 0 5.92±0.23 MTE低剂量组 15 7.97±0.16a MTE中剂量组 20 8.42±0.20a MTE高剂量组 30 16.26±0.74a
3.3 MTE对HepG2细胞线粒体膜电位的影响空白对照组HepG2细胞线粒体膜电位(FL-2/FL-1)为4.33±0.18,MTE低、中、高剂量组HepG2细胞线粒体膜电位分别下降至2.86±0.12、1.25±0.08、0.81±0.07,与空白对照组比较,差异有统计学意义(P<0.01)。(见图2)

图2 各组HepG2细胞线粒体膜电位比较(±s,n=3)
3.4 MTE对HepG2细胞相关蛋白的影响MTE低剂量组Bax表达与空白对照组比较,差异无统计学意义(P>0.05),MTE中、高剂量组可以上调Bax、Cytochrome-c、Caspase-9、Caspase-3蛋白的表达(P<0.01或P<0.05)。MTE各剂量组均可以下调Bcl-2蛋白的表达,与空白对照组比较,差异有统计学意义(P<0.05)。(见图3、表3)
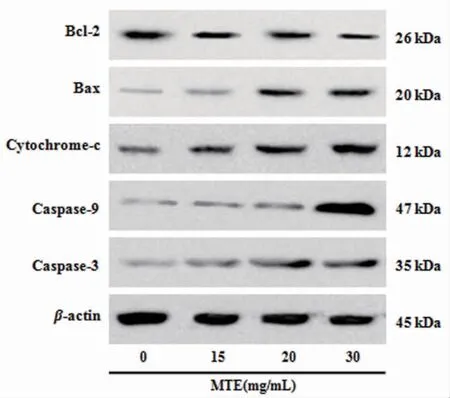
图3 各组HepG2细胞凋亡相关蛋白电泳条带
表3 各组HepG2细胞凋亡相关蛋白相对表达量比较(±s,n=3)
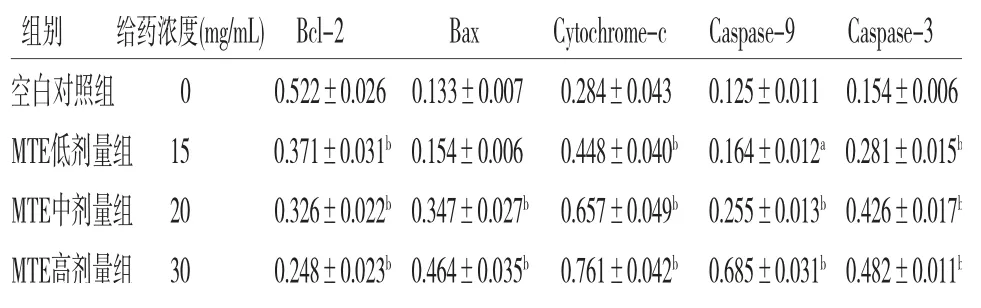
表3 各组HepG2细胞凋亡相关蛋白相对表达量比较(±s,n=3)
注:与空白对照组比较,aP<0.05,bP<0.01
组别 给药浓度(mg/mL)Bcl-2 Bax Cytochrome-c Caspase-9 Caspase-3空白对照组 0 0.522±0.026 0.133±0.007 0.284±0.043 0.125±0.011 0.154±0.006 MTE低剂量组15 0.371±0.031b 0.154±0.006 0.448±0.040b 0.164±0.012a 0.281±0.015b MTE中剂量组20 0.326±0.022b 0.347±0.027b 0.657±0.049b 0.255±0.013b 0.426±0.017b MTE高剂量组30 0.248±0.023b 0.464±0.035b 0.761±0.042b 0.685±0.031b 0.482±0.011b
4 讨 论
目前治疗晚期肝癌有效药物较少,中药因具有多靶点、多环节、副作用低等特点,在治疗肝癌方面具有很大的优势,从中药中寻找新型安全有效的抗肝癌药物已经成为研究热点[5]。通关藤具有广泛的药理活性,包括平喘、降压、免疫调节、保肝利尿等[6]。近年来,越来越多研究表明通关藤具有较强的抗肝癌活性[7-9],临床上治疗肝癌也获得较好的疗效[10-11],但探讨其具体作用机制的研究仍较少。
细胞凋亡又称程序性死亡,是细胞为维持内环境稳定,由细胞自身基因调控的细胞死亡形式[12]。肿瘤的发生不仅是分裂失控导致的细胞过度增生,同时也是细胞凋亡通路受阻,使本该死亡的细胞继续存在而产生肿瘤。在各种致癌因素作用下,基因发生突变,影响细胞增殖与死亡机制,导致细胞增殖过度,凋亡减弱,细胞数量无限增多,在病变部位堆积而形成肿瘤。细胞凋亡机制障碍既是肿瘤发生的重要早期事件,也是伴随其全程的重要病理现象[13]。目前抗肿瘤的一项重要干预策略是通过诱发肿瘤细胞凋亡,使肿瘤自然消亡。本实验结果提示,MTE处理HepG2细胞24 h后,HepG2细胞增殖明显下降,各剂量组细胞凋亡率均明显高于空白对照组,表明MTE具有诱导HepG2细胞凋亡的作用,并随着药物浓度增加,细胞凋亡率相应增加,具有一定的剂量依赖性。
目前研究认为细胞凋亡的主要途径有两条:外源性死亡受体途径和内源性线粒体凋亡途径。Bcl-2家族是线粒体凋亡途径的主要调控因子[14],包括Bcl-2、Bcl-xL等抗凋亡因子和Bax、Bak等促凋亡因子。在致凋亡因子的刺激下,Bcl-2维持线粒体膜完整性的作用下降,Bax易位至线粒体膜外,引起线粒体膜通透性发生改变,继而线粒体跨膜电位降低而去极化,线粒体基质中释放出Cytochrome-c等活性因子,Cytochrome-c进入胞质在ATP/dATP的协同作用下与凋亡蛋白酶活化因子-1(Apaf-1)结合形成寡聚体,激活Caspase-9,进而活化下游Caspase-3等酶系。激活的Caspase-3可以水解包括细胞调节、细胞信号转导、DNA修复等环节中重要的蛋白,从而导致细胞凋亡[15-16]。由此可见,在线粒体凋亡途径中,线粒体膜电位下降是细胞凋亡级联反应过程中早期发生的重要环节[17],Caspases家族在细胞凋亡的信号通路中具有中心主导作用[18],其中Caspase-3更是起着关键的功能[19],一旦Caspase-3被激活,不可避免诱发细胞凋亡。本研究结果显示,经MTE处理24 h后,HepG2细胞Bcl-2表达显著下降,Bax表达显著升高,线粒体膜电位下降,Cytochrome-c、Caspase-9、Caspase-3的表达显著上调,提示MTE能够启动内源性线粒体凋亡途径相关级联反应,诱导肿瘤细胞凋亡,从而发挥抗肿瘤作用。
