针刺对腰椎间盘突出症大鼠的镇痛作用及对ERK信号通路的影响*
2021-11-23吴苏宁郭思佳李春亮
何 力,吴苏宁,郭思佳,李春亮
(1.西宁市中医院,青海 西宁 810000;2.青海省人民医院,青海 西宁 810001)
腰椎间盘突出症为临床常见病、多发病,核心症状为神经根受压所致根性痛,机械性压迫、炎性改变为最基本病理因素[1]。西医治疗腰椎间盘突出症方法较多,包括药物、理疗、手术等,但药物、理疗仅能短时间缓解疼痛,远期效果不显著;手术并发症多,部分患者不耐受[2-3]。中医典籍中并无“腰椎间盘突出症”病名,根据症状体征可归入“痹证”“腰痛”“腰腿痛”等范畴,筋脉痹阻、腰府失养、气滞血瘀为主要病机[4]。针刺为中医传统治疗手段之一,具有舒经通络、活血化瘀、行气止痛等功效,符合腰椎间盘突出症病机[5]。但目前临床仍未具体明确针刺对腰椎间盘突出症的镇痛作用及具体机制。本研究经动物实验干预,分析针刺对腰椎间盘突出症大鼠的镇痛作用,并探讨其作用机制。
1 材料与方法
1.1 实验动物50只健康雄性SPF级SD大鼠,购自北京科兴中维生物技术有限公司,动物使用许可证号:SYXK(京)2019-0052。8周龄,体质量270~280 g。实验前在22℃恒温、50%湿度、12 h明/暗交替环境内适应性饲养7 d,自由获得饮水、饲料。本研究动物处置符合“3R”标准,经动物伦理委员会批准。
1.2 药物与试剂 盐酸利多卡因注射液(山东华鲁制药有限公司,国药准字H37022147,批号:170226);复方倍他米松注射液(比利时先灵葆雅公司,国药准字J20130084,批号:20171128);白细胞介素-1β(Interleukin-1β,IL-1β)酶联免疫吸附(ELISA)试剂盒(批号:SBJ-R0546)、肿瘤坏死因子-α(Tumor necrosis factor-α,TNF-α)酶联免疫吸附(ELISA)试剂盒(批号:SBJ-R0040)均购自南京森贝伽生物科技有限公司;HE染色试剂盒(北京博奥森生物技术有限公司,批号:C02-04004);兔抗大鼠磷酸化p38丝裂原活化蛋白激酶(phosphorylated-p38-Mitogen-activated protein kinase,p-p38 MAPK)一抗(批号:ab170099)、磷酸化胞外信号调节蛋白激酶1/2(phosphorylated-Extracellular-regulated kinase 1/2,p-ERK1/2)一抗(批号:ab2235007)、磷酸化c-Jun氨基末端激酶(phosphorylated-c-Jun N-terminal kinase,p-JNK)一抗(批号:ab124956)及山羊抗兔IgG二抗(批号:ab6721)均购自美国Abcam公司。
1.3 主要仪器 华佗牌无菌针具(江苏华佗器械有限公司,规格:0.22 mm×25 mm);BL-420S型生物机能监测仪(成都泰盟软件有限公司);MoticBA 210光学显微镜(北京汗盟紫星仪器仪表有限公司);Multiskan Sky全波长酶标仪(美国Thermo Fisher Scientific公司)。
1.4 造模与分组50只大鼠中随机取10只作为假手术组。另外40只建立腰椎间盘突出症大鼠模型[6]:术前12 h禁饮禁食,2%戊巴比妥钠50 mg/kg(0.25 mL/100 g)腹腔注射麻醉。于大鼠尾根部1 cm处,切下尾巴,切口消炎、缝合。尾部椎间盘切开,髓核取出,制备成自体髓核混悬液。随后大鼠调整为屈曲侧卧位,于L4~L5棘突间隙,9号腰椎穿刺针硬膜外穿刺。经微量注射器将自体髓核混悬液注入,随后注入2%利多卡因30 μL。建模成功标准:大鼠麻醉清醒后无步态不稳、瘫痪、足外翻等表现,两侧后足热痛刺激痛觉过敏检测显示出现对热痛刺激产生痛觉反应的现象。40只大鼠建模成功34只,成功率85.00%。34只大鼠随机分为模型组、针刺对照组、针刺组、阳性药物组,动物数分别为8只、8只、9只、9只。假手术组不进行尾椎髓核植入操作,其余步骤同模型组。
1.5 实验给药 成功建模后3 d开始治疗。阳性药物组按照大鼠与人的体表面积比例换算用药剂量,以2%利多卡因67.5 μL+倍他米松13.5 μL混合液进行左侧臀大肌注射(10 mg/kg),1次/d,连续10 d。假手术组、模型组大鼠以等量生理盐水行左侧臀大肌注射,1次/d,连续10 d。针刺组按照张露芬《实验针灸学》[7]选择穴位,包括双侧夹脊穴、关元俞穴、大肠俞穴、委中穴、昆仑穴。穴区去毛、消毒,以毫针垂直刺入,深度1~2 mm,留针30 min,期间每隔10 min行针1次,采用平补平泻法,1次/d,连续10 d;同时注射与其他组等量生理盐水,1次/d,连续10 d。针刺对照组在以上各穴位外侧约5 mm处为针刺点,并远离上述穴位所在经脉,所用针具、针刺深度、行针方法同针刺组,1次/d,连续10 d;同时注射与其他组等量的生理盐水,1次/d,连续10 d。
1.6 观察指标
1.6.1 大鼠行为学改变观察 各组大鼠均在治疗结束后隔日09∶00∶00—11∶00∶00,由固定人员按照盲法原则进行行为学检测,观察大鼠精神状态,并记录有无异常行为,如频繁摇动尾巴、撕咬肢体、以嘴反复舔后爪、后肢或足部突然自发抬起等。
1.6.2 镇痛效果检测 治疗后3 d,依据文献进行机械刺激痛阈值检测[8]:大鼠前半身包裹在小布袋内,双后肢露出。布袋放置在电子天平上,待大鼠安静后,天平调零。以1 mL注射器连接5号针头(针尖磨钝)制备成机械刺激痛阈测定器。检测时以钝针尖垂直刺激大鼠右侧后爪Ⅳ/Ⅴ趾蹼,自轻到重施压,直至大鼠出现缩爪反应或嘶叫,记录出现这些反应时天平读数,以此为机械刺激痛阈值(单位:g)。
1.6.3 感觉、运动神经传导速度检测 分别在治疗后3 d(完成机械刺激痛阈值检测后)进行感觉、运动神经传导速度检测。2%戊巴比妥钠50 mg/kg(0.25 mL/100 g)腹腔注射麻醉,以生物机能监测仪检测。感觉神经传导速度:大鼠右侧后爪内踝后内侧放置刺激电极,L1棘突头侧放置记录电极,L1棘突头侧向右1 cm处放置参考电极,臀大肌处放置接地电极,应用方波脉冲电流。参数设置:频率2.0 Hz,波宽0.1 ms,强度2~4 mA。计算机自动测量潜伏期,并自动计算刺激位置至记录位置的感觉神经传导速度。运动神经传导速度:进行经皮电刺激,分别在L1棘突、右侧臀大肌臀纹处放置第一、第二点刺激。L1棘突处放置阳极,阳极下1 cm处放置阴极,右侧后爪处放置接地电极,应用方波脉冲电流。参数设置:频率5~10 Hz,波宽0.1 ms,强度5~8 mA。计算机自动计算刺激位置至记录位置的运动神经传导速度。
1.6.4 取材及处理 完成感觉及运动神经传导速度检测后,在大鼠麻醉未清醒前,断头处死,快速打开胸腔,心脏暴露。灌注针头(50 mL针头改制)插入心尖,经左心室进入主动脉,针头固定,打开灌注装置(输液器改制)。右心耳剪开,灌注生理盐水,直至肺、肝脏颜色自深红色变为白色。随后灌注含4%多聚甲醛(0.1 mol/L)的磷酸缓冲液400 mL。灌注后根据原手术位置逐层打开,取出L4、L5背根神经节组织,分为3份。2份置于液氮保存,以备检测炎症指标及各蛋白;1份置于4%多聚甲醛固定,以备HE染色观察组织形态学改变。
1.6.5 IL-1β、TNF-α检测 采用ELISA法检测。取液氮保存背根神经节组织,按照1 g∶10 mL比例加PBS液,超声粉碎,震荡,制备匀浆。4℃10 000 r/min离心10 min,离心半径10 cm,取上清液。根据IL-1β、TNF-α试剂盒使用说明书完成操作。分别将不同程度标准品100 μL、待测样本100 μL加入相应反应孔,各孔加50 μL酶联亲和物,混匀。封板膜封板,37℃温育30 min。洗涤液洗涤30 s,冲洗5次,拍干。各孔(除空白孔)加50 μL酶标试剂,37℃温育30 min。洗涤液洗涤30 s,冲洗5次,拍干。各孔先后加50 μL显色剂A、B,震荡混匀,37℃避光显色15 min。各孔加50 μL终止液,反应10 min。20 min内观察酶标仪450 nm波长处吸光度值。分别以吸光度值、标准品浓度为纵坐标、横坐标,创建标准曲线,根据标本吸光度值获得浓度。
1.6.6 组织形态学变化检测 采用HE染色法检测。取4%多聚甲醛固定背根神经节组织,置于包埋盒,生理盐水冲洗。PBS溶液浸泡10~12 h。自动脱水机脱水,经包埋机、冰台行石蜡包埋,切片,厚度4 μm,烤片机烤干。二甲苯透明,梯度酒精脱蜡,水洗。苏木素染色5 min,加1%盐酸酒精分化渗染脱浆内剩余苏木素,流水冲洗30 min;伊红染色3 min,水洗,梯度酒精脱蜡。二甲苯透明,中性树胶封固。镜下观察脊神经根形态学变化,以NIS-ELements-BR3.1图像采集系统拍照。
1.6.7 p-p38 MAPK、p-ERK1/2、p-JNK蛋白相对表达量检测 采用蛋白质印迹法检测。取液氮保存背根神经节,PBS液清洗2次,加RIPA裂解液,冰上裂解30 min。4℃12 000 r/min离心15 min,离心半径10 min,取上清液。BCA法行蛋白定量,加上样缓冲液,沸水浴变性10 min。离心取上清,取50 μg样品10%十二烷基硫酸钠聚丙烯酰胺凝胶电泳进行蛋白分离,转至PVDF膜,加5%脱脂奶粉封闭1 h。加p-p38 MAPK(1∶1 000)、p-ERK1(1∶1 000)、p-ERK2(1∶1 000)、p-JNK(1:1 000)一抗,4℃,摇床孵育,过夜。TBST洗膜4次,每次10 min。加IgG二抗(1∶2 500),室温孵育,2 h。TBST洗膜4次,每次10 min。加ECL增强化学发光试剂,Image Quant LAS4000生物分子成像仪曝光,观察相应蛋白条带灰度值。目的蛋白表达水平=目的蛋白条带灰度值/β-actin条带灰度值。
1.7 统计学方法 采用SPSS 25.0统计软件分析数据,计量资料以“均数±标准差”(s)表示,多组比较采用单因素方差分析,两两比较采用LSD-t检验。P<0.05为差异有统计学意义。
2 结 果
2.1 大鼠行为学改变 假手术组大鼠精神状态良好,无异常行为。模型组大鼠出现频繁摇动尾巴、撕咬肢体、以嘴反复舔后爪、后肢或足部突然自发抬起等异常行为,精神状态较差,烦躁不安。针刺对照组大鼠行为学改变与模型组相似。与模型组、针刺对照组比较,针刺组、阳性药物组大鼠异常行为减少,精神状态有所缓解,其中阳性药物组大鼠改善更显著。
2.2 各组大鼠机械刺激痛阈值比较 各组大鼠机械刺激痛阈值比较,差异有统计学意义(P<0.05)。与假手术组比较,模型组、针刺对照组、针刺组、阳性药物组大鼠机械刺激痛阈值均降低(P<0.05);针刺对照组大鼠机械刺激痛阈值与模型组比较,差异无统计学意义(P>0.05);与模型组、针刺对照组比较,针刺组、阳性药物组大鼠机械刺激痛阈值均升高(P<0.05);与针刺组比较,阳性药物组大鼠机械刺激痛阈值升高(P<0.05)。(见表1)
表1 各组大鼠机械刺激痛阈值比较s,g)
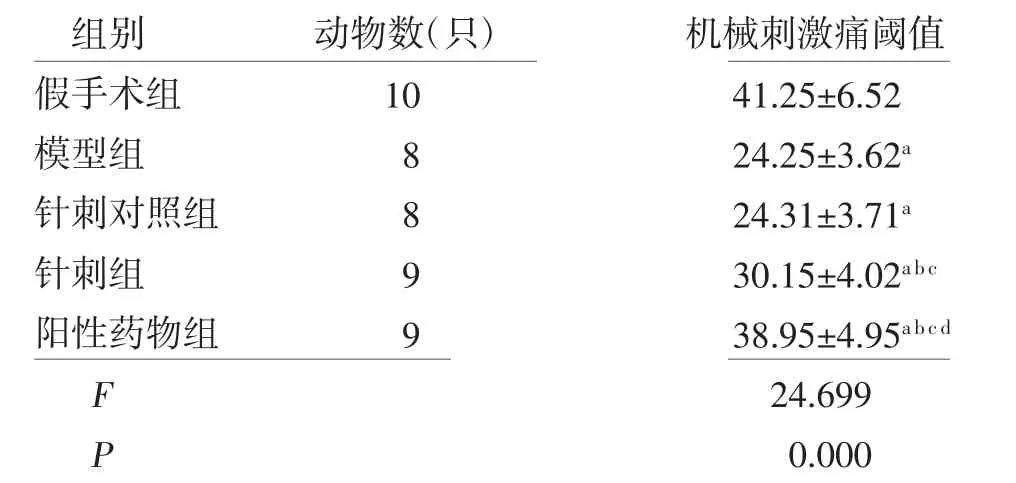
表1 各组大鼠机械刺激痛阈值比较s,g)
注:与假手术组比较,aP<0.05;与模型组比较,bP<0.05;与针刺对照组比较,cP<0.05;与针刺组比较,dP<0.05
组别 动物数(只) 机械刺激痛阈值假手术组 10 41.25±6.52模型组 8 24.25±3.62a针刺对照组 8 24.31±3.71a针刺组 9 30.15±4.02a b c阳性药物组 9 38.95±4.95a b c d F 24.699 P 0.000
2.3 各组大鼠感觉、运动神经传导速度比较 各组大鼠感觉、运动神经传导速度比较,差异有统计学意义(P<0.05)。与假手术组比较,模型组、针刺对照组、针刺组、阳性药物组大鼠感觉、运动神经传导速度均减慢(P<0.05);针刺对照组大鼠感觉、运动神经传导速度与模型组比较,差异无统计学意义(P>0.05);与模型组、针刺对照组比较,针刺组、阳性药物组大鼠感觉、运动神经传导速度均加快(P<0.05);与针刺组比较,阳性药物组大鼠感觉、运动神经传导速度的加快(P<0.05)。(见表2)
表2 各组大鼠感觉、运动神经传导速度比较s,m/s)
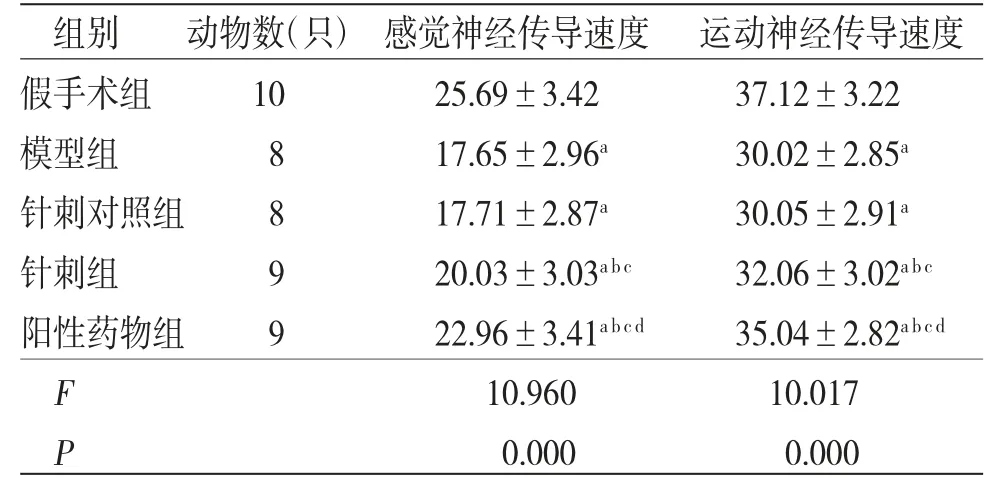
表2 各组大鼠感觉、运动神经传导速度比较s,m/s)
注:与假手术组比较,aP<0.05;与模型组比较,bP<0.05;与针刺对照组比较,cP<0.05;与针刺组比较,dP<0.05
组别 动物数(只)感觉神经传导速度 运动神经传导速度假手术组 10 25.69±3.42 37.12±3.22模型组 8 17.65±2.96a 30.02±2.85a针刺对照组 8 17.71±2.87a 30.05±2.91a针刺组 9 20.03±3.03a b c 32.06±3.02a b c阳性药物组 9 22.96±3.41a b c d 35.04±2.82a b c d F 10.960 10.017 P 0.000 0.000
2.4 各组大鼠背根神经节组织中炎症指标比较 各组大鼠背根神经节组织中IL-1β、TNF-α水平比较,差异有统计学意义(P<0.05)。与假手术组比较,模型组、针刺对照组、针刺组、阳性药物组大鼠背根神经节组织中IL-1β、TNF-α水平均升高(P<0.05);针刺对照组大鼠背根神经节组织中IL-1β、TNF-α水平与模型组比较,差异无统计学意义(P>0.05);与模型组、针刺对照组比较,针刺组、阳性药物组大鼠背根神经节组织中IL-1β、TNF-α水平均降低(P<0.05);与针刺组比较,阳性药物组大鼠背根神经节组织中IL-1β、TNF-α水平均降低(P<0.05)。(见表3)
表3 各组大鼠背根神经节组织中IL-1β、TNF-α水平比较(s)
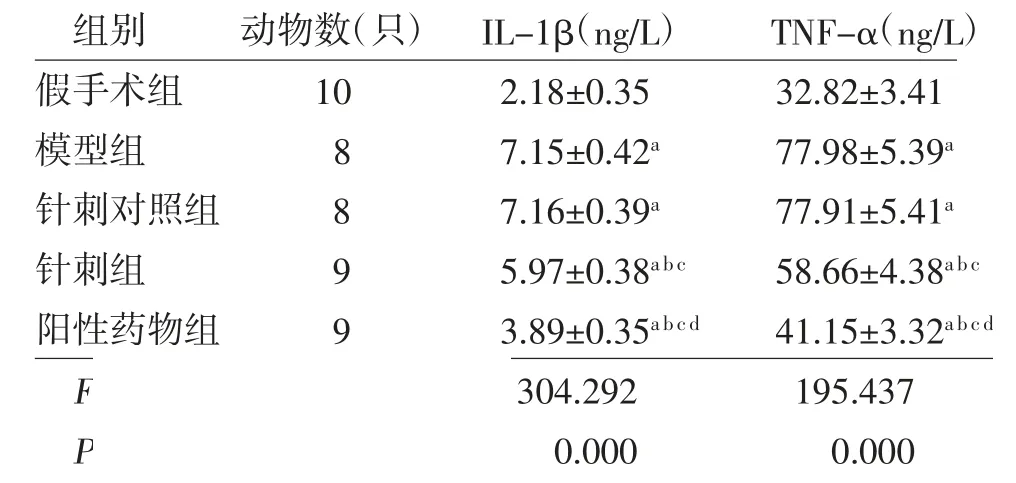
表3 各组大鼠背根神经节组织中IL-1β、TNF-α水平比较(s)
注:与假手术组比较,aP<0.05;与模型组比较,bP<0.05;与阳性药物组比较,cP<0.05;与针刺组比较,dP<0.05
组别 动物数(只)IL-1β(ng/L) TNF-α(ng/L)假手术组 10 2.18±0.35 32.82±3.41模型组 8 7.15±0.42a 77.98±5.39a针刺对照组 8 7.16±0.39a 77.91±5.41a针刺组 9 5.97±0.38a b c 58.66±4.38a b c阳性药物组 9 3.89±0.35a b c d 41.15±3.32a b c d F 304.292 195.437 P 0.000 0.000
2.5 背根神经节组织形态学改变HE染色显示,假手术组大鼠背根神经节中细胞核密度均匀,核仁清晰,胞浆中尼氏小体排列均匀;模型组大鼠背根神经节中细胞肿胀,细胞核出现不规则改变,核仁模糊,细胞浆出现空泡样改变,胞浆中尼氏小体排列不均匀;针刺对照组大鼠背根神经节组织形态学改变同模型组相似;与模型组比较,针刺组、阳性药物组大鼠背根神经节中细胞核边缘、核仁较清晰,胞浆中尼氏小体排列较均匀,胞浆空泡样改变减少,其中阳性药物组改善更显著。(见图1)
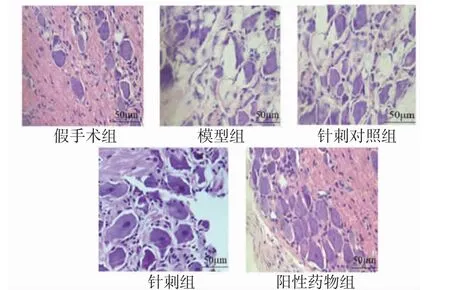
图1 各组大鼠背根神经节组织形态学改变情况(HE,×100)
2.6 各组大鼠背根神经节中p-p38 MAPK、p-ERK1、p-ERK2、p-JNK蛋白相对表达量比较 各组大鼠背根神经节中p-p38 MAPK、p-ERK1、p-ERK2、p-JNK蛋白相对表达量比较,差异有统计学意义(P<0.05);与假手术组比较,模型组、针刺对照组、针刺组、阳性药物组大鼠背根神经节中p-p38 MAPK、p-ERK1、p-ERK2、p-JNK蛋白相对表达量均升高(P<0.05);针刺对照组大鼠背根神经节中p-p38 MAPK、p-ERK1、p-ERK2、p-JNK蛋白相对表达量与模型组比较,差异无统计学意义(P>0.05);与模型组、针刺对照组比较,针刺组、阳性药物组大鼠背根神经节中p-p38 MAPK、p-ERK1、p-ERK2、p-JNK蛋白相对表达量均降低(P<0.05);与针刺组比较,阳性药物组大鼠背根神经节中p-p38 MAPK、p-ERK1、p-ERK2、p-JNK蛋白相对表达量降低(P<0.05)。(见表4、图2)

图2 各组大鼠背根神经节中p-p38 MAPK、p-ERK1、p-ERK2、p-JNK蛋白表达情况比较
表4 各组大鼠背根神经节中p-p38 MAPK、p-ERK1、p-ERK2、p-JNK蛋白相对表达量比较
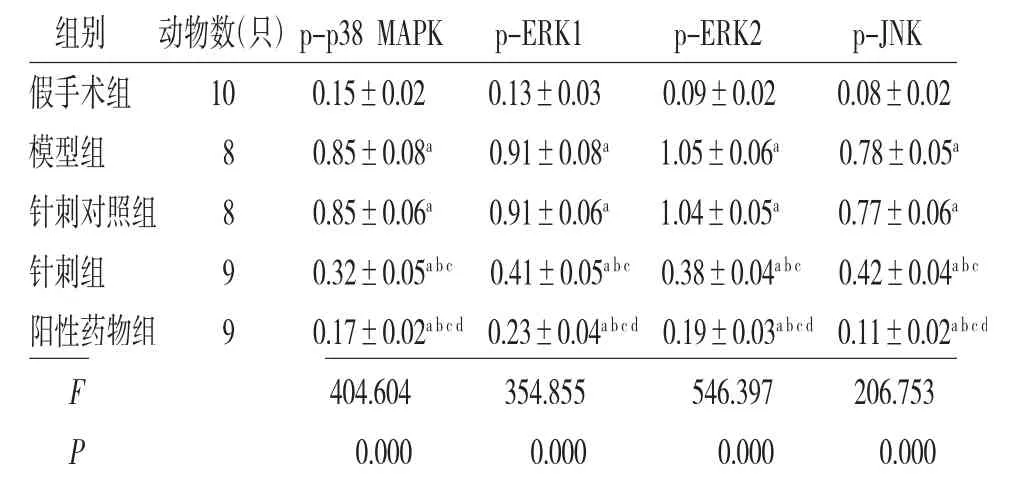
表4 各组大鼠背根神经节中p-p38 MAPK、p-ERK1、p-ERK2、p-JNK蛋白相对表达量比较
注:与假手术组比较,aP <0.05;与模型组比较,bP<0.05;与阳性药物组比较,cP<0.05;与针刺组比较,dP<0.05
组别 动物数(只)p-p38 MAPK p-ERK1 p-ERK2 p-JNK假手术组 10 0.15±0.02 0.13±0.03 0.09±0.02 0.08±0.02模型组 8 0.85±0.08a 0.91±0.08a 1.05±0.06a 0.78±0.05a针刺对照组 8 0.85±0.06a 0.91±0.06a 1.04±0.05a 0.77±0.06a针刺组 9 0.32±0.05a b c 0.41±0.05a b c 0.38±0.04a b c 0.42±0.04a b c阳性药物组 9 0.17±0.02a b c d 0.23±0.04a b c d 0.19±0.03a b c d 0.11±0.02a b c d F 404.604 354.855 546.397 206.753 P 0.000 0.000 0.000 0.000
3 讨 论
腰椎间盘突出症主要是受慢性劳损、急性损伤、椎间盘退行性病变等因素影响,致髓核突出,纤维环破裂,继而压迫血管、神经造成的以腰腿痛为主要表现的疾病[9-10]。近年来,腰椎间盘突出症患病率升高,且发病呈年轻化趋势,严重影响人们日常生活、工作。手术治疗可能给脊柱造成较大损伤,且手术创面大,并发症多,部分患者不易接受。因此,腰椎间盘突出症治疗方法中,非手术治疗占首要地位。局部应用麻醉药物、硬膜外腔糖皮质激素注射等西医非手术疗法虽可在短期内缓解疼痛程度,但长期疗效仍受争议,且西药长时间应用还可能导致不良反应[11]。中医针刺能调节突出髓核、受压神经根位置,使突出髓核萎缩减小,缓解神经根机械压迫,且不良反应少,安全性高。研究[12]表明,针刺具有良好镇痛功效,这与改善全身血液循环、减轻局部炎症及水肿等作用有关。但目前中医针刺对腰椎间盘突出症的镇痛作用及机制尚不明确。
有研究[13]显示,针刺能促使血浆β-内啡肽活性提高,减弱痛觉过敏状态,阻断疼痛回路,发挥镇痛作用。有学者提出,针刺腰椎间盘突出症患者夹脊穴,可改善镇痛评分,获得显著镇痛效果[14]。孙钰等[15]按照腰椎间盘突出症患者分期,分别采用扬刺、齐刺、傍刺法治疗,发现疼痛程度明显减轻,取得较好疗效。本研究针刺治疗所选穴位包括双侧夹脊穴、关元穴、大肠俞穴、委中穴、昆仑穴,具有通络化瘀、行气止痛、温通经脉之功效。本研究结果显示,针刺治疗后大鼠机械刺激痛阈值及感觉、运动传导速度增加,行为学、背根神经节组织形态学异常改变减轻,IL-1β、TNF-α水平降低。这提示针刺治疗可发挥镇痛作用,促使神经传导速度趋于正常,减轻炎症反应。赵丽云等[16]也发现,腰椎间盘突出症大鼠经针刺治疗可改善机械痛觉触觉阈值,减轻脊神经根、背根神经节损伤程度,与本研究共同证实了针刺的镇痛功效。
ERK通路是一种介导细胞反应的重要信号通路,可经由将细胞外刺激信号向细胞内传导,磷酸化下游底物,影响细胞的分化、增殖过程,相关蛋白包括p38 MAPK、ERK1/2、JNK等。有学者发现,ERK信号通路在神经可塑性、炎症反应发生中发挥重要作用,且参与神经痛的痛觉过敏、痛觉异常形成及维持过程[17]。相关实验还发现,背根神经节p38 MAPK/ERK信号通路激活,为髓核引发背根神经节神经痛、炎症反应的必需过程[18]。这些研究均提示ERK信号通路可能在腰椎间盘突出症疼痛发生及控制中有一定作用。本研究发现,针刺可促使大鼠背根神经节中p-p38 MAPK、p-ERK1、p-ERK2、p-JNK蛋白相对表达量降低,提示针刺治疗可抑制腰椎间盘突出症大鼠ERK信号通路,推测这可能是针刺发挥镇痛作用的重要机制之一。
综上所述,针刺对腰椎间盘突出症大鼠有一定镇痛作用,可改善神经传导速度,缓解炎症反应,减轻背根神经节损伤。作用机制可能与抑制ERK信号通路有关。本研究也存在不足之处,如所选腰椎间盘突出症大鼠数量略少,可能影响结论可靠性;应用的动物模型由机械损伤诱导,与人体腰椎间盘突出病理过程有一定区别,今后需探索更好的动物模型。另外,针刺对腰椎间盘突出症大鼠镇痛作用的其他机制尚不明确,今后仍需进一步分析。
