基于SIRT1通路茶黄素对慢性间歇低氧幼鼠气道损伤及重塑的作用机制研究*
2021-11-23张冰洁邓敏超张晓枫
张冰洁,邓敏超,魏 农,张晓枫
(江南大学附属医院,江苏 无锡 214100)
阻塞性睡眠呼吸暂停(obstructive sleep apnea,OSA)是一种以慢性间歇低氧为基本病理生理特征的肺部疾病,表现为睡眠中气道反复塌陷(部分或全部),出现慢性间歇低氧与睡眠片段化。OSA往往与慢性气道疾病并存,比如支气管哮喘患者常合并OSA,但因哮喘症状掩盖而影响OSA的诊疗,长期可加重哮喘病情,引起气道损伤甚至重塑[1]。近些年发现提取自植物中的黄酮类化合物对OSA、哮喘等肺部疾病有明显作用,其中红茶中提取的茶黄素有良好的清除自由基、抗氧化、改善微循环等功效,同时对免疫调节、炎症等亦有积极作用[2]。然而,茶黄素的药理研究尚停留于实验阶段,关于其用于哮喘、OSA等肺部疾病中的作用及其机制报道鲜见。故本实验模拟OSA的病理生理基础,建立慢性间歇低氧幼鼠模型,并用茶黄素干预,观察茶黄素对慢性间歇低氧幼鼠气道损伤与重塑的作用,探讨可能的作用机制,旨在为临床治疗慢性间歇低氧诱发的肺部疾病提供借鉴。
1 材料与方法
1.1 实验动物38只3周龄SPF级健康雄性SD大鼠,体质量50~60 g,购自北京斯贝福生物技术有限公司,生产许可证号:SCXK(京)2019-0010。实验开展前适应性饲养1周,单笼饲养,温度(24±2)℃,湿度40%~60%,自然光照,自由摄食水。本实验中大鼠均为脱颈处死,实验操作符合一般动物实验伦理学原则,经医学实验动物管理委员会批准。
1.2 药物与试剂 茶黄素(上海一基生物试剂有限公司,批号:20181225,纯度>99%);沉默信息调节因子1(silent information regulator1,SIRT1)抑制剂Nicotinamide(北京百奥莱博科技有限公司,批号:20191109,纯度>99.5%,用时以生理盐水溶解);丙二醛(malondialdehyde,MDA)ELISA试剂盒(批号:20190516)、超氧化物岐化酶(superoxide dismutase,SOD)ELISA试剂盒(批号:20190519)均购自南京森贝伽生物科技有限公司;血管内皮生长因子(vascularendothelialgrowthfactor,VEGF)ELISA试剂盒(批号:20191022)、基质金属蛋白酶-9(matrix metalloproteinase-9,MMP-9)ELISA试剂盒(批号:20190908)均购自武汉菲恩生物科技有限公司;金属蛋白酶抑制剂-1(tissue inhibifor of metalloproteinase-1,TIMP-1)ELISA试剂盒(上海仁捷生物科技有限公司,批号:20190214);兔抗小鼠腺苷酸活化蛋白激酶(adenosine monophosphate activated protein kinase,AMPK)一抗(批号:20191102)、磷酸化AMPK(p-AMPK)一抗(批号:2019000815)、SIRT1一抗、过氧化物酶增殖激活受体-γ共激活子-1α(peroxisome-proliferatoractivated receptor-γcoactivator-1α,PGC-1α)一抗(批号:20191214)、GAPDH一抗(批号:20190908)均购自上海联迈生物工程股份有限公司;辣根过氧化物酶标记的山羊抗兔IgG二抗(碧云天生物技术有限公司,批号:20191017)。
1.3 主要仪器CYE-Ⅱ型氧、二氧化碳气体测定仪(上海嘉定学联仪表厂);间歇低氧舱、空气模拟对照舱(自制,不锈钢为主体,舱盖中间为玻璃,气体钢瓶、流量计、减压阀、控制程序、电磁阀、继电器、显示器等组成控制系统,间歇低氧舱大小为125 cm×48 cm×24 cm,侧壁进气、排气单向阀各4个,空气模拟对照舱大小60 cm×48 cm×24 cm,侧壁进气、排气单向阀各2个,舱内压力保持常压);医用压缩氧气(浓度>99.5%)、压缩高纯度氮气(浓度>99.9%)(温州市医用氧厂);4V330V-10型电磁阀(宁波亚德客自动化工业有限公司);EXL-808型酶标仪(美国BioTeK公司)。
1.4 造模与分组38只SD健康幼鼠留取8只作空气对照组,其余建造慢性间歇低氧幼鼠模型[3]:将幼鼠置于间歇低氧舱内,将99.9%高纯度氮气、99.5%医用氧气交替输入舱内,1次低氧-复氧循环为90 s,具体操作如下:通氮气30 s(压力0.3 kPa),停30 s,通氧气12 s(氧流量25 L/min),停18 s,停止通气期间由测氧仪分别检测间歇低氧舱中氧浓度最高值、最低值。低氧浓度保持在7.8%左右,复氧浓度保持在21.0%左右,CO2浓度<0.01%,湿度(50±10)%。每天舱内实验时间为7.5 h(08:50:00—16:20:00)。空气对照组幼鼠置于空气模拟对照舱内,通压缩空气,由同一个单片机程控,条件同造模幼鼠。实验期间舱上盖厚布模拟黑夜,创造舱内黑夜条件,引导幼鼠进入睡眠状态。每天出舱后,置于日光灯下模拟白天,饮食、活动不限。1次/d,连续低氧干预4周。30只造模幼鼠分为模型组、抑制剂组、茶黄素组,每组10只。
1.5 实验给药 茶黄素组幼鼠每天在进入间歇低氧舱前0.5 h腹腔注射60 μg/mL茶黄素[4],抑制剂组幼鼠腹腔注射茶黄素60 μg/mL后,再腹腔注射SIRT1抑制剂Nicotinamide 20 mg/kg[5],均以生理盐水溶解至0.2 mL,模型组与空气对照组幼鼠腹腔注射等体积生理盐水。1次/d,连续2周,观察幼鼠一般状况。
1.6 实验取材 干预4周后进行1%戊巴比妥钠麻醉,股动脉取血,4℃3 000 r/min离心10 min,离心半径10 cm,取上清,分装放置后冻存在-80℃冰箱,用于MMP-9、TIMP1、VEGF检测;打开胸腔,暴露并游离肺组织,取右下肺叶组织,10%中性甲醛固定后进行病理检测;取右肺上叶组织液氮冷冻,用于ELISA与Western blotting检测。用注射器灌洗左肺,匀速注入左肺4 mL的0.9%无菌氯化钠溶液,反复回抽3次后,收集肺泡灌洗液(bronchoalveolar lavage fluid,BALF),1 000 r/min离心10 min,离心半径10 cm,取其沉淀待测细胞计数。
1.7 观察指标
1.7.1 幼鼠BALF中细胞计数 离心BALF后取沉淀细胞,以0.9%无菌氯化钠溶液200 μL混匀,取20 μL细胞混悬液,以380 μL冰醋酸混匀,再次吸取20 μL混悬液,在血细胞计数板中用高倍显微镜计数有核细胞总数及淋巴细胞、嗜酸性粒细胞、中性粒细胞。
1.7.2 ELISA法检测幼鼠肺组织MDA含量与SOD活力 取部分离体右肺上叶组织,4℃生理盐水漂洗,用滤纸吸干水分,称取1 g湿重肺组织,以4℃生理盐水4 mL混匀,用玻璃匀浆器制备成匀浆,每次10 s,间隙30 s,共3~5次,冰水中操作。3 500 r/min离心15 min,离心半径10 cm,取上清液,参考MDA、SOD ELISA试剂盒说明书,稀释标准品,设置空白孔、标准孔、待测样品孔并加样,37℃温育30 min,配液后洗涤,除空白孔外每孔加入酶标试剂,温育,洗涤,显色,终止,在450 nm波长处测定各孔吸光度值(OD值),重复实验3次,取平均值。
1.7.3 HE染色观察幼鼠肺组织病理 取10%中性甲醛固定的肺组织,脱水,透明,石蜡包埋,修剪蜡块后连续切片,厚度约为4 μm。切片脱蜡复水后,苏木精染色15 min,用自来水冲洗,提插数次,以75%盐酸乙醇分化30 s,温水(50℃左右)浸泡5 min,置入伊红液2 min,常规脱水,透明,封片。图像分析炎性指数,(×200)镜下计数炎症细胞,每张切片随机抽取10个视野,取计数平均值。评定标准:无肺泡炎,计1分;轻度肺泡炎,肺泡隔增宽,病变范围<20%,计2分;中度肺泡炎,病变范围占20%~50%,计3分;重度肺泡炎,病变范围>50%,弥漫性分布,计4分。
1.7.4 ELISA检测血清VEGF、MMP-9、TIMP-1含量 取冻存的股动脉血清,参考VEGF、MMP-9、TIMP-1 ELISA试剂盒说明书进行检测:设置标准孔、待测样品孔与空白孔,每待测样品孔中加入100 μL样品,37℃温箱中加入反应板2 h,弃液,滤纸印干洗涤反应板。每孔加入100 μL酶标试剂,37℃温箱置入反应板1 h,洗板。每孔加入100 μL底物液,暗处反应,每孔加入50 μL终止液终止,450 nm处测量各孔OD值,计算VEGF、MMP-9、TIMP-1含量。
1.7.5 Western blotting检 测 幼 鼠 肺 组 织AMPK、p-AMPK、SIRT1、PGC-1α蛋白表达 取另一部分离体右肺上叶组织,用匀浆器研碎,加入RIPA裂解液,12 000 r/min离心15 min,离心半径10 cm,取上清。BCA法提取总蛋白,蛋白、上样缓冲液混匀,沸水浴变性10 min,冷却后取50 μg蛋白进行SDS-PAGE电泳,转膜,5%脱脂奶粉封闭2 h。条带浸入一抗(AMPK稀释1∶500、p-AMPK稀释1∶1 000、SIRT1稀释1:500、PGC-1α稀释1∶500、GAPDH稀释1∶1 000)中,4℃孵育过夜,次日加HRP标记的羊抗兔二抗(稀释1∶2 000),室温孵育2 h,取出聚偏二氟乙烯膜,PBS清洗3次,进行化学发光检测,Quatity One凝胶软件分析系统分析蛋白条带灰度值。
1.8 统计学方法 采用SPSS 25.0统计软件分析实验数据,细胞计数、MDA浓度、SOD浓度、炎症评分等计量资料以“均数±标准差”(s)表示,进行Levene与方差齐性检验,若方差齐,行单因素方差分析与LSD-t比较,不齐则进行Welch检验与Dunnett T3比较。P<0.05为差异有统计学意义。
2 结 果
2.1 幼鼠一般状况8只空气对照组幼鼠实验过程中精神良好,毛发有光泽,进食、排便正常,体质量正常增长,未闻及异常呼吸音;30只造模幼鼠出现口唇发绀、呼吸急促、站立不稳等症状,表明造模成功。模型组幼鼠随干预时间延长,上述表现日益明显,且精神萎靡、毛色黄无光泽、进食减少、体质量增长缓慢,轻者气喘,重者闻及喉间痰鸣音。茶黄素组、抑制剂组幼鼠精神、毛发、进食与排便等情况有所改善。
2.2 各组幼鼠BALF中细胞计数比较 与空气对照组比较,模型组、抑制剂组、茶黄素组幼鼠BALF中细胞总数及嗜酸性粒细胞、淋巴细胞、中性粒细胞计数明显增加(P<0.05);与模型组比较,抑制剂组、茶黄素组幼鼠BALF中细胞总数及嗜酸性粒细胞、淋巴细胞、中性粒细胞计数明显减少(P<0.05);与抑制剂组比较,茶黄素组幼鼠BALF中细胞总数及嗜酸性粒细胞、淋巴细胞、中性粒细胞计数明显减少(P<0.05)。(见表1)
表1 各组幼鼠BALF中细胞计数比较s,×106/L)

表1 各组幼鼠BALF中细胞计数比较s,×106/L)
注:与空气对照组比较,aP<0.05;与模型组比较,bP<0.05;与抑制剂组比较,cP<0.05
组别 动物数(只) 给药剂量 细胞总数 嗜酸性粒细胞 淋巴细胞 中性粒细胞空气对照组 8 - 9.64±1.28 0.55±0.07 1.23±0.04 0.25±0.04模型组 10 - 35.41±3.56a 3.52±0.11a 2.95±0.07a 0.99±0.08a抑制剂组 10 茶黄素60 μg/mL+Nicotinamide 20 mg/kg 22.16±2.89a b 2.44±0.13a b 2.22±0.05a b 0.74±0.09a b茶黄素组 10 60 μg/mL 14.66±1.77a b c 1.72±0.16a b c 1.78±0.06a b c 0.52±0.05a b c F 58.473 314.062 502.889 64.108 P 0.000 0.000 0.000 0.000
2.3 各组幼鼠肺组织MDA含量、SOD活力比较 与空气对照组比较,模型组、抑制剂组、茶黄素组幼鼠肺组织中MDA含量均明显升高、SOD活力均明显降低(P<0.05);与模型组比较,抑制剂组、茶黄素组幼鼠肺组织中MDA含量均明显降低、SOD活力均明显升高(P<0.05);与抑制剂组比较,茶黄素组幼鼠肺组织中MDA含量明显降低、SOD活力明显升高(P<0.05)。(见表2)
表2 各组幼鼠肺组织MDA含量、SOD活力比较

表2 各组幼鼠肺组织MDA含量、SOD活力比较
注:与空气对照组比较,aP<0.05;与模型组比较,bP<0.05;与抑制剂组比较,cP<0.05
组别 动物数(只) 给药剂量 MDA(nmol/mg)SOD(U/mg)空气对照组 8 - 5.77±0.45 139.94±2.98模型组 10 - 12.69±0.23a 96.42±3.67a抑制剂组 10茶黄素60 μg/mL+Nicotinamide 20 mg/kg 10.12±0.17a b 112.66±2.69a b茶黄素组 10 60 μg/mL 8.64±0.21a b c 125.39±4.74a b c F 305.248 79.053 P 0.000 0.000
2.4 各组幼鼠肺组织病理变化情况HE染色肺组织病理切片可见:空气对照组幼鼠气道黏膜正常,气道壁未见增厚,无炎症细胞浸润,未见明显上皮细胞脱落;模型组幼鼠气管壁增厚,可见大量上皮细胞脱落,大量炎症细胞浸润。与模型组比较,抑制剂组、茶黄素组幼鼠气管壁增厚、上皮细胞脱落、炎症细胞浸润程度等有所减轻。(见图1)

图1 各组幼鼠肺组织病理切片图(HE染色,×400)
与空气对照组比较,模型组、抑制剂组、茶黄素组幼鼠肺组织炎症评分均明显升高(P<0.05);与模型组比较,抑制剂组、茶黄素组幼鼠肺组织炎症评分均明显降低(P<0.05);与抑制剂组比较,茶黄素组幼鼠肺组织炎症评分明显降低(P<0.05)。(见图2)

图2 各组幼鼠肺组织炎症评分比较
2.5 各组幼鼠血清VEGF、MMP-9、TIMP-1含量比较 与空气对照组比较,模型组幼鼠血清VEGF、MMP-9、TIMP-1含量均明显升高(P<0.05);与模型组比较,抑制剂组、茶黄素组幼鼠血清VEGF、MMP-9、TIMP-1含量均明显降低(P<0.05);与抑制剂组比较,茶黄素组幼鼠幼鼠血清VEGF、MMP-9、TIMP-1含量均明显降低(P<0.05)。(见图3)

图3 各组幼鼠血清VEGF、MMP-9、TIMP-1含量比较
2.6 各组幼鼠肺组织AMPK、p-AMPK、SIRT1、PGC-1α蛋白表达比较 与空气对照组比较,模型组幼鼠肺组织p-AMPK、SIRT1、PGC-1α蛋白相对表达量明显降低(P<0.05);与模型组比较,抑制剂组、茶黄素组幼鼠肺组织p-AMPK、SIRT1、PGC-1α蛋白相对表达量明显升高(P<0.05);与抑制剂组比较,茶黄素组幼鼠肺组织p-AMPK、SIRT1、PGC-1α蛋白相对表达量明显升高(P<0.05)。4组幼鼠肺组织AMPK蛋白相对表达量比较,差异无统计学意义(P>0.05)。(见图4~5)

图4 各组幼鼠肺组织AMPK、p-AMPK、SIRT1、PGC-1α蛋白表达Western blotting图
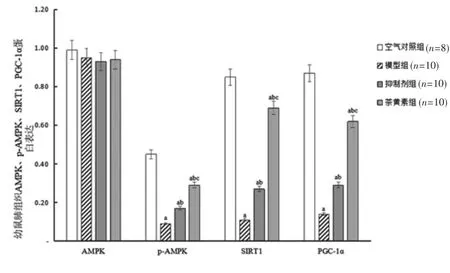
图5 各组幼鼠肺组织AMPK、p-AMPK、SIRT1、PGC-1α蛋白相对表达量比较(x±s)
3 讨 论
慢性间歇低氧指的是反复低氧、复氧交替过程,可激发呼吸、内分泌、神经等一系列病理生理改变,其所致肺损伤是哮喘、OSA等疾病发作的基本始动环节。有研究[6]认为,慢性间歇低氧可能通过系统性炎症、氧化应激等途径致病。中医对慢性间歇低氧的研究尚处于起步阶段,关于其诱发的气道损伤与重塑可归为“肺胀”范畴,主要从虚、瘀等方面进行辨证论治,但对慢性间歇低氧的基础研究较少。然而,因慢性间歇低氧属于特殊类型缺氧,而有抗缺氧效果的中药较多,故可借其抗缺氧效应用于研究。近年来,现代药理学研究发现,茶黄素生物学作用广泛,不仅有抗病毒、抑菌、抗癌、抗炎、抗黏液高分泌、免疫调节等药理作用,还是一种极为有效的抗氧化剂、自由基清除剂,在食品与医药保健等领域上的地位日渐突出[7]。茶黄素用于慢性间歇低氧致气道损伤与重塑治疗,取得了一定成效。
慢性间歇低氧可诱发慢性炎症长期刺激,损伤气道壁,出现气道高反应性与气流阻塞等情况,从而导致气道重塑,主要表现为炎症细胞浸润、气道平滑肌增厚等[8]。本研究结果显示:与模型组比较,茶黄素组幼鼠BALF中细胞总数及嗜酸性粒细胞、淋巴细胞、中性粒细胞计数减少,提示茶黄素可减轻幼鼠肺部炎症细胞浸润。气道重塑与炎症细胞、炎症因子长期存在所致气道炎症及慢性炎症引起的氧化应激存在密切关系[9]。SOD是肺部内源性抗氧自由基损伤系统的重要物质,对机体氧化、抗氧化平衡有重要作用,测量肺部SOD浓度可间接反映氧自由基对肺组织细胞的损伤程度[10];MDA是氧自由基代谢产物,能反映肺组织膜完整性受破坏程度[11]。本研究中,与模型组比较,茶黄素组幼鼠MDA含量降低、SOD活力升高,提示茶黄素可增强SOD活力,发挥抗氧化应激作用。气道重塑由多种细胞因子参与,如MMP-9、VEGF、TIMP-1等。MMP-9是调节细胞外基质代谢的主要限速酶,在正常肺组织内几乎不表达,可通过降解生长因子前体,激活生长因子,致气道平滑肌增殖、肥厚,重塑气道[12]。TIMP-1是MMP-9的主要抑制剂,可通过特异性抑制MMP-9生物学活性,增加细胞外基质沉积同时减少其降解,造成气道重塑[13]。气道炎症及气道重塑等均与VEGF相关,VEGF在OSA、哮喘等患者中表达明显升高。药物处理降低VEGF表达,可减轻机体肺部病理改变,提示气道炎症性损伤及重塑与VEGF有关[14]。本研究通过观察幼鼠肺组织病理切片发现,与模型组比较,茶黄素组幼鼠气管壁增厚、上皮细胞脱落、炎症细胞浸润等病理反应减轻,且肺组织炎症评分降低,提示茶黄素可减轻气道炎症,保护气管结构完整,改善气道重塑。
SIRT1是目前研究最深入的Sirtuin蛋白,可与多种重要转录因子、转录共调控因子互相作用,经乙酰化作用调节基因转录、靶蛋白活性,从而参与衰老、代谢等发生发展,而这些过程多与缺氧有关。XUR Y等[15]发现白藜芦醇可通过上调SIRT1表达减轻心肌缺氧/复氧诱导的细胞凋亡,推测SIRT1表达上调可能抑制细胞凋亡。PGC-1α在诱导细胞凋亡与炎症反应中发挥着重要作用,与氧化应激关系最密切。HUANG J等[16]通过动物实验发现上调PGC-1α与SIRT1表达可减轻氧化应激损伤,提示PGC-1α与SIRT1表达上调可能减轻氧化应激损伤,并抑制氧化应激损伤所致炎症与细胞凋亡。AMPK被认为是应激反应酶,在能量缺乏情况下(如缺氧/复氧)被激活,可产生急性效应,辅助完成抗应激反应、维持生存的细胞行为[17]。AMPK在应激状态下被激活,对细胞有保护作用,HUANGX T等[18]研究表明Galectin-1可通过AMPK-Nrf2途径抑制肺部炎症反应与氧化应激,说明AMPK参与了肺部炎症反应、氧化应激过程。本研究结果显示,与空气对照组比较,模型组幼鼠肺组织中p-AMPK、SIRT1、PGC-1α蛋白表达下调,提示慢性间歇低氧可能通过抑制AMPK/SIRT1/PGC-1α通路造成气道损伤与重塑;与模型组比较,抑制剂组、茶黄素组幼鼠肺组织中p-AMPK、SIRT1、PGC-1α蛋白表达上调,且茶黄素组高于抑制剂组,提示茶黄素可能通过激活AMPK/SIRT1/PGC-1α通路减轻慢性间歇低氧导致的气道损伤,抑制气道重塑。
综上所述,茶黄素可能是通过上调AMPK/SIRT1/PGC-1α通路减轻慢性间歇低氧幼鼠气道损伤、抑制气道重塑,为临床研发、应用茶黄素提供了实验依据,对开辟慢性间歇低氧所致气道损伤与重塑的治疗提供了新方法。
