紫苏叶多糖通过Wnt/PCP通路对慢阻肺大鼠气道炎症反应及气道重塑的作用研究*
2021-11-23王文静刘雪梅张桂琴
王文静,刘雪梅,张桂琴
(包头市第四医院,内蒙古 包头 014030)
慢性阻塞性肺疾病(chronic obstructive pulmonary disease,COPD)是常见慢性呼吸道疾病,主要特征为气流持续受限、肺功能下降,临床表现为咳嗽、呼吸困难等。本病病程长,易反复发作,后期可引起慢性肺源性心脏病、呼吸衰竭等多种并发症,严重危害人类生命健康[1]。气道重塑是COPD的基本病理特征,是导致气道狭窄及肺功能下降的重要因素[2]。目前临床尚缺乏有效抑制气道重塑的药物,探索有效治疗药物对于延缓COPD进展、抑制气道重塑具有重要意义。紫苏是常用传统中药,已有研究证实,紫苏在COPD中具有抗炎作用,可延缓疾病进展[3]。紫苏叶是紫苏的重要药用部位,含有丰富维生素和蛋白质,具有较高食用和保健价值[4]。多糖是紫苏叶重要活性成分之一,目前关于其对COPD是否有效报道尚少。本研究通过建立COPD大鼠模型,拟探讨紫苏叶多糖对COPD的影响及可能作用机制,为临床治疗COPD提供实验参考。
1 材料与方法
1.1 实验动物8周龄SPF级健康雄性SD大鼠50只,体质量200~220 g,购自上海斯莱克实验动物有限责任公司,生产许可证号:SCXK(沪)2017-0005。购入后饲养于内蒙古自治区药品检验研究院,使用许可证号:SYXK(蒙)2016-0004,保持温度22~24℃,湿度50%~60%,明暗循环12 h/12 h,适应性饲养7 d,饲喂标准鼠粮及纯净水,大鼠自由采食饮水。实验严格遵守《实验动物管理条例》,确保动物福利伦理,经医学实验动物管理委员会审核批准,伦理审批号:BT201800036。
1.2 药物与试剂 紫苏叶多糖(陕西斯诺特生物科技有限公司,纯度:98%,批号:2018112506);中南海牌过滤嘴香烟(北京卷烟厂,批号:118204);无翅型MMTV整合位点家族(wingless-type MMTV integration site family,Wnt)激动剂氯化锂(lithium chloride,LiCl)(美国Sigma公司,批号:213233);脂多糖(lip opolysacchari de,LPS)(北京索莱宝科技有限公司,批号:L2280);大鼠白介素-8(interleukin-8,IL-8)ELISA试剂盒(批号:SEKR-0071)、肿瘤坏死因子-α(tumor necrosis factor-α,TNF-α)ELISA试剂盒(批号:YM-A7056)均购自北京索莱宝科技有限公司);兔抗大鼠Wnt5a抗体(批号:ab227229)、ras同源蛋白A(ras-homologous A,RhoA)抗体(批号:ab187027)、c-Jun氨基末端激酶(c-Jun N-terminal kinases,JNK)抗体(批号:ab126424)、p-JNK抗体(批号:ab2074477)均购自美国Abcam公司)。
1.3 主要仪器FlexiVent动物肺功能仪(加拿大SCIREQ公司);JJ-12J脱水机和JB-P5包埋机(武汉俊杰电子有限公司);RM2016病理切片机(德国徕卡公司);BA210T显微镜(麦克奥迪实业集团有限公司);164-5056电泳仪(美国Bio-Rad公司)。
1.4 造模与分组 取40只大鼠,参照文献[5],采用烟熏联合气管滴入LPS复合法建立COPD大鼠模型。烟熏方法:自制有机玻璃烟熏箱,四周留直径约1.5 cm的排气孔,燃烧12支香烟,每次约10 min,间隔2 h,再燃烧1次。气管内注入LPS:腹腔注射1%戊巴比妥钠(40 mg/kg)麻醉大鼠,颈部消毒,切开皮肤后分离皮下组织,暴露气管,向气管内注入200 μL(1 μg/μL)LPS,注射完毕后使大鼠直立并左右旋转,使LPS均匀分散至肺中,缝合皮肤,消毒创口。分别于实验的第1天和第15天,气管各注入1次LPS,其余时间每天将大鼠放入烟熏箱内按上述方法进行烟熏,共持续4周。实验过程中,大鼠表现为精神萎靡,毛发无光泽并发生脱落,少动,呼吸急促,出现明显咳嗽症状,表示造模成功,本实验所有大鼠均造模成功。造模成功大鼠随机分为模型组、LiCl组、紫苏叶多糖组、紫苏叶多糖+LiCl组,每组10只。另取10只大鼠作为假手术组,采用相同方法暴露气管,注入等量生理盐水,不进行烟熏。
1.5 实验给药 末次烟熏后24 h,LiCl组大鼠皮下注射LiCl,60 mg/kg,并灌胃生理盐水;紫苏叶多糖组大鼠皮下注射生理盐水,并灌胃紫苏叶多糖,20 mg/kg;紫苏叶多糖+LiCl组大鼠皮下注射LiCl,60 mg/kg,并灌胃紫苏叶多糖,20 mg/kg;假手术组和模型组大鼠皮下注射并灌胃等量生理盐水,1次/d,连续4周。
1.6 观察指标
1.6.1 肺功能 末次干预后2 h,麻醉大鼠,颈部备皮,暴露气管,进行气管插管,采用肺功能仪检测用力肺活量(forced vital capacity,FVC),1秒用力呼气容积(forced expiratory volume in one second,FEV1),呼气峰流速(peak expiratory flow,PEF)。
1.6.2 IL-8、TNF-α水平 肺功能检测完毕后,随机取5只大鼠,结扎右支气管,用注射器抽取10 mL生理盐水,分3次灌洗,30 s后缓慢回抽,收取肺泡灌洗液(bronchoalveolar lavage fluid,BALF),回收率>80%。1 500 r/min,4℃离心10 min,取上清,按照ELISA试剂盒说明书进行操作,使用酶标仪读取450 nm吸光度值,根据标准曲线计算IL-8、TNF-α水平。
1.6.3 肺组织学观察 灌洗完毕后,脱颈椎处死大鼠,切取右肺组织,浸入4%多聚甲醛中进行固定24 h,乙醇脱水、二甲苯透明、石蜡包埋,切片(片厚4 μm),常规HE染色,透明、脱水、封片,光学显微镜下观察肺组织病理变化,每张切片随机选取5个视野,参照李佳艺等[6]的方法,测量视野长度和宽度,计算视野面积,计数视野中肺泡总数,计算平均肺泡数(mean alveolar number,MAN),MAN=肺泡总数/视野面积;标记视野中央“十”字线的肺泡间隔数,测量“十”字线长度,计算肺泡平均间隔内衬(mean linear intercept,MLI),MLI=“十”字线长度/肺泡间隔数。
1.6.4 气管壁及气管平滑肌厚度 随机选取每只大鼠HE切片中3个完整支气管(直径1 000~1 500 μm),使用Image图像分析系统测定支气管总面积、管腔面积、管壁内周长、平滑肌外侧面积和平滑肌内侧面积,支气管壁厚度=(支气管总面积-管腔面积)/管壁内周长,平滑肌厚度=(平滑肌外侧面积-内侧面积)/管壁内周长。
1.6.5 肺组织Wnt5a、RhoA、JNK、p-JNK蛋白 各组剩余大鼠脱颈椎处死后,取肺保存于液氮中,取100 mg冻存肺组织提取总蛋白,并进行定量,制备SDS-PAGE胶,蛋白上样进行电泳,转膜,加入封闭液室温封闭1 h,加一抗4℃孵育过夜,洗膜,加二抗室温孵育2 h,ECL发光,显影,Image软件分析条带灰度值,以目的蛋白与内参β-actin灰度比值表示目的蛋白相对表达水平。
1.7 统计学方法 采用SPSS 25.0统计学软件分析数据,计量资料以(s)表示,多组比较采用单因素方差分析,两两比较采用LSD-t检验。P<0.05为差异有统计学意义。
2 结 果
2.1 各组大鼠肺功能指标比较 与假手术组比较,模型组大鼠FVC、FEV1、PEF均降低(P<0.05);与模型组比较,LiCl组大鼠FVC、FEV1、PEF均降低,紫苏叶多糖组大鼠FVC、FEV1、PEF均升高(P<0.05);紫苏叶多糖+LiCl组大鼠FVC、FEV1、PEF高于LiCl组(P<0.05),而低于紫苏叶多糖组(P<0.05)。(见表1)
表1 各组大鼠肺功能指标比较

表1 各组大鼠肺功能指标比较
注:与假手术组比较,aP<0.05;与模型组比较,bP<0.05;与LiCl组比较,cP<0.05;与紫苏叶多糖组比较,dP<0.05
组别 动物数(只)给药剂量(mg/kg)FVC(mL)FEV1(mL) PEF(L/s)假手术组 10 - 10.36±0.65 5.13±0.15 35.52±1.59模型组 10 - 4.27±0.45a 2.09±0.09a 18.79±0.96a LiCl组 10 60 2.89±0.36b 1.65±0.08b 12.48±0.83b紫苏叶多糖组 10 20 8.47±0.59b 4.21±0.13b 28.79±1.32b紫苏叶多糖+LiCl组10 20+60 6.05±0.53c d 3.17±0.11c d 23.51±1.24c d F 333.782 434.076 531.774 P 0.000 0.000 0.000
2.2 各组大鼠BALF中IL-8、TNF-α水平比较 与假手术组比较,模型组大鼠BALF中IL-8、TNF-α水平均升高(P<0.05);与模型组比较,LiCl组大鼠BALF中IL-8、TNF-α水平均升高(P<0.05),紫苏叶多糖组大鼠BALF中IL-8、TNF-α水平均降低(P<0.05);紫苏叶多糖+LiCl组大鼠BALF中IL-8、TNF-α水平低于LiCl组(P<0.05),而高于紫苏叶多糖组(P<0.05)。(见表2)
表2 各组大鼠BALF中IL-8、TNF-α水平比较,ng/L)

表2 各组大鼠BALF中IL-8、TNF-α水平比较,ng/L)
注:与假手术组比较,aP<0.05;与模型组比较,bP<0.05;与LiCl组比较,cP<0.05;与紫苏叶多糖组比较,dP<0.05
组别 动物数(只)给药剂量(mg/kg)IL-8 TNF-α假手术组 5 - 254.13±26.42 265.46±13.49模型组 5 - 605.27±32.48a 365.79±18.16a LiCl组 5 60 687.61±33.51b 396.97±17.62b紫苏叶多糖组 5 20 424.52±29.43b 303.58±14.79b紫苏叶多糖+LiCl组5 20+60 538.91±31.46cd 331.62±15.67cd F 150.474 51.476 P 0.000 0.000
2.3 各组大鼠肺组织病理学变化 肺部大体观察:假手术组大鼠肺表面光滑,体积正常,无斑点,呈粉红色;模型组大鼠肺体积明显增大,表面可见黑色斑点,呈苍白色;LiCl组大鼠肺大体观察与模型组相似,表面黑色斑点较多,呈苍白色;紫苏叶多糖组大鼠肺体积较模型组略大,斑点较少,呈粉红色;紫苏叶多糖+LiCl组大鼠肺表面斑点多于紫苏叶多糖组,但少于模型组,体积较大,呈粉白色。(见图1)

图1 各组大鼠肺组织大体观察
HE染色显示,假手术组大鼠肺泡结构正常,肺泡腔未见扩大,肺间隔未见增厚,未见明显炎症细胞浸润;模型组大鼠肺泡腔扩大,部分融合成肺大泡,肺泡壁增厚,可见大量炎症细胞浸润;LiCl组大鼠肺组织病理变化与模型组相似,肺泡腔扩大、断裂、融合,肺间隔增厚,出现的大量炎症细胞;紫苏叶多糖组大鼠肺组织病变较模型组明显改善,肺泡结构大致正常,肺泡扩张明显减少,炎症细胞浸润明显减少;紫苏叶多糖+LiCl组大鼠肺组织病变较模型组明显改善,但较紫苏叶多糖组肺泡扩张严重,炎症细胞增加。(见图2)
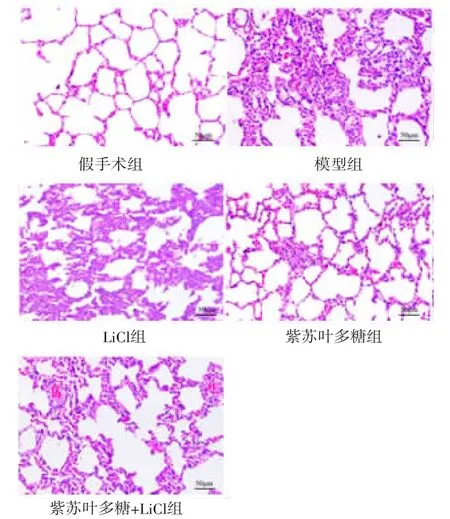
图2 各组大鼠肺组织病理学变化比较(HE,×200)
与假手术组比较,模型组大鼠MLI增加,而MAN减少(P<0.05);与模型组比较,LiCl组大鼠MLI增加,而MAN减少(P<0.05),紫苏叶多糖组大鼠MLI减少,而MAN增加(P<0.05);与紫苏叶多糖组比较,紫苏叶多糖+LiCl组大鼠MLI增加,而MAN减少(P<0.05)。(见表3)
表3 各组大鼠MLI、MAN比较
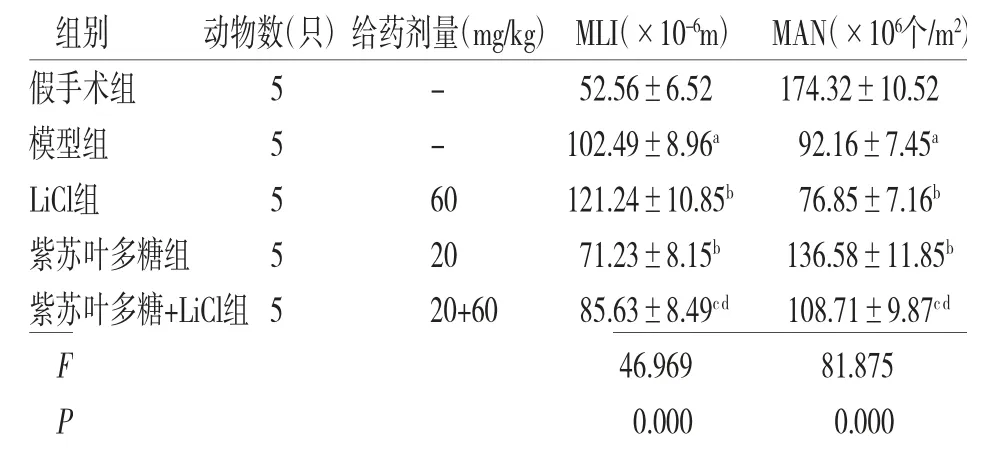
表3 各组大鼠MLI、MAN比较
注:与假手术组比较,aP<0.05;与模型组比较,bP<0.05;与LiCl组比较,cP<0.05;与紫苏叶多糖组比较,dP<0.05
组别 动物数(只)给药剂量(mg/kg)MLI(×10-6m)MAN(×106个/m2)假手术组 5 - 52.56±6.52 174.32±10.52模型组 5 - 102.49±8.96a 92.16±7.45a LiCl组 5 60 121.24±10.85b 76.85±7.16b紫苏叶多糖组 5 20 71.23±8.15b 136.58±11.85b紫苏叶多糖+LiCl组5 20+60 85.63±8.49cd 108.71±9.87cd F 46.969 81.875 P 0.000 0.000
2.4 各组大鼠支气管壁及气管平滑肌厚度比较 与假手术组比较,模型组大鼠支气管壁厚度、平滑肌厚度均增加(P<0.05);与模型组比较,LiCl组大鼠支气管壁厚度、平滑肌厚度均增加(P<0.05),紫苏叶多糖组大鼠支气管壁厚度、平滑肌厚度均减小(P<0.05);紫苏叶多糖+LiCl组大鼠支气管壁厚度、平滑肌厚度低于LiCl组,而高于紫苏叶多糖组(P<0.05)。(见表4)
表4 各组大鼠支气管壁厚度、平滑肌厚度比较±s,μm2/μm)
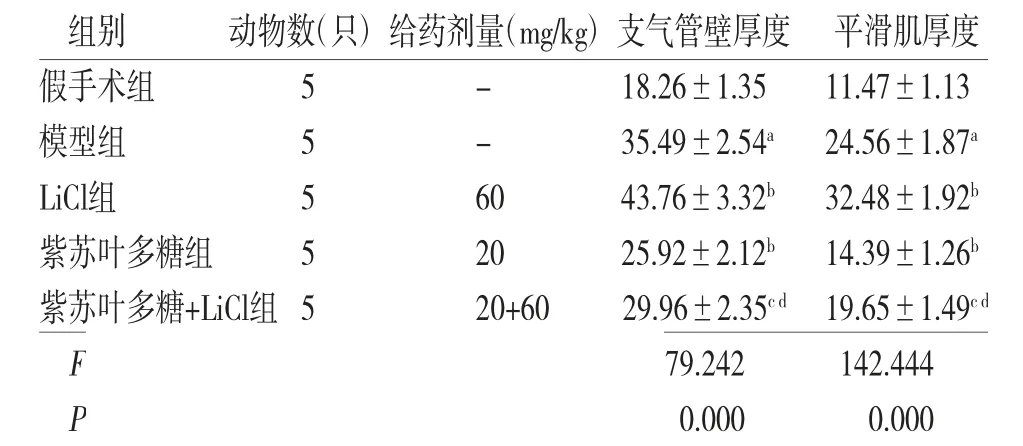
表4 各组大鼠支气管壁厚度、平滑肌厚度比较±s,μm2/μm)
注:与假手术组比较,aP<0.05;与模型组比较,bP<0.05;与LiCl组比较,cP<0.05;与紫苏叶多糖组比较,dP<0.05
组别 动物数(只)给药剂量(mg/kg)支气管壁厚度 平滑肌厚度假手术组 5 - 18.26±1.35 11.47±1.13模型组 5 - 35.49±2.54a 24.56±1.87a LiCl组 5 60 43.76±3.32b 32.48±1.92b紫苏叶多糖组 5 20 25.92±2.12b 14.39±1.26b紫苏叶多糖+LiCl组5 20+60 29.96±2.35c d 19.65±1.49c d F 79.242 142.444 P 0.000 0.000
2.5 各组大鼠肺组织Wnt5a、RhoA、JNK、p-JNK蛋白水平比较 与假手术组比较,模型组大鼠肺组织Wnt5a、RhoA、p-JNK蛋白相对表达量均增加(P<0.05);与模型组比较,LiCl组大鼠肺组织Wnt5a、RhoA、p-JNK蛋白相对表达量均增加(P<0.05),紫苏叶多糖组大鼠肺组织Wnt5a、RhoA、p-JNK蛋白相对表达量均减少(P<0.05);紫苏叶多糖+LiCl组大鼠肺组织Wnt5a、RhoA、p-JNK蛋白相对表达量低于LiCl组(P<0.05),而高于紫苏叶多糖组(P<0.05)。5组大鼠肺组织JNK蛋白相对表达量比较,差异无统计学意义(P>0.05)。(见表5、图3)
表5 各组大鼠肺组织Wnt5a、RhoA、JNK、p-JNK蛋白水平比较

表5 各组大鼠肺组织Wnt5a、RhoA、JNK、p-JNK蛋白水平比较
注:与假手术组比较,aP<0.05;与模型组比较,bP<0.05;与LiCl组比较,cP<0.05;与紫苏叶多糖组比较,dP<0.05
组别 动物数(只)给药剂量(mg/kg)Wnt5a RhoA JNK p-JNK假手术组 5 - 0.13±0.03 0.25±0.04 1.08±0.11 0.26±0.05模型组 5 - 0.81±0.07a 0.79±0.07a 1.03±0.10 0.82±0.08a LiCl组 5 60 1.26±0.08b 0.93±0.08b 1.05±0.13 0.95±0.08b紫苏叶多糖组 5 20 0.43±0.05b 0.51±0.05b 1.06±0.11 0.56±0.06b紫苏叶多糖+LiCl组5 20+60 0.70±0.06cd 0.68±0.06cd 1.02±0.12 0.69±0.07cd F 245.123 91.079 0.218 73.666 P 0.000 0.000 0.926 0.000

图3 各组大鼠肺组织中Wnt5a、RhoA、JNK、p-JNK蛋白表达电泳图
3 讨 论
COPD与慢性炎症有关,反复慢性炎症引起的气道重塑是COPD进展的关键病理因素,气道重塑过程始终伴随气道炎症[7]。吸入烟雾或其他有害颗粒,可激活COPD患者体内巨噬细胞、中性粒细胞、T淋巴细胞等释放一系列炎症介质,导致肺组织炎症细胞浸润;气道壁释放各种细胞因子或炎性介质等损伤局部组织,并介导异常修复过程,引起气道壁增厚、气道平滑肌增生肥大、细胞外基质沉积等,发生气道重塑,最终造成气管管腔狭窄,进行性气流阻力增加[8-9]。本研究采用烟熏联合LPS方法建立COPD大鼠模型,结果显示,模型组大鼠肺体积增大,出现明显斑点,呈苍白色,MLI增加,MAN减少,支气管壁及气管平滑肌厚度增加,表明COPD模型建立成功,符合气道重塑病理改变。
减轻炎症反应,防治气道重塑,是延缓COPD进展的关键。紫苏叶具有止咳平喘、降气化痰、润肠通便、理气止痛等功效。现代药理学表明,紫苏叶中含有黄酮类、多糖类、挥发油类等多种生物活性成分,具有抗炎、抗菌、抗氧化、抗肿瘤等药理活性[10]。PARK D D等[11]研究表明,紫苏叶提取物可减轻TNF-α诱导的促炎反应,对小鼠结肠炎具有预防作用。有研究[12]显示,紫苏叶提取物可减轻LPS诱导的RAW264.7细胞炎症反应,促进细胞增殖。本研究采用紫苏叶多糖治疗COPD大鼠,结果显示大鼠肺功能有所提高,BALF中IL-8、TNF-α等炎症因子水平下降,HE染色结果显示肺泡结构大致正常,肺泡扩张明显减少,炎症细胞浸润明显减少,MLI减少,MAN增加,支气管壁厚度、平滑肌厚度减小,提示紫苏叶多糖可抑制COPD大鼠炎症反应,减轻气道重塑,改善肺组织病理损伤。
Wnt信号通路异常活化与呼吸系统疾病发生发展密切相关,Wnt5a可激活非经典Wnt信号通路,引起机体炎症反应损伤气道上皮[13]。平面细胞极性(planar cell polarity,PCP)途径即Wnt/PCP途径,是非经典Wnt信号通路之一,主要通过调节下游RhoA等表达,激活JNK途径,破坏组织形态[14]。RhoA是Wnt/PCP途径中的关键蛋白,能够通过细胞张力调节细胞增殖,与肺部血管重建有关,其表达水平与慢性阻塞性肺疾病畸形加重期患者疾病严重程度成正相关[15]。JNK磷酸化进入活化状态后,可调节下游信号分子,参与细胞生长、分化等多种过程。已有研究证实,Wnt/PCP通路在肺发育过程中发挥了重要作用,能参与肺气肿、肺动脉高压等肺部疾病的发生[16-17]。为进一步研究紫苏叶多糖对COPD的作用机制,本研究使用Wnt通路激动剂LiCl干预COPD大鼠,结果显示LiCl组大鼠肺组织Wnt5a、RhoA、p-JNK蛋白相对表达量高于模型组,大鼠肺功能、炎症因子水平、肺部病理变化及气道重塑情况更严重,表明Wnt/PCP通路激活可促进COPD进展;本研究在使用紫苏叶多糖治疗的基础上同时使用LiCl干预,结果显示,LiCl可抵消部分紫苏叶多糖的改善作用。由此证实,紫苏叶多糖改善COPD气道重塑,可能与抑制Wnt/PCP通路有关。
综上所述,紫苏叶多糖可抑制COPD大鼠炎症反应,减轻气道重塑,可能与抑制Wnt/PCP通路有关。
