伸筋草经皮给药对小鼠抗炎镇痛作用及机制研究*
2021-11-22于立芹张华南徐如冰
朱 杰,于立芹,张华南,范 毅,魏 磊,王 伟,徐如冰
(1.河南省生物技术开发中心,河南 郑州 450002;2.河南省植物天然产物开发工程技术研究中心,河南 郑州 450002)
伸筋草(Lycopodid Herba)为石松科植物石松(Lycopodium japonicum Thunb.)的干燥全草。《普济方·诸痹门·风痹》记载,伸筋草辛温走窜下行之性更善于治疗脚膝疼冷[1]。《中华人民共和国药典》记载,伸筋草微苦、辛,温,归肝、脾、肾经,可祛风除湿,舒筋活络,用于关节酸痛,屈伸不利[2]。现代药理研究认为伸筋草具有抗炎、镇痛、抗氧化、抗血小板凝集等多种功效[3-4],在临床应用中,伸筋草多用于膝骨关节炎、类风湿关节炎、颈肩腰腿痛等疾病的治疗[5-6],是方剂中高频使用药物之一。
药物治疗是骨关节炎等关节疾病的最主要治疗方法。但对于高发病率的老年人群,常见口服药物如非甾体类抗炎药具有胃肠出血、损伤肾功能、诱发和加重心衰等风险[7-8],开发透皮吸收外用制剂是骨关节炎药物研发的重要方向。中华医学会骨科学分会发布的《骨科常见疼痛的处理专家建议》[9]也将外用药推荐用于治疗骨骼肌肉轻、中和重度疼痛。
伸筋草作为骨关节炎等关节疾病治疗常用药,其外用抗炎镇痛效果及其作用机制鲜有报道。因此,本研究提取伸筋草并制备凝胶膏,对小鼠经皮给药,采用多种经典的炎症与疼痛模型,如二甲苯致小鼠耳肿胀模型、新鲜蛋清致小鼠足跖肿胀模型、醋酸扭体模型、甲醛致痛模型等,研究伸筋草外用抗炎镇痛效果,并检测血浆中TNF-α、IL-1β、IL-6等细胞因子含量,探讨伸筋草抗炎镇痛作用机理,以期为伸筋草相关药物深入开发及临床应用提供科学基础。
1 材 料
1.1 实验动物SPF级雄性昆明种小鼠160只,体质量18~22 g,由湖南斯莱克景达实验动物有限公司提供,许可证号:SCXK(湘)2016-0002,实验期间自由饮水和摄食,12 h昼夜节律变换,湿度50%~70%,温度(23±1)℃。实验过程中对动物的处置符合国家科学技术部颁发的《关于善待实验动物的指导性意见》的要求。
1.2 药物与试剂 伸筋草药材购自河南张仲景大药房股份有限公司,经河南省生物技术开发中心赵天增研究员鉴定为石松科植物石松Lycopodium japonicum Thunb.的干燥全草,经检测均符合2015年版《中华人民共和国药典》一部相关项下要求。青鹏软膏(西藏奇正藏药股份有限公司,批号:180306);芦丁标准品(中国食品药品检定研究院,批号:100080-201811);卡波姆941[科莱恩(广州)国际贸易有限公司,批号:20181214];脱毛膏[利洁时家化(中国)有限公司,批号:20190304];TNF-ɑ、IL-1β、IL-6 ELISA测定试剂盒(武汉伊莱瑞特生物科技股份有限公司,批号:2146ZP1GHG,QCKNS9ENCE,BLLHR13BUP);甘油、三乙醇胺、亚硝酸钠、硝酸铝、氢氧化钠、甲醛、乙醇(95%)、二甲苯均为分析纯,由天津致远化学试剂有限公司生产。
1.3 主要仪器FW-100高速多功能粉碎机(北京市永光明医疗仪器有限公司);CP224C型电子天平[奥豪斯仪器(上海)有限公司];STX2201型便携式电子天平[奥豪斯仪器(上海)有限公司];药典筛(浙江上虞市金鼎标准筛具厂);imark酶标仪[伯乐生命医学产品(上海)有限公司];TU19型紫外分光光度计(北京普析通用仪器有限责任公司);SB2100型旋转蒸发仪(上海爱朗仪器有限公司)。
2 方 法
2.1 伸筋草凝胶膏制备 取伸筋草干燥粉末50 g,置于圆底烧瓶中,加入75%乙醇回流提取2次,料液比分别为1∶10与1∶8,每次40 min。滤过,合并提取液,旋转蒸发干燥,得到伸筋草提取物3.015 g(提取率6.03%),备用。
秤取适量卡波姆941,缓慢加入到适量甘油中,边加边搅拌,加入蒸馏水至卡波姆941浓度为1.0%。水凝胶膏溶胀过夜后加入三乙醇胺,调节水凝胶pH值范围为6.5~7.0。秤取适量伸筋草提取物,超声溶于75%乙醇中,加入水凝胶基质中,调整至生药浓度为1.0 g/mL和2.0 g/mL。
2.2 伸筋草总黄酮含量测定
2.2.1 标准曲线测定 参考韦松基等[10]的方法稍作修改,以芦丁为标准品,配制标准溶液浓度为0.300 mg/mL。精密吸取芦丁标准溶液0、0.5、1.0、1.5、2.0、2.5 mL置于10 mL容量瓶中,各加75%乙醇至5 mL,再加入5%NaNO2溶液0.5 mL,摇匀,置室温放置5 min,再加入10%Al(NO3)3溶液0.5 mL,摇匀,置室温放置5 min,再加入4%NaOH溶液4.0 mL,用75%乙醇定容,摇匀,置室温放置10 min,以第一份溶液为空白,在紫外分光光度计500 nm处检测吸收度,以吸收度A为纵坐标,芦丁溶液浓度C(mg/mL)为横坐标,绘制浓度-吸光度标准曲线。
2.2.2 伸筋草总黄酮含量测定 取伸筋草提取物0.1 g,加入75%乙醇溶解并置10 mL容量瓶定容得伸筋草溶液。精密吸取伸筋草溶液0.5 mL置于10 mL容量瓶中,按照标准曲线测定项下自“加75%乙醇至5 mL”开始操作,以75%乙醇为空白对照,于500 nm处测定吸光度值,计算伸筋草溶液中总黄酮含量。
2.3 蛋清致小鼠足跖肿胀实验 随机取40只小鼠随机分为模型组、青鹏软膏组、伸筋草低剂量组、伸筋草高剂量组,每组10只。每只小鼠背部脊柱两侧脱毛(1 cm×1 cm),脱毛膏涂于小鼠背部脊柱两侧5 min后,用纱布擦洗净。模型组小鼠在脱毛区涂空白凝胶,伸筋草高、低剂量组小鼠涂抹伸筋草凝胶膏,0.15 mL/只,青鹏软膏组涂抹青鹏软膏,0.15 mL/只,1次/d,连续10 d。采用游标卡尺法测定小鼠右后足跖厚度。实验前测定致炎前足跖厚度。第10天药物干预30 min后进行致炎造模,对每只小鼠右后足底皮下注射10%蛋清30μL,并于致炎后0.5、1、2、4、6、8 h依次测量各鼠右后足跖厚度,计算足跖肿胀度。每次测定均测量3次,取平均值。
肿胀度=(Ct-C0)/C0,其中,C0表示致炎前足跖厚度,Ct表示致炎后足跖厚度。
2.4 二甲苯致小鼠耳肿胀实验 小鼠分组与给药同“2.3”。第10天药物干预后30 min,小鼠右耳两面各涂二甲苯36μL,左耳作为对照,30 min后将小鼠颈椎脱臼处死,沿耳廓基线剪下两耳,用直径8 mm打孔器分别在同一部位打下圆耳片,用电子天平称质量,计算肿胀度与肿胀抑制率。
肿胀度=右耳片质量-左耳片质量。肿胀抑制率=(模型组平均肿胀度-给药组平均肿胀度)/模型组平均肿胀度×100%。
2.5 甲醛致痛实验 小鼠分组与给药同“2.3”。第10天药物干预后30 min,各小鼠左后足底注射2.5 mL/L甲醛溶液0.04 mL/只,立即计时,分别记录注射后0~5 min和20~30 min内小鼠舔左后足及左后足缩足累积时间,比较各组间的差异。
2.6 醋酸扭体实验 小鼠分组与给药同“2.3”。第10天药物干预后30 min,各小鼠腹腔注射0.6%冰醋酸0.2 mL,观察记录注射后20 min内各组小鼠的扭体次数,比较各组间的差异。
2.7 ELISA法测定TNF-ɑ、IL-1β和IL-6含量 醋酸扭体实验后,各组小鼠摘眼球采血,离心分离制备血浆。分别按照TNF-ɑ、IL-1β和IL-6 ELISA试剂盒说明书操作,根据标准曲线,计算各组血浆中TNF-ɑ、IL-1β和IL-6含量。
2.8 统计学方法 用SPSS 25.0软件处理数据,计量资料以“均数±标准差”(±s)表示,经正态分布检验后进行比较。各组间两两比较采用单因素方差分析(One way ANOVA)LSD检验,P〈0.05为差异有统计学意义。
3 结 果
3.1 伸筋草提取物中总黄酮含量测定结果 以吸光度(A)值为纵坐标,以质量浓度为横坐标,进行回归分析,绘制标准曲线,得到回归方程为:A=14.282C-0.032 33(R=0.999 9),线性范围15~75μg/mL。根据线性方程得出伸筋草提取物中总黄酮含量为4.37 mg/g。由此计算出高、低剂量伸筋草凝胶中总黄酮含量分别为0.52、0.26 mg/mL。
3.2 各组小鼠足跖厚度和足跖肿胀比较 各组小鼠致炎前足跖厚度比较,差异无统计学意义(P〉0.05)。各组小鼠在足跖注射10%新鲜蛋清溶液后均引发炎症反应,表现为足跖肿胀,且在致炎后0.5 h达到峰值,之后足跖肿胀度缓慢下降。与模型组比较,青鹏软膏组和伸筋草高、低剂量组小鼠均表现出一定的抗炎活性。青鹏软膏组和伸筋草高剂量组小鼠致炎后0.5、1 h足跖厚度明显下降(P〈0.05或P〈0.01),致炎后1 h小鼠足跖肿胀度明显下降(P〈0.01)。伸筋草低剂量组小鼠致炎后1、2、8 h足跖厚度均明显下降(P〈0.05或P〈0.01),致炎后1、2 h足跖肿胀度明显下降(P〈0.05或P〈0.01)。足跖厚度与肿胀度的时间主效应分析表明致炎后不同时间点小鼠足跖厚度比较,差异有统计学意义(P〈0.01),即存在时间效应,各组均如此。足跖厚度分组主效应分析表明各组小鼠足跖厚度总体比较,差异有统计学意义(P〈0.01),即存在分组效应;各组小鼠跖肿胀度总体比较,差异无统计学意义(P〉0.05),即不存在分组效应。足跖厚度与肿胀度的时间与分组不存在交互效应(P〉0.05)。(见表1~2、图1)
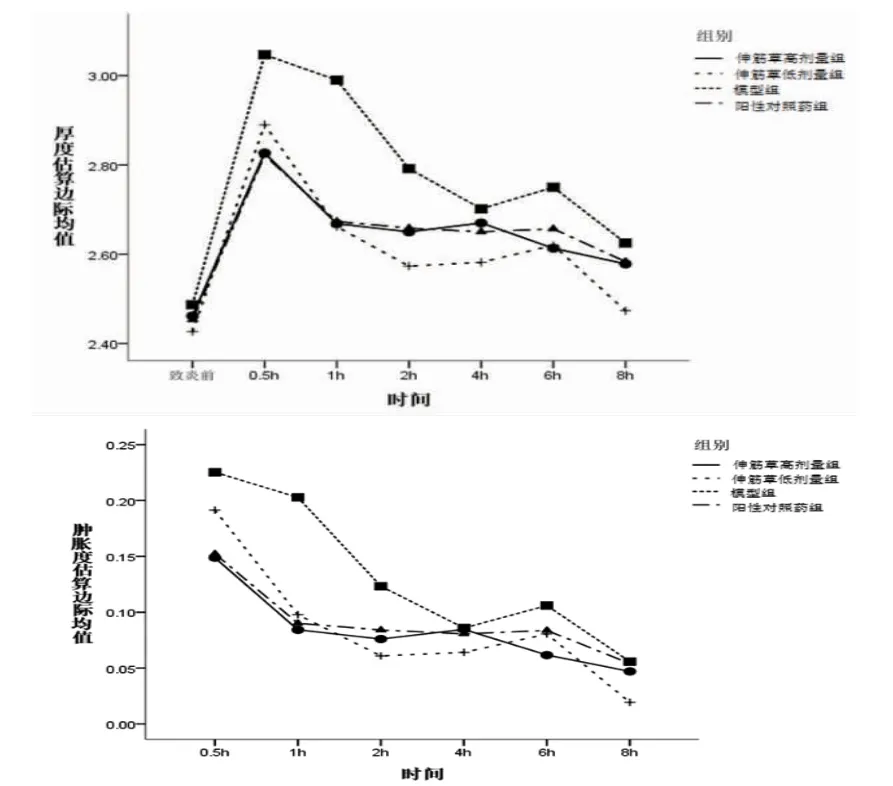
图1 交互效应轮廓图
表1 各组小鼠足跖厚度比较(±s,mm)
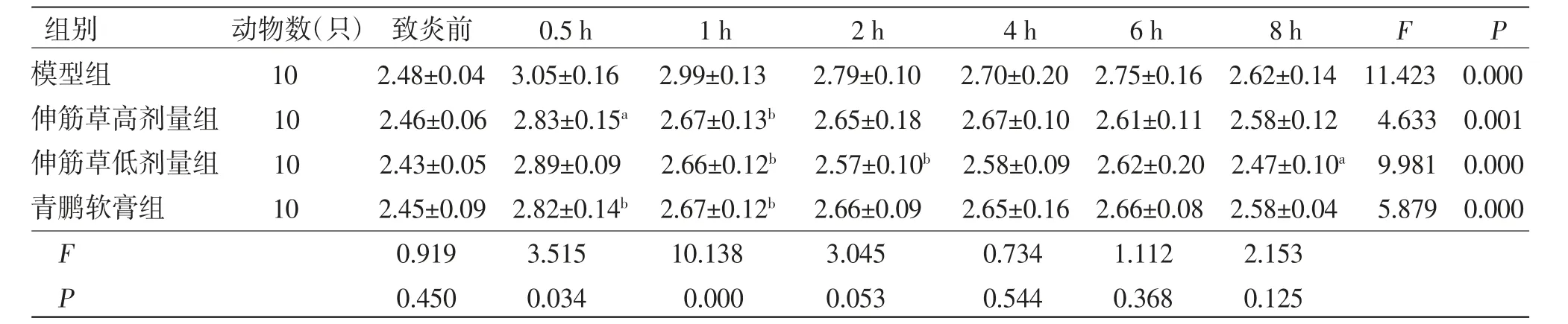
表1 各组小鼠足跖厚度比较(±s,mm)
注:F时间主效应=34.603,P时间主效应=0.000;F分组主效应=7.611,P分组主效应=0.001;F交互效应=1.454,P交互效应=0.162;与模型组比较,aP〈0.05,bP〈0.01
组别 动物数(只)致炎前 0.5 h 1 h 2 h 4 h 6 h 8 h F P模型组 10 2.48±0.04 3.05±0.16 2.99±0.13 2.79±0.10 2.70±0.20 2.75±0.16 2.62±0.14 11.423 0.000伸筋草高剂量组 10 2.46±0.06 2.83±0.15a 2.67±0.13b 2.65±0.18 2.67±0.10 2.61±0.11 2.58±0.12 4.633 0.001伸筋草低剂量组 10 2.43±0.05 2.89±0.09 2.66±0.12b 2.57±0.10b 2.58±0.09 2.62±0.20 2.47±0.10a 9.981 0.000青鹏软膏组 10 2.45±0.09 2.82±0.14b 2.67±0.12b 2.66±0.09 2.65±0.16 2.66±0.08 2.58±0.04 5.879 0.000 F 0.919 3.515 10.138 3.045 0.734 1.112 2.153 P 0.450 0.034 0.000 0.053 0.544 0.368 0.125
表2 各组小鼠足跖肿胀度比较(±s)
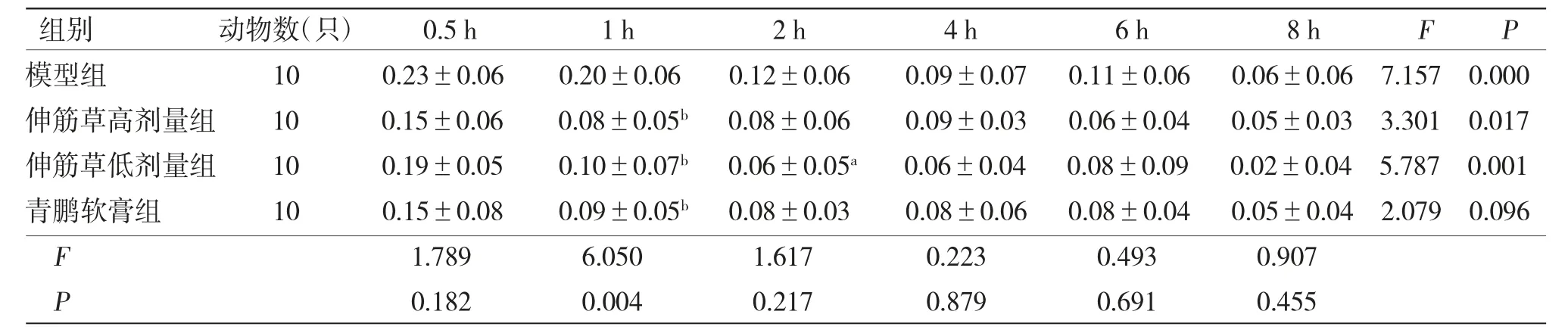
表2 各组小鼠足跖肿胀度比较(±s)
注:F时间主效应=20.765,P时间主效应=0.000;F分组主效应=3.064,P分组主效应=0.052,F交互效应=1.268,P交互效应=0.261;与模型组比较,aP〈0.05,bP〈0.01
组别 动物数(只) 0.5 h 1 h 2 h 4 h 6 h 8 h F P模型组 10 0.23±0.06 0.20±0.06 0.12±0.06 0.09±0.07 0.11±0.06 0.06±0.06 7.157 0.000伸筋草高剂量组 10 0.15±0.06 0.08±0.05b 0.08±0.06 0.09±0.03 0.06±0.04 0.05±0.03 3.301 0.017伸筋草低剂量组 10 0.19±0.05 0.10±0.07b 0.06±0.05a 0.06±0.04 0.08±0.09 0.02±0.04 5.787 0.001青鹏软膏组 10 0.15±0.08 0.09±0.05b 0.08±0.03 0.08±0.06 0.08±0.04 0.05±0.04 2.079 0.096 F 1.789 6.050 1.617 0.223 0.493 0.907 P 0.182 0.004 0.217 0.879 0.691 0.455
3.3 对二甲苯致小鼠耳肿胀的影响 二甲苯涂抹刺激后小鼠耳部明显充血肿胀(见图2)。与模型组比较,青鹏软膏组和伸筋草高、低剂量组小鼠耳肿胀度均明显下降(P〈0.01),表明伸筋草具有较好的抗炎作用。(见表3)
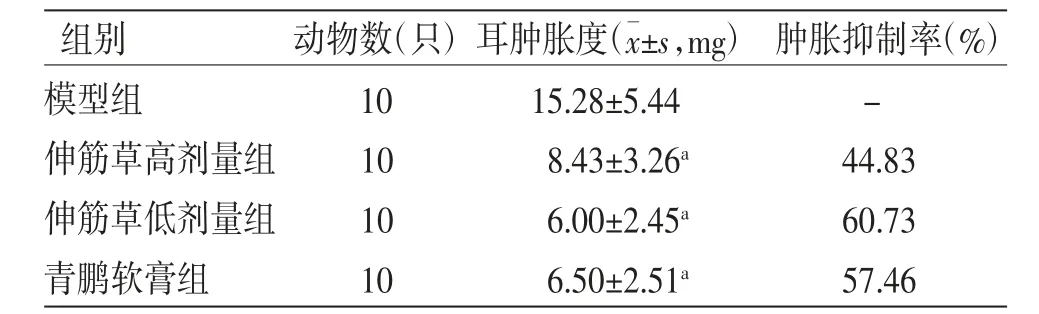
表3 伸筋草对小鼠耳肿胀的影响

图2 模型组小鼠二甲苯致耳肿胀情况
3.4 各组小鼠舔左后足时间比较0~5 min时,青鹏软膏组及伸筋草高、低剂量组小鼠涂药后舔左后足时间均少于模型组(P〈0.05或P〈0.01)。20~30 min时,青鹏软膏组及伸筋草高、低剂量组小鼠涂药后舔左后足时间与模型组比较,差异均无统计学意义(P〉0.05)。(见表4)
表4 各组小鼠舔左后足时间比较(±s,s)
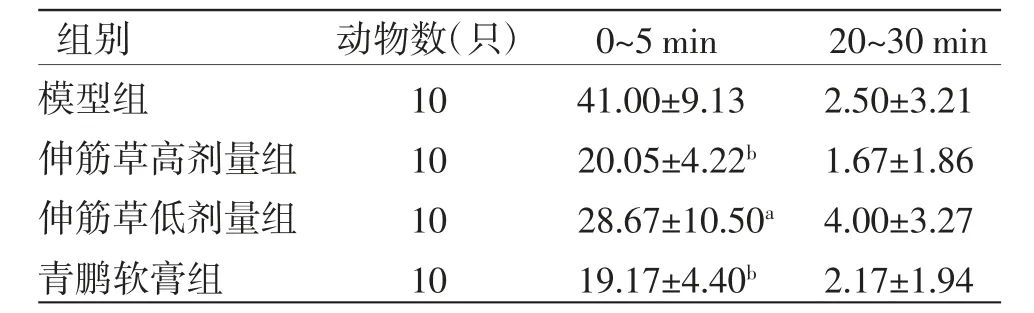
表4 各组小鼠舔左后足时间比较(±s,s)
注:与模型组比较,aP〈0.05,bP〈0.01
组别 动物数(只) 0~5 min 20~30 min模型组 10 41.00±9.13 2.50±3.21伸筋草高剂量组 10 20.05±4.22b 1.67±1.86伸筋草低剂量组 10 28.67±10.50a 4.00±3.27青鹏软膏组 10 19.17±4.40b 2.17±1.94
3.5 各组小鼠醋酸扭体次数比较 青鹏软膏组和伸筋草低剂量组小鼠扭体次数明显少于模型组(P〈0.05或P〈0.01);伸筋草高剂量组醋酸小鼠扭体次数与模型组比较,差异无统计学意义(P〉0.05)。(见表5)
表5 各组小鼠醋酸扭体次数比较(±s)

表5 各组小鼠醋酸扭体次数比较(±s)
注:与模型组比较,aP〉0.05,bP〈0.01,cP〈0.05
组别 动物数(只) 扭体次数(次)模型组 10 49.71±11.63伸筋草高剂量组 10 36.83±13.33a伸筋草低剂量组 10 32.43±12.45b青鹏软膏组 10 36.71±7.59c
3.6 各组小鼠血浆细胞因子水平比较 青鹏软膏组和伸筋草高、低剂量组小鼠血浆IL-1β含量均明显低于模型组(P〈0.05或P〈0.01);青鹏软膏组和伸筋草高、低剂量组小鼠TNF-ɑ含量与模型组比较,差异无统计学意义(P〉0.05)。伸筋草高剂量组小鼠血浆IL-6水平明显低于模型组(P〈0.05),伸筋草低剂量组和青鹏软膏组小鼠血浆IL-6水平均低于模型组,但差异无统计学意义(P〉0.05)。(见表6)
表6 各组小鼠血浆TNF-ɑ、IL-1β和IL-6含量比较(±s,pg/mL)
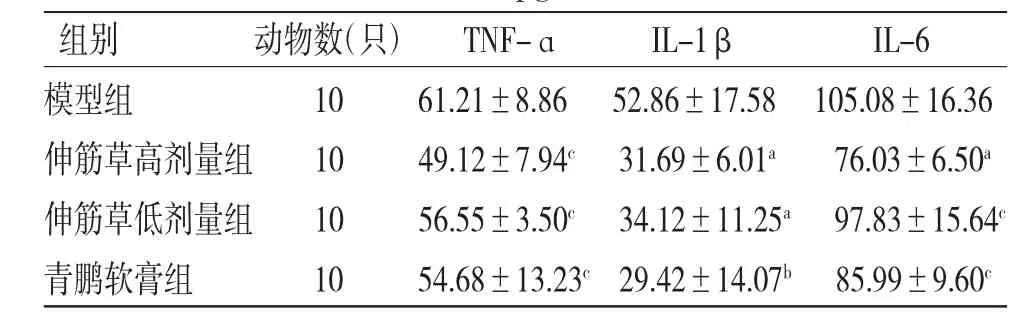
表6 各组小鼠血浆TNF-ɑ、IL-1β和IL-6含量比较(±s,pg/mL)
注:与模型组比较,aP〈0.05,bP〈0.01,cP〉0.05
组别 动物数(只) TNF-ɑ IL-1β IL-6模型组 10 61.21±8.86 52.86±17.58 105.08±16.36伸筋草高剂量组 10 49.12±7.94c 31.69±6.01a 76.03±6.50a伸筋草低剂量组 10 56.55±3.50c 34.12±11.25a 97.83±15.64c青鹏软膏组 10 54.68±13.23c 29.42±14.07b 85.99±9.60c
4 讨 论
骨关节炎的发病机理尚不清楚,临床表现为关节疼痛、晨僵和活动障碍等。骨关节炎的治疗目标是减轻和消除疼痛,矫正畸形,改善或恢复关节功能,提高患者生活质量[11]。因此,在关节炎治疗用药中,抗炎镇痛是非常重要的治疗手段。非甾体类镇痛抗炎药是全世界处方量最大的药物之一,其不合理使用及不良反应已经成为不容忽视的问题。寻找具有抗炎镇痛作用的中药及其天然活性成分逐渐受到重视。青鹏软膏为藏族药用植物组成的传统经典验方,具有活血化瘀、消炎止痛的功效,药效学及临床研究表明青鹏软膏对骨关节炎类疾病抗炎镇痛效果明确,且多项临床研究也均将其作为阳性对照[12-13],因此本研究选择青鹏软膏作为阳性对照药。
研究认为,伸筋草中的化学成分主要为生物碱类、三萜类及少量的蒽醌类及挥发油等[14],化学研究主要集中于提取鉴定伸筋草中新的生物碱类成分,对其他物质的研究关注不多。黄酮类化合物广泛存在于植物中,通常认为其具有抗氧化、抗病毒、抗肿瘤、抗炎镇痛等多种活性[15]。因此,本研究对伸筋草提取物中黄酮含量进行了测定。抗炎镇痛活性方面,曾元儿等[16]研究对比了伸筋草不同提取部位的抗炎镇痛活性;敖鹏等[3]建立了佐剂性关节炎模型,研究伸筋草不同提取物对佐剂性关节炎的治疗作用及其血清细胞因子的作用。以上研究均为经口给药,不能提示伸筋草外用的抗炎镇痛效果。本研究结果发现,伸筋草外用具有良好的抗炎镇痛作用,可开发成单一外用制剂,用于骨关节疾病的治疗。
TNF-ɑ、IL-1β、IL-6是参与机体免疫应答、免疫调节及炎症反应的重要细胞因子。TNF-ɑ通过旁分泌和自分泌的形式调节细胞和体液免疫,在分子水平上通过结合受体TNFR1和TNFR2调控细胞的增殖、分化和凋亡,而过量的TNF-ɑ不仅使其信号通路发生异常,还可与包括IL-1β、IL-6在内的其他促炎性细胞因子参与诱导RANKL依赖的破骨细胞的生成,最终导致关节与软骨的破坏,IL-1β可刺激金属蛋白酶的产生而加重骨破坏的作用[17]。IL-6被证实在关节炎症中由滑膜成纤维细胞、关节软骨细胞等多种细胞共同分泌,并参与骨关节炎发病和病情进展过程[18]。多项临床实验证明,抗TNF-ɑ与抗IL-1β治疗,减少TNF-ɑ、IL-1β表达,对治疗类风湿性关节炎有确切疗效[19]。体内IL-6水平可早期诊断骨关节炎,也可帮助了解患者疾病严重程度[20]。本研究对3种炎症因子的检测结果显示,伸筋草可能是通过抑制IL-1β、IL-6的表达水平达到抗炎镇痛的作用。伸筋草长期涂抹外用后是否具有缓解疾病进展及关节软骨保护作用等,尚需要采用关节炎模型动物进一步研究。
