六味地黄膏膏摩对脑瘫幼鼠大脑皮层损伤修复及BDNF/TrkB表达的影响*
2021-11-22张星贺宋咏丽高永超邰先桃井夫杰
张星贺,宋咏丽,高永超,邰先桃,井夫杰
(1.云南中医药大学针灸推拿康复学院,云南 昆明 650500;2.成都中医药大学药学院,四川 成都 611137;3.山东中医药大学针灸推拿学院,山东 济南 250355)
脑性瘫痪(cerebral palsy,CP)简称脑瘫,是一种严重的脑部损伤综合征,通常表现为发育迟缓甚至停滞,运动、感觉、认知、交流及行为障碍,常伴有癫痫及继发性肌肉骨骼疾病等,发病率为2‰~3.5‰[1-3]。CP患儿所造成的财力、物力及精力消耗数倍甚至十数倍于正常小儿,给社会及家庭造成沉重的负担[4]。寻找能够修复患儿脑损伤,提高患儿生存质量,以及降低家庭负担的治疗方式,是当代妇产、儿科、康复等医学领域亟须解决的问题。团队前期研究发现,六味地黄膏膏摩能够促进CP幼鼠生长发育,影响大脑血流供给[5];还可促进CP患儿的体格发育、改善体质[6];但六味地黄膏膏摩能否促进CP脑损伤的修复尚不清楚。该研究在“肾脑相关”理论指导下,使用六味地黄膏膏摩对CP幼鼠进行干预,并与单纯推拿、单纯涂六味地黄膏相比较。观察六味地黄膏膏摩对CP幼鼠大脑皮层损伤修复的效果并探究六味地黄膏膏摩是否能够调控BDNF/TrkB信号通路,以期为六味地黄膏膏摩的临床应用提供实验依据。
1 材料与方法
1.1 实验动物SPF级SD大鼠18只(雌鼠6只、雄鼠12只),体质量250~280 g,由湖南斯莱克景达实验动物有限公司提供,实验动物合格证号:43004700063963。饲养于昆明医科大学基础医学院清洁级动物房独立喂养笼具(Individual ventilated caging system,IVC)中,每笼内雌鼠1只,雄鼠2只,室温22~26℃,相对湿度50%~60%,光照12 h,黑暗12 h。雌鼠雄鼠自由交配,待雌鼠妊娠后与雄鼠分笼,单独喂养至分娩。该实验经云南中医药大学动物实验伦理委员会批准,动物试验伦理批号:2018 YZ0423。实验动物从业人员资格证书号(云南省):LA2017163。
1.2 药物与试剂 六味地黄膏按照团队前期已获授权的国家发明专利技术进行制作[7],六味地黄膏用量参照《药理实验方法学》“动物与人体等效剂量折算系数”[8],计算得出CP幼鼠每日用量为33.8 g/kg。兔抗大鼠BDNF一抗(批号:ab108319)、兔抗大鼠TrkB一抗(批号:ab18987)、小鼠抗大鼠β-actin一抗(批号:ab8224)、羊抗兔二抗(批号:ab205718)、羊抗小鼠二抗(批号:ab205719)(Abcam公司);BDNF ELISA试剂盒(批号:ml302829)、TrkB ELISA试剂盒(批号:ml035685)(上海酶联生物科技有限公司);尼氏染色试剂盒(Solarbio公司,批号:G1430)。
1.3 主要仪器ChemiDoc XRS+凝胶成像仪(美国BIO-RAD公司);Multiskan FC酶标仪(美国赛默飞世尔科技公司);Spectra酶标仪(美国美谷分子仪器有限公司);Primo Star正置生物显微镜(德国卡尔蔡司公司)。
1.4 造模与分组 于幼鼠出生后第2天称体质量,选取50只体质量7~11 g的幼鼠作为备选对象。第3天造模前,采用RAND函数随机选择10只幼鼠作为假手术对照组,其余40只幼鼠采用左侧颈总动脉凝断合并缺氧的方式制备CP模型。采用异氟烷麻醉幼鼠,以幼鼠停止活动,四肢瘫软,掐尾无反应为度;用75%酒精棉球对颈部皮肤进行消毒处理后,在解剖显微镜下切开颈部正中偏左侧皮肤,找到左侧颈总动脉;分离附近组织及伴行神经,提起血管并使用电凝笔凝断左侧颈总动脉;缝合伤口并消毒;幼鼠复苏后,将其置于37℃恒温的密闭缺氧箱中,氧含量6%,缺氧3 h后取出。假手术对照组同样在麻醉后切开颈部正中偏左侧皮肤,找到左侧颈总动脉,但不予血管凝断及缺氧。造模后再次采用RAND函数将40只CP模型幼鼠随机分为模型对照组、推拿组、涂膏组及膏摩组。
1.5 实验干预 自第4天开始,推拿组采用指摩法对肾俞穴进行操作,60次/min,压力为0.25~0.35 N,每次2 min,1次/d,共干预28 d。涂膏组将六味地黄膏涂于肾俞穴部位(不予多余的抹动),1次/d,共干预28 d。膏摩组将六味地黄膏涂于肾俞穴部位,并采用指摩法进行推拿操作,60次/min,压力为0.25~0.35 N,每次2 min,1次/d,共干预28 d。假手术对照组、模型对照组不予干预操作,在其余3组接受干预操作的同时将其与母鼠分笼进行禁食处理。
1.6 观察指标 干预28 d后将幼鼠麻醉处死,抽取心尖血并取上清液,-80℃超低温冰箱储存备用。在每组幼鼠内取5只幼鼠大脑组织制成石蜡切片(10μm);剩余5只幼鼠进行取材,取出大脑皮层后立刻进行裂解,离心后取上清液,作为皮层的样品蛋白,-80℃超低温冰箱储存备用。
1.6.1 神经元形态数量 采用尼氏染色法观察大脑皮层神经元数量及形态分布。大脑石蜡切片65℃烘烤5 min,经脱蜡水化后,按照尼氏染色试剂盒说明书进行染色,脱水透明后中性树胶封片观察。从每只幼鼠大脑石蜡切片中,随即取3片进行染色,每个切片在皮层部位随机选择3个视野,在10倍目镜及40倍物镜下拍照。采用Image J进行神经元计数。
1.6.2 血清BDNF/TrkB含量 从-80℃超低温冰箱中取出血清样品,并置于-20℃冰箱2 h及4℃冰箱1 h进行梯度解冻,然后按照试剂盒说明书进行操作。采用Spectra酶标仪在450 nm波长进行测定,根据标准曲线及公式计算浓度。
1.6.3 大脑皮层BDNF/TrkB蛋白表达水平 皮层样品蛋白变性后,规定蛋白上样量为50μg,根据样品蛋白浓度,计算样品蛋白的上样体积。灌注分离胶、压缩胶,然后上样。80V电泳20min,120 V电泳80 min。22 V转模80 min。漂洗后采用5%的脱脂牛奶封闭液在摇床上缓慢摇动封闭2 h。加入稀释好的兔抗大鼠BDNF一抗(1:1 000);兔抗大鼠TrkB一抗(1:1 000);小鼠抗大鼠β-actin一抗(1:1 000),放入4℃冰箱内的摇床上缓慢摇动12 h。漂洗后加入稀释好的二抗;羊抗兔二抗(1:5 000);羊抗小鼠二抗(1:5 000),室温摇床缓慢摇动1 h。漂洗后进行曝光并拍照。导入Image J对条带的平均光密度进行测量,并对比内参蛋白β-actin的比值作为被测蛋白量。
1.7 统计学方法 采用GraphPad Prism 7.0进行统计分析。数据均为计量资料,采用“均数±标准差”(±s)表示,鉴于尼氏染色类型,对其采用半定量分析。在进行比较前,采用Shapiro-Wilk检验数据正态性,P〈0.1为数据呈非正态分布;采用F检验验证方差齐性,P〈0.1为数据方差不齐。采用非参数检验(Mann-Whitney检验)进行组间的比较,P〈0.05为差异有统计学意义。
2 结 果
2.1 各组幼鼠大脑皮层神经元形态及数量比较 假手术对照组幼鼠大脑皮层神经元细胞形态正常,分布均匀,核浆界限清晰,染色深浅、透明度较一致,尼氏小体较多且呈虎斑样分布。模型对照组幼鼠大脑皮层神经元形态异常,分布不规则,核浆界限不清晰,形状大小不一,染色深浅、透明度不一,尼氏小体较少。与模型对照组比较,推拿组、涂膏组及膏摩组幼鼠大脑皮层神经元形态及分布均有所改善,染色深浅、透明度较为一致,尼氏小体较多。与假手术对照组比较,推拿组、涂膏组及膏摩组幼鼠大脑皮层神经元形态异常,分布不规则,核浆界限不清晰,形状大小不一,染色深浅、透明度不一,尼氏小体较少。(见图1)
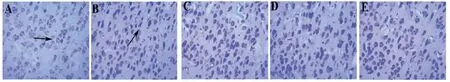
图1 大脑皮层神经元尼氏染色结果(×400)
模型对照组幼鼠大脑皮层正常形态神经元数量少于假手术对照组(P〈0.01);推拿组、涂膏组、膏摩组幼鼠大脑皮层正常形态神经元数量均多于模型对照组(P〈0.01),且均少于假手术对照组(P〈0.01)。膏摩组幼鼠大脑皮层正常形态神经元数量多于推拿组、涂膏组(P〈0.05或P〈0.01);推拿组幼鼠大脑皮层正常形态神经元数量与涂膏组比较,差异无统计学意义(P〉0.05)。(见表1)
表1 各组幼鼠大脑皮层正常形态神经元数量比较(±s,个)
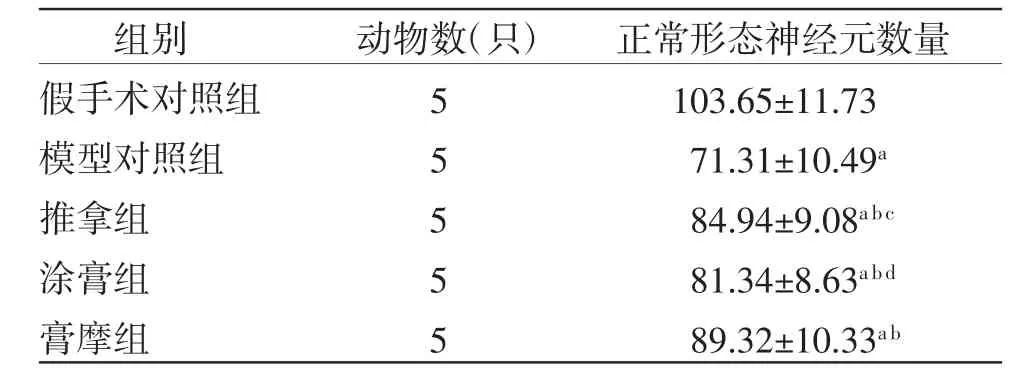
表1 各组幼鼠大脑皮层正常形态神经元数量比较(±s,个)
注:与假手术对照组比较,aP〈0.01;与模型对照组比较,bP〈0.01;与膏摩组比较,cP〈0.05,dP〈0.01
组别 动物数(只) 正常形态神经元数量假手术对照组 5 103.65±11.73模型对照组 5 71.31±10.49a推拿组 5 84.94±9.08a b c涂膏组 5 81.34±8.63a b d膏摩组 5 89.32±10.33a b
2.2 各组幼鼠血清BDNF、TrkB含量比较 模型对照组幼鼠血清BDNF、TrkB含量高于假手术对照组(P〈0.05);膏摩组幼鼠血清BDNF含量高于模型对照组(P〈0.05);膏摩组幼鼠血清TrkB含量低于推拿组,(P〈0.05)。(见表2)
表2 各组幼鼠血清BDNF、TrkB含量比较(±s,pg/mL)
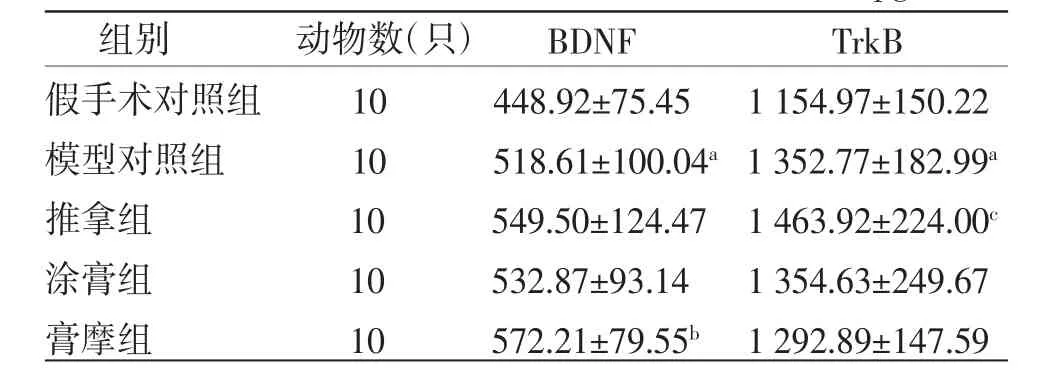
表2 各组幼鼠血清BDNF、TrkB含量比较(±s,pg/mL)
组别 动物数(只) BDNF TrkB假手术对照组 10 448.92±75.45 1 154.97±150.22模型对照组 10 518.61±100.04a 1 352.77±182.99a推拿组 10 549.50±124.47 1 463.92±224.00c涂膏组 10 532.87±93.14 1 354.63±249.67膏摩组 10 572.21±79.55b 1 292.89±147.59
2.3 各组幼鼠大脑皮层BDNF、TrkB蛋白表达水平比较 模型对照组幼鼠大脑皮层BDNF蛋白表达水平高于假手术对照组(P〈0.05),TrkB蛋白表达水平与假手术对照组比较,差异无统计学意义(P〉0.05);膏摩组幼鼠大脑皮层BDNF蛋白表达水平高于模型对照组(P〈0.01),但TrkB低于模型对照组(P〈0.05);膏摩组幼鼠大脑皮层BDNF蛋白表达水平高于推拿组及涂膏组(P〈0.01),但TrkB蛋白表达水平低于推拿组及涂膏组(P〈0.05)。(见图2、表3)
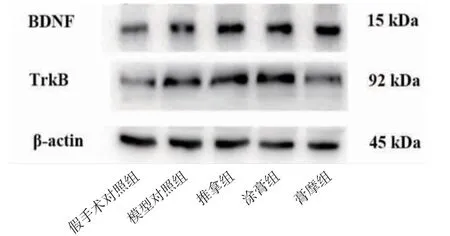
图2 各组幼鼠大脑皮层BDNF、TrkB蛋白表达电泳条带
表3 各组幼鼠大脑皮层BDNF、TrkB表达水平比较(±s)
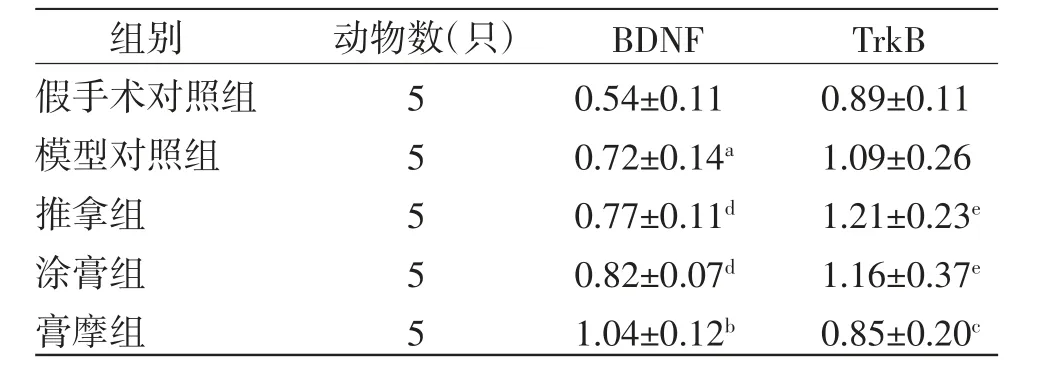
表3 各组幼鼠大脑皮层BDNF、TrkB表达水平比较(±s)
注:与假手术对照组比较,aP〈0.05;与模型对照组比较,bP〈0.01,cP〈0.05;与膏摩组比较,dP〈0.01,eP〈0.05
组别 动物数(只) BDNF TrkB假手术对照组 5 0.54±0.11 0.89±0.11模型对照组 5 0.72±0.14a 1.09±0.26推拿组 5 0.77±0.11d 1.21±0.23e涂膏组 5 0.82±0.07d 1.16±0.37e膏摩组 5 1.04±0.12b 0.85±0.20c
3 讨 论
脑瘫属中医学“痿证”“痴呆”“五迟”“五软”“五硬”等范畴。中医学认为,父母素体虚弱、精血不足,妊娠期外邪侵袭、扰动胎气,亦或产时风邪入侵等小儿出生前后各种因素是小儿脑瘫的主要病因。小儿先天禀赋不足则肾精化髓无力、脑髓失养、脑络损伤,故出现四肢萎软无力、行迟、立迟、语迟、智力低下、反应迟钝、四肢僵硬、痴呆等症状。如元代医家曾世荣《活幼心书·五软》曰:“五软证,名曰胆怯,良由父精不足,母血素衰而得。”清代医家吴谦《医宗金鉴·五迟》曰:“小儿五迟之症,多因父母气血虚弱,先天有亏,致儿生下筋骨软弱,行步艰难,齿不速长,坐不能稳,要皆肾气不足之故。”清代医家张温《张氏医通·婴儿门》曰:“五迟者……良由父母精血不足,肾气虚弱,不能荣养而然。”蔡陆仙《中国医药汇海·论脑以肾为本》曰:“人之灵固莫于脑矣,然其灵根实起于肾……而脑髓实由肾主之,精足则髓足,髓足则脑充。”现代著名医家李德修《李德修小儿推拿技法·脑炎》曰:“肾通脑最快,治脑炎需多推”。王国才亦认为CP无论病因如何,都势必造成肾精亏虚、髓海失养,其治疗均需补肾[9]。因此,CP的治疗当重在补肾益脑、填精益髓,以起到濡养修复大脑的作用[10-12]。
BDNF是第2个被发现的神经营养因子(neurotrophins,NTs)家族成员,在海马和大脑皮质组织中含量最高,其同时也是脑内含量最高的NTs。NTs具有促进神经细胞存活、分化、修复、再生,重塑神经元突触等作用。NTs在神经细胞损伤的修复,神经细胞凋亡的抑制,神经细胞存活的增强,以及发挥相关功能等方面具有重要作用。NTs家族目前已发现众多类型,其中包括神经生长因子(nerve growth factor,NGF)、BDNF、神经营养因子3(neurotrophin 3,NT3)及神经营养因子4/5(neurotrophin 4/5,NT-4/5)等[13]。NTs发挥功能需要通过与其相对应的神经营养因子受体相结合,高亲和力受体为酪氨酸蛋白激酶(tyrosine kinase receptor,Trk),其通常发挥维持神经细胞存活生长的正向效应。低亲和力受体为p75,与NTs结合可发挥促进神经细胞凋亡的负向效应,但p75在一定量的时候反而可以促进NTs与Trk的结合。NTs与Trk或p75相结合后,引起受体同源二聚化,受体分子的自身酪氨酸磷酸化,磷酸化的酪氨酸召集细胞内的多种相关靶信号分子以最终启动细胞内信号转导(见图3),以发挥相关的调控作用[13-15]。
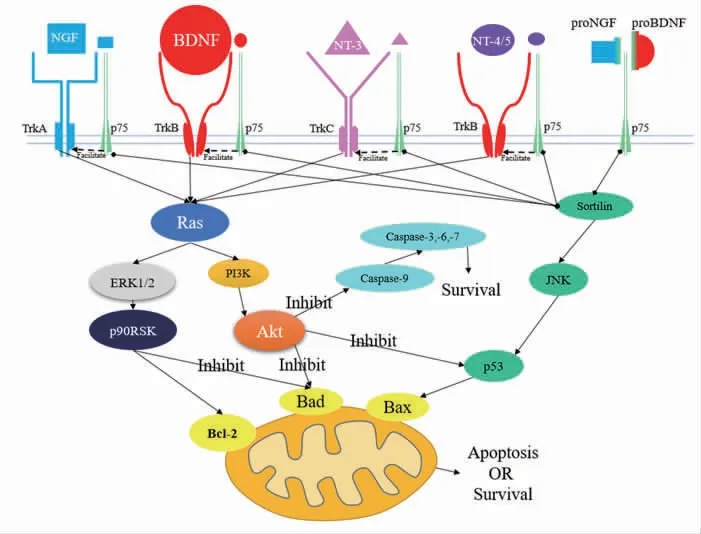
图3 NTs家族信号转导途径
由多胚层原始神经干细胞分化而来的胚胎干细胞,具有自我更新、增殖、分化的能力,可分化为多种重要的神经元[16]。胚胎干细胞与中医先天之精具有相同的来源,两者均来源于父母之精。如《灵枢·决气篇》曰:“两神相搏,合而成形,常先身生,是谓精。”即肾中的先天之精禀受于父母,为人体胚胎形成的基本构成物质。同时,胚胎干细胞能够在子宫内分化为机体发育的组织细胞并促进人体胚胎的形成,而中医“肾精”具有调控生殖、充骨生髓、补养脑髓、激发脏腑功能及维持正常的生命运行等作用。故先天之精与胚胎干细胞具有相同的属性特点,胚胎干细胞是先天之精的现代医学细胞层次的存在形式[17]。而中医“髓”具有充润濡养大脑、维持大脑正常功能运转的作用,大脑的濡养在现代医学中可表现为神经元的生长、分化、成熟,神经递质的传递,神经元的存活,损伤神经元的修复,以及神经元非程序性凋亡的抑制等[18]。有研究表明,补肾类中药能够改善神经系统疾病动物模型的症状,促进BDNF、TrkB等相关营养因子的表达[19-20]。因此,中医“肾脑相关”理论中大脑的濡养则可能与大脑神经元状态、神经元数量及NTs的变化有关[16-18]。
六味地黄丸首见于宋代医家钱乙《小儿药证直·地黄丸》:“地黄丸,治肾怯失音,囟开不合,神不足,目中白睛多,面色白等方。”可见古代医家最初的用意是将此方用来治疗小儿囟门迟闭、齿迟、语迟、立迟、行迟及发迟等“五迟”“五软”及“痿证”,与当代CP先天受损、脏腑精气不足、生长发育迟缓或停止等病因症状相吻合。本研究将具有滋阴补肾、填精益髓作用的“六味地黄丸”制作为外用膏剂[7],并与同样具有补肾益脑功用的肾俞穴相结合,通过六味地黄膏膏摩的干预方式对CP幼鼠进行干预。采用与中医“髓”功能相似的皮层神经元形态数量及BDNF/TrkB作为主要指标进行观察。大脑皮层神经元尼氏染色表明,以补肾益脑为核心治则,不论采用摩肾俞的推拿刺激、六味地黄膏外用或者两者结合的六味地黄膏膏摩,均能对CP幼鼠起到濡养大脑、修复大脑皮层受损神经的作用,但3种干预方式的修复作用有限;而推拿与六味地黄膏相结合的六味地黄膏膏摩法能够更有效地修复皮层神经损伤。BDNF/TrkB是脑损伤后多种修复转导途径中的一种重要启动因子。BDNF/TrkB总量及磷酸化表达的增加能够诱导神经细胞的存活,并对神经损伤起到积极的修复作用。模型对照组CP幼鼠在缺血缺氧脑损伤后BDNF/TrkB的表达明显增加,以发挥脑损伤后的自我修复的作用。与此同时,六味地黄膏膏摩能够更加显著地诱导CP幼鼠血清与大脑皮层BDNF的表达,进一步增强CP幼鼠脑损伤修复的效果,而同样以补肾为核心的推拿肾俞或涂六味地黄膏膏对CP幼鼠BDNF/TrkB表达的影响均不显著,但膏摩组CP幼鼠大脑皮层TrkB蛋白表达水平与假手术对照组比较,差异均无统计学意义(P〉0.05)。
六味地黄膏膏摩相较单纯推拿或者单纯涂膏,对大脑皮层神经元的损伤具有更好的修复作用,且拥有更强的促BDNF表达作用,但膏摩组TrkB表达水平较模型对照组有所减少。究其原因,膏摩组除了摩肾俞的经穴效应外,还可能起到刺激局部皮肤改善血液循环促进六味地黄膏透皮吸收的作用;而TrkB磷酸化是后续细胞信号转导途径中的一种形式,在TrkB总量减少的同时,其磷酸化程度很有可能已经增强,能够更有效地触发后续的细胞存活相关信号转导机制,从而对神经元损伤起到促进修复的作用;现代医学神经损伤修复是多通路、多样化、复杂化的,中医“髓”濡养大脑的功能除了与BDNF/TrkB相似外,还与NGF、NT3、NT-4/5等具有功能上的相似性。
六味地黄膏膏摩是选择性脊柱推拿[21]及补肾名方“六味地黄丸”的有机结合,能够避免药物口服的难题,具有药物及推拿双重功效的优势。六味地黄膏膏摩能够调控CP幼鼠生长激素释放激素(GHRH)、促生长激素释放肽(Ghrelin)及生长抑制素(SS)等,起到促进生长发育的效果,同时还可影响大脑血流供给[5,22-23]。在经过药物安全性验证后,我们将六味地黄膏膏摩应用于临床,发现其具有促进早产低体重儿及CP患儿生长发育的作用[6,24-25]。本研究证明了六味地黄膏膏摩能够对CP幼鼠大脑皮层损伤起到修复作用,且优于单纯推拿或六味地黄膏外用;其补肾益脑、修复脑损伤的机制可能与BDNF/TrkB信号通路有关,但仍可能存在其他的作用机制,仍需进一步广泛而深入的研究。
