益生菌类保健食品中双歧杆菌计数不确定度的评定
2021-11-22商迎辉李梦洁刘芸如黄汉昌劳凤学
商迎辉,李梦洁,刘芸如,黄汉昌,劳凤学
(北京联合大学功能因子与脑科学研究院 生物化学工程学院 北京 100191)
益生菌是对人体有益的活性菌群,能增强人体的免疫力[1],促进肠道的健康,预防和改善腹泄等状况[2]。其中,双歧杆菌不但可产生B1、B2、B6、B12等多种维生素及氨基酸,还可产生有机酸,使有害菌或一些致病菌因肠内pH 值的下降而死亡。另外,益生菌必须满足可食用性、安全性和稳定性。经过再加工生产后仍然稳定且具有活性,可以耐受胃酸、胆汁和胰酶的消化,可在体内繁殖[3]。
益生菌每日的摄入量决定其益生效果,到达肠道内的益生菌数为106CFU/g(mL)时才能对人体产生益生效果[4]。益生菌类保健食品应含有与其益生作用相对应的菌种和最低的含量值。《益生菌类保健食品申报与审评规定(试行)》中规定益生菌类保健食品在其保质期内的活菌数量的最小值为106CFU/g(mL)。
不确定度是表征合理地赋予被测量值的分散性与测量结果相联系的参数[5]。《检测和校准实验室能力的通用要求》[6]和《检测和校准实验室能力认可准则在微生物检测领域的应用说明》[7]中明确要求:微生物检测实验室应具有对测量不确定度评定的相应能力。
不确定度的评定一般用A 类评定和B 类评定来评定测量不确定度分量。其中,A 类评定用统计方法评定不确定度分量,重复性检测引入的不确定度属于A 类不确定度;而另一类B 类评定用任何非统计方法评定不确定度分量,仪器和设备校准引入等的不确定度属于B 类不确定度[8]。
同时含有乳杆菌和双歧杆菌的益生菌类保健食品中双歧杆菌的计数是按照《食品安全国家标准 食品微生物学检验 乳酸菌检验》(GB 4789.35-2016)[9]进行,其中,样品稀释和加样时既可以使用1 mL 吸管也可以使用微量移液器。其操作方便,耗材成本较低,在实验室检验过程中微量移液器的使用更普遍。益生菌类保健食品中双歧杆菌的数量较大,稀释倍数大,由于与微量移液器相比吸量管的允差小,因此带入的不确定度变小。本研究目的是比较以上两种量具对双歧杆菌计数的测量不确定度产生的影响。
1 材料与方法
1.1 材料与试剂
市售益生菌类保健品(同时含乳杆菌属和双歧杆菌属),汤臣倍健股份有限公司;莫匹罗星锂盐、半胱氨酸盐酸盐改良的MRS 培养基,北京陆桥技术有限责任公司。
1.2 仪器与设备
1.2.1 引入B 类不确定度的仪器与设备 依据《食品安全国家标准 食品微生物学检验 乳酸菌检验》(GB 4789.35-2016)。
1)天平 感量0.01 g,依据检定证书,量程0~25 g 时,最大允许误差±0.025 g。
2)量筒 250 mL,依据《常用玻璃量器》(JJG 196-2006)[10],容量允差为±2.0 mL。
3)无菌吸量管(A 类)依据 《常用玻璃量器》(JJG 196-2006),1 mL(具0.01 mL 刻度),容量允差为±0.008 mL;10 mL(具0.1 mL 刻度),容量允差为±0.05 mL。
4)微量移液器(100~1 000 μL)依据《移液器检定规程》(JJG 646-2006)[11],移取1 mL 时,容量允差为±0.01 mL。
1.2.2 其它设备 恒温培养箱(36 ℃),上海博讯实业有限公司医疗设备厂;均质器,西班牙IUL 及无菌均质袋;厌氧包,日本MGC 公司。
1.3 方法
1.3.1 依据《食品安全国家标准 食品微生物学检验 乳酸菌检验进行双歧杆菌计数》(GB 4789.35-2016)
1.3.2 双歧杆菌计数过程
1.3.2.1 样品称量与制备 充分混匀样品,按无菌操作要求称取25.00 g,置于含225 mL 无菌生理盐水的均质袋中,用均质器均质120 s,制成1∶10 的样品匀液。
1.3.2.2 样品稀释
1)吸量管组 用1 mL 无菌吸量管吸取1∶10 样品稀释液1 mL,沿管壁缓缓注入含有9 mL无菌生理盐水的试管内,充分振摇后制成1∶100的样品稀释液。按上述操作,依次作10 倍系列稀释。
2)移液器组 使用微量移液器进行上述操作。
1.3.2.3 加样
1)吸量管组 选择3 个适宜的连续稀释度,每个稀释度用1 mL 无菌吸量管吸取1 mL 样品稀释液于无菌平皿内,每个稀释度做2 个平皿。
2)移液器组 使用微量移液器进行上述操作。
1.3.2.4 培养与计数 稀释液被移入平皿后,将冷却至48 ℃的莫匹罗星锂盐和半胱氨酸盐酸盐改良的MRS 培养基倾注平皿约15 mL,转动平皿使之混合均匀。从样品稀释到平板倾注在15 min内完成。36 ℃厌氧培养72 h。培养后计数平板上的所有菌落数。
2 结果与分析
2.1 双歧杆菌菌落计数
选取菌落数在30~300 CFU 范围,无蔓延菌落生长的平板计数双歧杆菌菌落总数。
2.2 结果表述
只有一个稀释度平板上的菌落数在计数范围,计算2 个平板上的菌落数平均值,将平均值乘以相应稀释倍数,作为每克样品中双歧杆菌菌落数。
2.3 不确定度的评定
2.3.1 样品重复性检测引起的A 类不确定度 依据《食品安全国家标准 食品微生物学检验 乳酸菌检验》(GB 4789.35-2016),对同一含乳杆菌和双歧杆菌的保健食品做10 次独立测试,结果只有稀释度为108的双歧杆菌菌落数在计数范围。由于每克样品中双歧杆菌的数量在109数量级,因此对试验数据取对数进行A 类不确定度的评定[12-14]。
2.3.1.1 吸量管组 按贝塞尔公式计算检验结果对数值标准差:
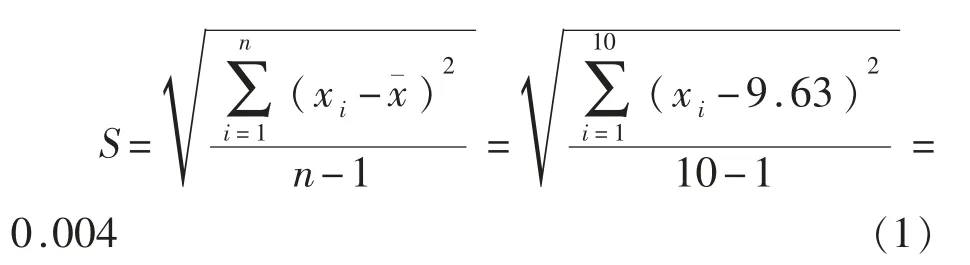
式中,S——标准差;xi——第i次测量的测得值;——n次测量所得一组测得值的算数平均值。
相对标准不确定度为:
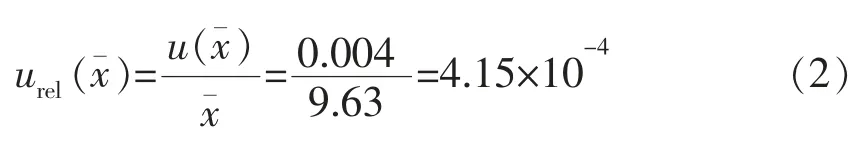
式中,urel()——相对标准不确定度;u()——标准不确度;——n次测量所得一组测得值的算数平均值。
2.3.1.2 移液器组 按贝塞尔公式计算出检验结果对数值标准差:
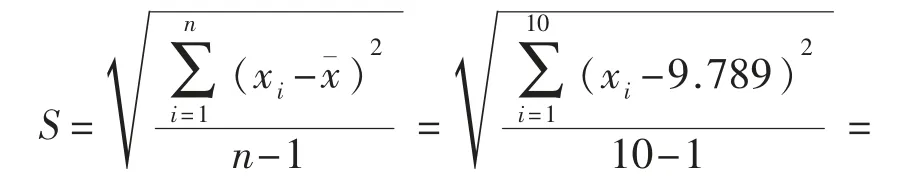

相对标准不确定度为:
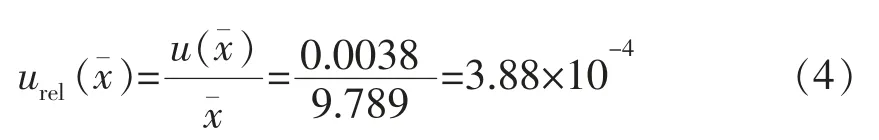
2.3.2 B 类不确定的度评定[15-17]
2.3.2.1 样品制备过程中引入的不确定度 用天平(精度0.01 g)称取25.00 g 样品,由天平检定证书可知,最大允许差为±0.025 g。按级使用的数字仪表、测量仪器最大允许误差导致的不确定度属于矩形(均匀)分布,天平引入的标准不确定度为:

相对不确定度为:

用容量250 mL 的量筒量取225 mL 无菌生理盐水,加入样品中制备样品匀液。《常用玻璃量器》(JJG 196-2006)规定,250 mL 量出式量筒的容量允差为±2.0 mL。取矩形分布,量筒引入的标准不确定度为:

相对不确定度为:

以上2 项合成可得样品制备过程中引入的相对合成不确定度为:

2.3.2.2 样品稀释过程中引入的不确定度
1)吸量管组 样品10 倍系列稀释方法:吸取样品1 mL 加入9 mL 稀释液中。依据《常用玻璃量器》(JJG 196-2006),1 mL(具0.01 mL 刻度),容量允差为±0.008 mL。取矩形分布,其标准不确定度为:

相对不确定度为:

10 mL 吹出式(A 类)分度吸量管容量允差为±0.05 mL,取矩形分布,其标准不确定度为:

相对不确定度为:

该过程产生的相对不确定度U稀释依据泊松关于微生物培养产生的不确定度定量测定理论中的公式计算:

因样品的梯度稀释方法相同,则=k×,k为10 倍系列梯度稀释的次数,本试验中双歧杆菌计数的稀释倍数是108,则k=7。

2)移液器组 根据 《移液器检定规程》(JJG 646-2006)规定,100~1 000 μL 移液器吸取1 000 μL 时容量允差为±1 000 μL×1.0%=0.01 mL,取矩形分布,其标准不确定度为:

相对不确定度为:

10 mL 吹出式(A 类)分度吸量管容量允差为±0.05 mL,取矩形分布,其标准不确定度为:

该过程产生的相对不确定度U稀释依据泊松关于微生物培养产生的不确定度定量测定理论中的
公式计算:
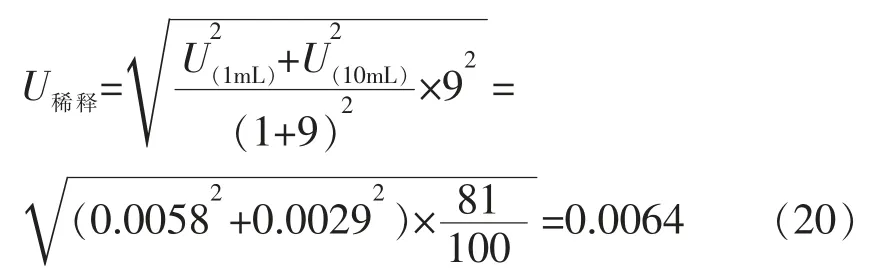
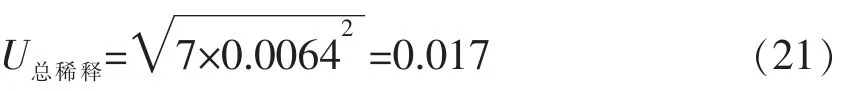
2.3.2.3 加样过程引入的不确定度
1)吸量管组 用吸量管吸取1 mL 样品稀释液加入平板,加样引入的相对不确定度等同于稀释样品过程中吸取1 mL 产生的相对不确定度。
U(1mL)=0.0046,U加=0.0046
2)移液器组 用移液器吸取1 mL 样品稀释液加入平板,加样引入的相对不确定度等同于稀释样品时吸取1 mL 产生的相对不确定度。
U(1ml)=0.0058,U加=0.0058
2.3.3 合成不确定度
2.3.3.1 吸量管组 双歧杆菌计数的合成相对不确定度为:

则合成不确定度为:

2.3.3.2 移液器组 双歧杆菌计数的合成相对不确定度为:

则合成不确定度为:

2.3.4 扩展不确定度 测定结果按正态分布估计,置信水平为95%时,包含因子k=2。扩展不确定度可由合成不确定度乘以包含因子获得,U吸量管=2×0.14=0.28,U移液器=2×0.18=0.36。
2.3.5 不确定度结果计算 当包含率在95%时,保健食品样品中双歧杆菌计数结果的扩展不确定度U吸量管为0.28,X=±U吸量管。以吸量管作为稀释和加样量具,样品中双歧杆菌计数的对数X值区间为9.35~9.91。取反对数后,其取值为(2.2~8.1)×109CFU/g,样品双歧杆菌总数的置信区间为(2.2~8.1)×109CFU/g。同样,以移液管作为稀释和加样量具,样品中双歧杆菌计数的对数X值区间为9.43~10.15。取反对数后,其取值为(2.7~14)×109CFU/g,样品双歧杆菌总数的置信区间为(2.7~14)×109CFU/g。
2.4 数据分析
2.4.1 两种量具对双歧杆菌计数结果(对数值)的影响 使用MATLAB 软件对吸量管组和移液器组双歧杆菌计数结果对数值(见表1、表2)进行方差分析(ANOVA)。ANOVA 箱形图见错误! 未找到引用源。ANOVA 计算结果见图2,结果中P=1.2816×10-4,证明两组数据差异非常明显。

图1 ANOVA 箱形图Fig.1 ANOVA boxplot
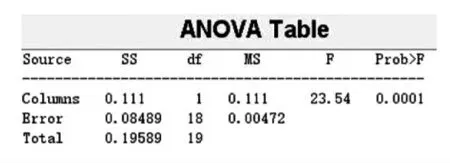
图2 MATLAB 软件中ANOVA 分析结果Fig.2 ANOVA result from the MATLAB analysis

表1 吸量管组双歧杆菌计数结果(×108 CFU/g)Table 1 Counting result of the Bifidobacterium using pipette(×108 CFU/g)

表2 移液器组双歧杆菌计数结果(×108 CFU/g)Table 2 Counting result of the Bifidobacterium using micropipettor(×108 CFU/g)
2.4.2 两种量具对双歧杆菌计数结果不确定度的影响 除A 类不确定度外,吸量管组样品稀释和加样引入的不确定度以及置信区间均略小于移液器组。

表3 两种量具对双歧杆菌计数结果不确定度的影响Table 3 The influence of the two different tools to the uncertainty of counting the Bifidobacterium
3 讨论
依据《食品安全国家标准 食品微生物学检验乳酸菌检验》(GB 4789.35-2016)[9]对益生菌类保健食品中的双歧杆菌计数,其中样品稀释和加样既可使用1 mL 吸量管也可使用微量移液器。由于益生菌类保健食品中双歧杆菌的数量较大,稀释倍数大,因此引入的不确定度均较大。稀释过程中使用吸量管与移液器相比,使用吸量管带入的不确定度略小,且使用吸量管对加样过程带入的不确定度、合成相对标准不确定度和扩展不确定度均略小,而使用吸量管对A 类不确定度的影响比使用移液器略大。另外,使用两种量具对同一益生菌类保健食品中双歧杆菌进行计数,结果差异显著。应进一步分析产生差异的原因,使用哪种量具计数结果更为准确,以及如何缩小或消除这种差异。
