产超氧化物歧化酶乳酸菌的筛选及发酵条件优化
2021-11-22张秋月黎谢飞曾小群蔡振东郭宇星潘道东
张秋月,黎谢飞,曾小群,吴 振,蔡振东,郭宇星,潘道东,*
(1 宁波大学食品与药学学院 浙江省动物蛋白食品精深加工技术重点实验室 浙江宁波 315211 2 南京师范大学食品与制药工程学院 南京 210097)
乳酸菌(Lactic acid bacteria,LAB)是一类革兰氏阳性、过氧化氢酶阴性,不产芽孢、厌氧或兼性好氧的球菌或杆菌,可发酵各种碳水化合物产生乳酸[1]。乳酸菌作为一种被认可的益生菌,可抑制发酵和非发酵产品中真菌的生长,提高产品的安全性[2];可增强机体免疫力,缓解氧化应激引起的相关疾病[3-4];改善发酵食品风味,提高食品质量和感官特性[5-6]。目前,从自然界和各种传统发酵产品中筛选具有多种功能的乳酸菌备受关注,也成为研究热点之一。李丹阳等[7]从新疆风干肉中筛选的乳酸乳球菌A-18 和戊糖片球菌C-11 产蛋白酶较高,且具有较好的耐酸、耐胆盐特性,可应用于发酵肉制品中品质控制的研究;刘孝芳等[8]从生鲜牛奶中筛选的植物乳杆菌具有高胆盐水解酶活性,可水解胃肠道中的甘氨胆酸盐产生游离态胆酸,与胆固醇共沉淀排出体外,为降胆固醇产品的开发奠定了基础。
活性氧(Reactive oxygen species,ROS)是一类含有不成对电子的原子或原子团,主要包括氧自由基、过氧化氢(H2O2)、单线态氧和臭氧[9]。生物体内的ROS 可与脂质、细胞膜和蛋白质发生反应,对细胞造成不可逆的损伤,其中危害最大的是超氧阴离子自由基。超氧化物歧化酶(Superoxide dismutase,SOD)是一种金属蛋白,它含有铜、锌、锰、铁或镍作为天然的辅基,可催化超氧阴离子自由基歧化成分子氧和过氧化氢,是抗氧化酶防御系统的第1 道防线,也是最重要的一道防线[10]。根据金属辅助因子的不同,将SOD 分为4 种类型:Cu/Zn-SOD、Ni-SOD、Mn-SOD 和Fe-SOD[11-12],这些SOD 分布在细胞的不同区域,在应对氧化应激中起关键作用[13]。
目前,针对SOD 的研究主要集中在临床医学研究、食品保藏、化妆品和植物抗逆性等4 个方面[14]。使用由邻香草醛和柔性脂肪胺合成的含有双核结构的Mn-SOD 模拟化合物可显著抑制促炎因子,减轻肝脏炎症反应,具有保护肝脏的作用[15];从植物中提取的SOD 通过冷冻干燥得到的冻干粉是食品生产中稳定性较高的酶制剂[16],可抑制过氧化酶活性,减少食品变质及腐败,同时还可用作水果和蔬菜的保鲜剂[17]。本文从传统发酵食品中筛选高产SOD 的乳酸菌菌株,采用正交试验法优化菌株产SOD 的培养条件,为高产SOD 乳酸菌的工业应用提供理论基础。
1 材料与方法
1.1 材料与试剂
长沙臭豆腐(C),绍兴臭豆腐(S),宁波臭豆腐(N),南京臭豆腐(J),贵州泡菜(G)均为农家制作。
MRS 琼脂、MRS 肉汤,青岛Hopebio 公司;无水碳酸钙、氯化钠、30%过氧化氢溶液,国药化学试剂有限公司;总DNA 提取试剂盒、DNA marker,北京Trans Gen 生物技术有限公司;革兰氏染色液试剂盒,北京Solarbio 公司;100 mmol/L PBS缓冲液 (pH 7.2~7.4),上海莱博科技有限公司;SOD 测定试剂盒,南京建成生物工程研究所;BCA蛋白测定试剂盒,康为世纪生物科技有限公司。
1.2 仪器及设备
QHZ-12A 型组合式恒温振荡培养箱,江苏盛蓝仪器制造有限公司;YXQ-30SII 型立式高压灭菌锅,济南捷岛分析仪器有限公司;Axio 显微镜,德国ZEISS 公司;5804R 型高速冷冻离心机,德国艾本德有限公司;MultiGeneTM梯度PCR 仪,美国莱伯特公司;Infinite M200 PRO 型多功能酶标仪,瑞士TECAN 公司;SCIENTZ-ⅡD 型超声波细胞粉碎机,宁波新芝生物科技股份有限公司。
1.3 试验方法
1.3.1 乳酸菌的分离纯化 用无菌PBS 对样品进行梯度稀释,涂布于含0.1 g/L 碳酸钙的MRS 琼脂培养基中,37 ℃倒置培养24~48 h,挑选菌落形态不同且有明显碳酸钙溶解能力的菌株进行划线分离,分离3~5 代,直至得到纯的培养物。对分离纯化得到的菌株进行过氧化氢酶触实验和革兰氏染色,将过氧化氢实验呈阴性和革兰氏染色呈阳性的菌株用体积分数30%的甘油冷冻保藏于-40℃超低温冰箱中。
1.3.2 抗过氧化氢乳酸菌的筛选 细胞中引起氧化应激的因素有很多,在体外,过氧化氢常被用来构建细胞的氧化损伤模型,研究抗氧化剂对细胞的保护作用。本试验中乳酸菌抗过氧化氢能力的测定根据陈晓琳等[18]的方法稍作改进,初步筛选具有抗氧化能力的菌株,将生长良好的菌株做好标记,用于下一步SOD 酶活性的测定。
1.3.3 乳酸菌无细胞提取物的制备 取2 mL 活化培养的菌液于100 mL MRS 肉汤培养基中,37℃培养18 h,6 000 r/min 离心10 min,弃上清,用无菌PBS 洗3 次,将菌体重悬于PBS 溶液中,调整菌液密度至OD600nm=1.0,混匀。在冰浴条件下,用超声细胞粉碎机对样品进行破碎,4 ℃,10 000 r/min 离心30 min,取上清,用于SOD 酶活性的测定。
1.3.4 SOD 酶活性的测定 SOD 酶活性的测定按照SOD 检测试剂盒的步骤进行。以PBS 为对照,在测定过程中样品的浓度需稀释至抑制率在40%~60%范围内,在此之间酶活性的测定具有较高的精确度。规定当SOD 的抑制率达50%时,所对应的酶量为一个SOD 活力单位(U)。
参照BCA 蛋白定量试剂盒的说明书,制作蛋白标准曲线。
1.3.5 16S rRNA 分子生物学鉴定 对SOD 酶活性高的菌株进行16S rRNA 分子鉴定,分析方法在Hasan-Beikdashti[19]基础上进行了一些修改。取1 mL 过夜培养的菌液,用DNA 试剂盒提取DNA,相关步骤参照DNA 提取试剂盒进行。以DNA 为模板进行聚合酶链式反应(PCR),上游引物27F:5’-AGAGTTTGATCCTGGCTCAG-3’,下游引物1492R:5’-GGTTACCTTGTTACGACTT-3’,PCR 反应组分如表1所示。

表1 PCR 反应体系组分Table 1 The components of PCR
将各组分按照上表加样后进行PCR 扩增反应,扩增产物采用1%的琼脂糖凝胶电泳进行鉴定,选取在1 500 bp 处有单一条带的样品送上海生物工程有限公司测序,利用BLAST 将分离得到的序列与Gen Bank 中的序列进行比较,通过MEGA 软件建立系统发育树,对筛选菌株进行鉴定。
1.3.6 生长曲线和产酸曲线的测定 将活化后的菌液以2%的接种量接种至100 mL MRS 肉汤培养基中,37 ℃连续培养30 h,每隔2 h 进行一次菌密度和pH 值的测定,连续测定30 h,分析数据并绘制生长曲线和pH 变化曲线[20]。
1.3.7 单因素实验 为方便后续食品加工中对菌株产SOD 能力的判定,优化实验过程中菌株的酶活性用U/mL 来表示。
温度:将活化后的菌株分别在20,25,30,37,42 ℃下培养18 h,混匀锥形瓶,取相同体积的菌液,无菌PBS 洗2 次,最终重悬于相同体积的PBS中用于SOD 酶活性测定,每组试验做3 个重复,下同。
接种量:将活化后的菌株密度调整为一致,按照1%,2%,3%,4%,5%的比例接种至MRS 肉汤培养基中,在相同的温度下连续培养18 h 后测定菌株的SOD 酶活性。
pH 值:分别用1 mol/L 的盐酸和1 mol/L 的氢氧化钠将MRS 肉汤培养基的pH 值调至5.5,6.0,6.5,7.0,7.5 和8.0。在相同培养条件下对菌株的SOD 酶活性进行测定。
装液量:将活化后的菌液分别接种至50,75,100,125,150 mL 的MRS 肉汤培养基中,连续培养18 h 后,4 ℃8 000 r/min 离心10 min,无菌PBS洗涤,测定菌株的SOD 酶活性,确定最佳装液量。
1.3.8 正交试验设计 根据单因素实验筛选出菌株产SOD 的最佳发酵温度、接种量、pH 值和装液量,设计4 因素3 水平的L9(34)正交试验,根据SOD 的活性进一步确定菌株的最佳发酵条件。
2 结果与分析
2.1 乳酸菌的分离和过氧化氢抗性试验
从5 份样品中筛选出了104 株在CaCO3-MRS 琼脂培养基上具有明显钙溶圈且与乳酸菌有相似表型特征的菌株进行分离纯化[21]。其中,20 株来自长沙臭豆腐 (编号C1~C20),22 株来自绍兴臭豆腐(编号S1~S22),20 株来自宁波臭豆腐(编号N1~N20),20 株来自南京臭豆腐 (编号J1~J20),22 株来自贵州泡菜(编号G1~G22)。对这些分离的菌株进行革兰氏染色和过氧化氢酶触试验,所有挑选的菌株都表现出过氧化氢酶阴性、革兰氏阳性。根据对过氧化氢抗性能力的测定,初步筛选出20 株具有抗氧化能力的菌株,用作下一步酶活性的测定。
2.2 超氧化物歧化酶活性的测定
初步筛选出20 株对过氧化氢有抗性的乳酸菌,用SOD 检测试剂盒对20 株乳酸菌进行酶活性测定,结果如图1所示(酶活性低且差异性不显著的数据未显示)。

图1 乳酸菌产SOD 的差异水平分析Fig.1 Different level analysis of SOD produced by lactic acid bacteria
如图1所示,C8 产SOD 的酶活性最高,达349.62 U/mg,其次是S9、N2、N3 和C18。N5、N6、J7和G2 之间的SOD 酶活性不存在显著性差异(P>0.05),J15 和C18 的酶活性不存在显著差异(P>0.05),C8 的SOD 酶活性大小是G2 的4.2 倍,J15的2.1 倍,可作为高产SOD 酶的菌株做进一步的研究。
2.3 产SOD 乳酸菌的鉴定
C8 的碳酸钙溶解能力和革兰氏染色如图2A和2B 所示,根据16S rRNA 基因序列,通过同源性分析构建的系统发育树如图2C 所示。C8 属于乳球菌属(Lactococcus),与已知菌株Lactococcus lacticL105 的序列同源性达到100%,可将其确定为乳酸乳球菌。
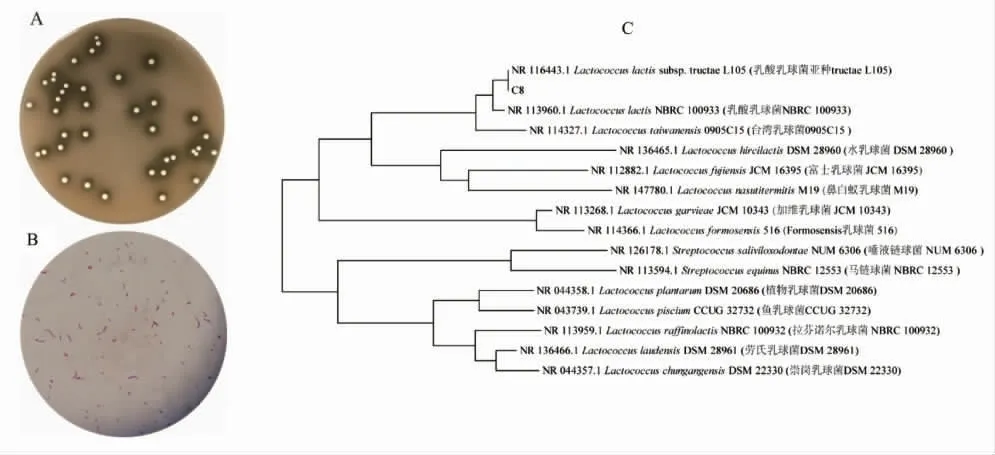
图2 C8 的菌落形态特征和分子鉴定Fig.2 Colony morphology and molecular identification of C8
2.4 菌株生长特性和产酸能力的分析
乳酸乳球菌在30 h 内的生长曲线和产酸曲线如图3所示,菌株在培养4 h 后OD 值显著上升,pH 曲线和生长曲线保持相同的趋势,在培养4 h 后,pH 值开始下降。结果表明,乳酸乳球菌在4~12 h 间处于快速增长的对数期,培养18 h 后增长缓慢,进入稳定期。Sorde 等[22]对菌株B4 和C2产新型谷氨酰胺转胺酶的培养条件进行优化,发现酶的最大产量均出现在生长稳定期。因此选择培养18 h 时的菌株进行产酶条件优化。

图3 乳酸乳球菌生长曲线和pH 值变化曲线Fig.3 The growth curve and pH value change curve of Lactococcus lactis
2.5 单因素实验结果
乳酸乳球菌在不同发酵温度(20~42 ℃)下的SOD 活性如图4a 所示。结果表明,随着温度的升高,SOD 的活性从20 ℃的14.2 U/mL 逐渐增加到37 ℃的46.7 U/mL,提高了3.3 倍。30 ℃条件下培养的乳酸乳球菌SOD 的产量虽然高于25 ℃,但两者无显著性差异(P>0.05)。当温度从37 ℃上升到42 ℃时,酶的产量急剧下降到6.4 U/mL。在37 ℃培养条件下,乳酸乳球菌产SOD 的量分别是20,25,30,42 ℃的3.3,1.13,1.1,7.3 倍。研究结果表明,培养温度过高(42 ℃)或过低(20 ℃)均会对乳酸乳球菌的SOD 活性产生显著影响,可能非最适培养温度不利于乳酸乳球菌的生长,进而影响酶的积累。在特定的接种浓度和培养时间下,乳酸乳球菌在37 ℃具有最高酶活性,可作为最优产酶温度用于SOD 的生产。
为确定乳酸乳球菌产SOD 的最优初始接种量,将菌株以不同比例接种于MRS 肉汤培养基,37 ℃培养18 h 后测定SOD 的活性。结果如图4b所示,SOD 酶的变化与温度优化的趋势相似,随着菌液接种量的增加,乳酸乳球菌产SOD 的能力不断增强,在接种量为3%时,达到最大酶活(60.5 U/mL)。接种量为4%和5%时,SOD 的活性逐渐下降,分别为58.3,47.8 U/mL,两者存在显著差异(P≤0.05)。与3%接种量相比,以4%接种量培养的乳酸乳球菌SOD 活性略有下降,然而两者无显著性差异(P>0.05)。结果表明,在37 ℃培养条件下,初始接种量为3%时,乳酸乳球菌的SOD 酶活性最高,接种量低于或高于3%均会影响SOD 的产量,可能由于固有培养基的营养成分在3%的接种量时,可达到最大利用率,接种量越大越不利于菌株的生长,或者在接种量大的培养条件下菌株不能达到生长的稳定期,不利于SOD 酶的积累。
通过调节培养基的初始pH 值,比较在不同pH 环境下乳酸乳球菌产SOD 的差异性。结果如图4c 所示,在中性或弱碱性条件下,乳酸乳球菌产SOD 的能力显著高于弱酸性条件(P≤0.05)。在pH 5.5 和pH 6.0 的弱酸性条件下,培养的乳酸乳球菌SOD 活性较低,分别为59.21 U/mL 和60.12 U/mL,两者不存在显著性差异(P>0.05)。在初始pH 值为7.5 的弱碱性条件下,菌株的SOD 活性达76.69 U/mL。结果表明,与弱酸性条件相比,弱碱性的培养环境更有利于乳酸乳球菌SOD 的生成,可能由于弱碱性环境有利于乳酸菌产生乳酸,促进乳酸菌生长。
图4d 表明不同灌装量对乳酸乳球菌产SOD的影响。如图所示SOD 的活性随培养基体积的增加而逐渐降低,从92 U/mL(75 mL)降至86.1 U/mL(150 mL)。在150 mL 和50 mL、100 mL 和125 mL中培养的乳酸乳球菌SOD 的活性无显著差异(P>0.05)。结果表明,在250 mL 锥形瓶中,当灌装量为75 mL 时,SOD 活性最高。灌装量的多少反映了菌株发酵过程中的通气量,影响菌体的生长[18]。在本研究中灌装量的多少直接影响乳酸乳球菌的生长和SOD 酶的积累,75 mL 可作为最佳的装液量。
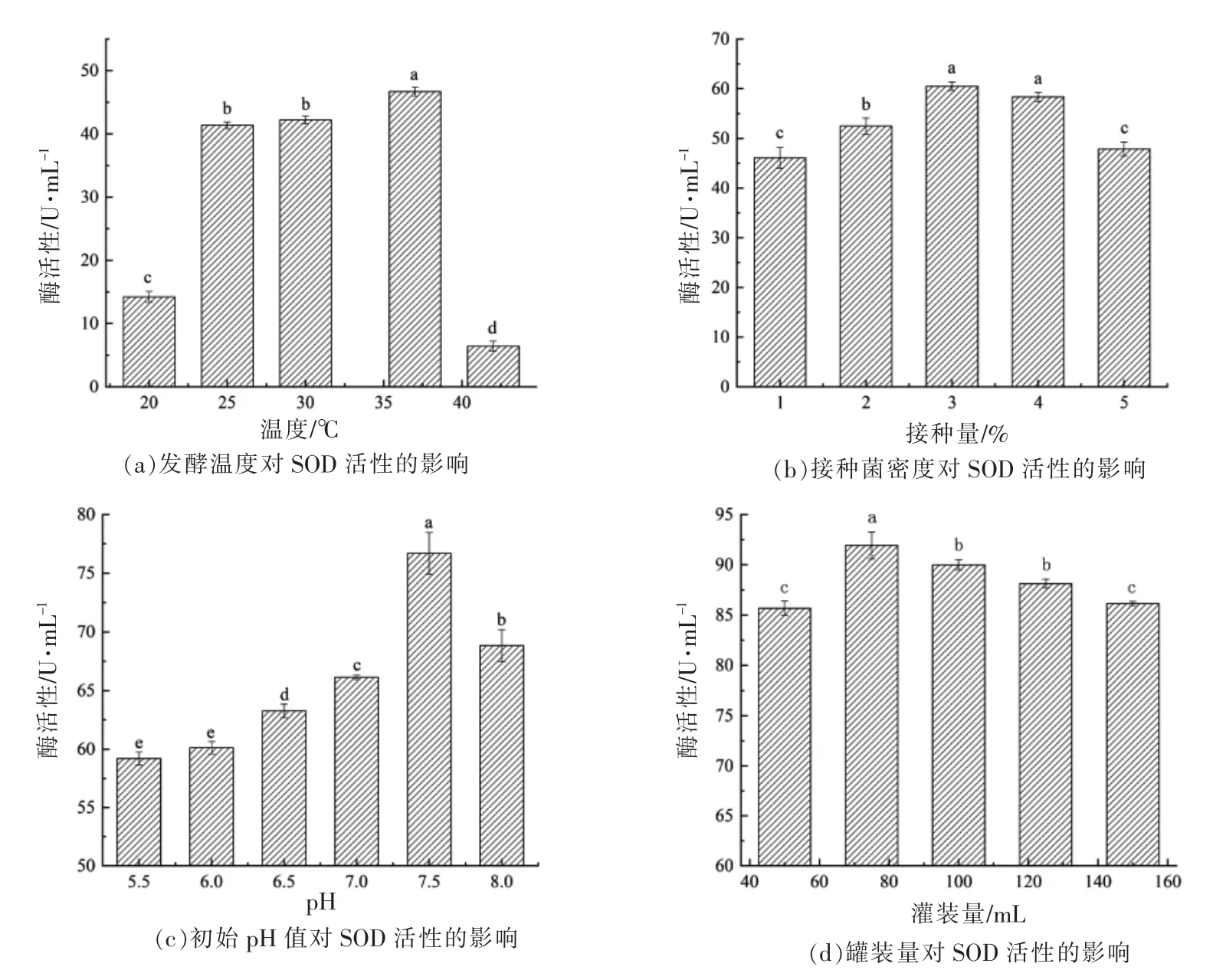
图4 不同培养条件下乳酸乳球菌产SOD 的能力Fig.4 The ability of Lactococcus lactis to produce SOD under different culture conditions
2.6 正交试验设计及结果
根据单因素实验结果设计的正交试验如表2所示。在不同发酵条件下测定各组SOD 的活性,结果如表3所示。

表2 正交试验设计表Table 2 The design of orthogonal experiments

表3 正交试验结果Table 3 Results of orthogonal experiments
由极差R可知,各发酵条件对乳酸乳球菌产SOD 活性的影响顺序为温度(A)>pH(C)>接种量(B)>装液量(D),表明温度和初始pH 值对菌株产SOD 能力的影响显著。根据k1、k2和k3可知,最优水平组合为A2B2C2D2,其SOD 的活性如表4所示。最优组合的SOD 活性较优化前提高了2 倍多,三者存在显著性差异,可确定最优组合为:发酵温度37 ℃、接种量3%、初始pH 值7.5、最佳装液量75 mL。

表4 正交试验的验证Table 4 Verification of orthogonal experiments
3 讨论与结论
传统发酵食品是筛选具备各种功能乳酸菌的主要来源,例如:泡菜、干腌肉和奶酪,其中乳酸菌为发酵产品提供了额外的益生菌特性[23-24]。SOD 是一种内源性抗氧化酶,主要来源于真核生物,如植物和动物[25-26],具有较强的抗氧化能力,可催化超氧阴离子产生氧气[27]。真核生物中对SOD 的纯化可显著提高SOD 的活性,被广泛用作抗衰老配方的添加剂。Santos 等[28]采用DEAE 生物凝胶柱对来自脱硫弧菌的Fe-SOD 进行纯化,纯化后酶活性达到1 900 U/mg。Thakur 等[29]测定了来自地衣芽孢杆菌SPB-13 的热稳定性Fe/Mn-SOD,其粗酶活力达245.12 U/mg,纯化后为3 965.51 U/mg。与真核微生物相比,产SOD 的乳酸菌具有更多的优势特性,在食品中的应用更为广泛。首先,乳酸菌可作为发酵剂直接在发酵食品中使用,其次乳酸菌产生的SOD 不需要繁琐的纯化步骤。本研究从长沙臭豆腐中筛选出一株SOD 活性达349.62 U/mg 的乳酸乳球菌,可用作发酵产品的发酵剂,提高产品的功能特性。
得到具有高活性的SOD 不仅需要筛选潜在产SOD 的菌株,还需要优化其培养条件。张海玲等[30]采用正交试验法优化重组酵母产SOD 的发酵条件,在培养温度28 ℃,接种体积分数1%,诱导体积分数1%的条件下,重组酵母产SOD 的活性显著提高近3 倍。李晓艳等[31]对海洋来源的植物乳杆菌CLP0279 产低温SOD 的发酵条件进行优化,在发酵温度20 ℃,时间68 h,初始pH 7.0,接种量8%,装液量75 mL 的条件下,植物乳杆菌产SOD 的活性提高了1.32 倍。本研究在此基础上通过单因素实验研究了发酵温度、接种量、初始pH值和灌装量对乳酸乳球菌SOD 活性的影响,并通过正交试验进行优化,得到最优培养条件为发酵温度37 ℃,接种量3%,初始pH 7.5,灌装量75 mL。乳酸乳球菌经优化培养后产SOD 的活性提高2 倍多,可为后期工业化生产提供数据参考。
今后,可在此优化条件下继续深入研究:(1)乳酸乳球菌与保加利亚乳杆菌和嗜热链球菌的菌群效应如何? 是否可显著提高菌群的SOD 活性?(2)乳酸乳球菌是否会对发酵乳的品质产生影响?与市售发酵乳相比,是否可提高发酵乳的总抗氧化能力? 本研究的深入探索可为功能性发酵乳的研发提供可实施的思路和基础。
