反复/连续湿热处理对小麦B淀粉结构、理化性质和消化性能的影响
2021-11-22梁思远申慧珊苏春燕李文浩
梁思远,申慧珊,宫 冰,苏春燕,张 波,李文浩
(西北农林科技大学食品科学与工程学院 陕西杨凌 712100)
小麦淀粉中存在粒径较大的(10~35 μm)A 淀粉和较小(<10 μm)的B 淀粉,通常A 淀粉的质量占70%~90%,而颗粒数量少于30%,B 淀粉颗粒数量占90%以上,质量小于30%,A、B 淀粉在结构、理化性质、功能和利用价值方面存在差异[1-2]。小麦淀粉的这种特异性组成对小麦面团的形成、流变学特性和各种面制品的加工也有影响,面团中A、B 淀粉的比例会显著影响面团的流变学性质,面条的颜色,烹饪质量,质构特性和感官品质[3-5]。目前,A 淀粉通常作为成品淀粉广泛应用于各领域,而B 淀粉作为小麦淀粉、谷朊粉生产中的副产物,大多被当作废弃物处理,其有限的利用包括作为发酵培养基和饲料,制备糖浆、糊精、味精、酒精、柠檬酸和α-淀粉等,这些利用也存在一些问题,主要与其色泽较暗和黏性较大等因素有关[6-7]。通过各种物理、化学和生物手段对小麦B 淀粉进行改性,对扩大其应用范围具有重要意义。
湿热处理(Heat-moisture treatments,HMT)是在较低水分含量(10%~30%)和较高温度(90~120℃)下处理淀粉的一种物理改性方法[8]。与化学改性方法相比,HMT 具有变性程度高、操作简单、成本低、效率高、无废弃物等优点。HMT 可显著改变谷类[9-10]、薯类[11-12]和豆类淀粉[13-14]的结构、理化性质和消化特性。HMT 可以降低淀粉的结晶度[13]、溶解度和膨胀力[12],提高淀粉的热稳定性和剪切稳定性,使淀粉不易老化[15]。同时,HMT 还提高淀粉的消化率,降低不同淀粉对β-淀粉酶的敏感性[14]。HMT 所诱导的淀粉结构、性质和消化性的改变程度取决于处理温度、处理时间和淀粉来源[8-14]。有研究表明反复湿热处理 (Repeated heat-moisture treatments,RHMT) 较传统的连续湿热处理(Continuous heat-moisture treatments,CHMT)能更显著地引起淀粉结构、性质及其消化性能的改变[13-14]。本文系统研究了不同处理时间RHMT 和不同处理次数CHMT 及其二者在相同处理时间条件下对B淀粉结构、理化性质和消化特性的影响,以期为揭示RHMT 和CHMT 的变性机理,扩大小麦B 淀粉在食品加工中的应用提供理论依据。
1 材料与方法
1.1 材料与试剂
普通小麦面粉(西农979),河南希优种业有限公司;糖化酶、猪胰α-淀粉酶,阿拉丁试剂公司;其它试剂均为分析纯级。
1.2 设备与仪器
FW100 高速万能粉碎机,天津市泰斯特仪器有限公司;DHG-9123A 电热恒温鼓风干燥箱、Dk-S24 电热恒温水浴锅,上海精宏仪器有限公司;S-3400N 扫描电子显微镜,日本日立高新技术公司;LeciA TCS SP8 激光共聚焦显微镜,德国莱卡公司;SUPER3 快速黏度分析仪,瑞典Perten 公司;Q2000 差示扫描量热分析仪,美国TA 仪器公司。
1.3 试验方法
1.3.1 小麦B 淀粉提取 向小麦面粉中加入60%的蒸馏水调制成面团,室温静置20 min 后水洗面团,将淀粉浆过100 目筛,然后3 000 r/min 离心10 min,弃上清液,小心刮去上层淡黄色物质,收集下层淀粉,置于40 ℃烘箱烘干,粉碎、过100 目筛,即得小麦淀粉样品。将50 g 小麦淀粉悬浮于400 mL 去离子水中,静置1 h 后吸取上层悬浮液250 mL,加水至原刻度,重复12 次,收集全部上层悬浮液。将收集的悬浮液4 000 r/min 离心20 min,烘干得小麦B 淀粉。制备的B 淀粉采用《食品安全国家标准 食品中水分的测定》(GB 5009.3-2016)、《食品安全国家标准 食品中灰分的测定》(GB 5009.4-2016)、《食品安全国家标准 食品中蛋白质的测定》(GB 5009.5-2016)、《食品安全国家标准 食品中脂肪的测定》(GB 5009.6-2016)、《大米 直链淀粉含量的测定》(GB/T15683-2008)分析,其基本组成为:水分10.09%,灰分0.26%,粗蛋白0.30%,脂肪0.28%,直链淀粉27.83%。
1.3.2 淀粉湿热处理
1.3.2.1 反复湿热处理 取适量B 淀粉放入丝口瓶中,调整水分含量为30%,混匀,密封后在室温放置24 h 平衡水分。然后,将淀粉放入120 ℃烘箱中处理2 h,取出,自然冷却,烘干、粉碎、过100 目筛,即得反复湿热处理1 次的淀粉(RHM-1)。按上述步骤重复处理2~6 次,分别获得反复湿热处理 的 淀 粉RHM-2、RHM-3、RHM-4、RHM-5、RHM-6。
1.3.2.2 连续湿热处理 取适量B 淀粉放入丝口瓶中,调整水分含量为30%,混匀,密封后在室温放置24 h 平衡水分。然后,将淀粉放入120 ℃烘箱中分别处理2,4,6,8,10,12 h,取出,自然冷却,烘干、粉碎、过100 目筛,获得连续湿热处理的淀粉CHM-2、CHM-4、CHM-6、CHM-8、CHM-10、CHM-12。
1.3.3 淀粉形态观察
1.3.3.1 扫描电子显微镜观察 将适当处理后的淀粉用导电胶布固定于载物台上,离子溅射喷金处理后,用扫描电镜观察、拍照,照片放大倍数1 000 倍。
1.3.3.2 激光共聚焦扫描显微镜观察 称取2 mg淀粉分散在4 μL 10 mmol/L 8-氨基芘-1,3,6-三磺酸三钠盐(APTS)溶液和4 μL 1 mol/L 氰基硼氢化钠溶液中,30 ℃反应15 h 后用1 mL 蒸馏水洗涤5 次,将淀粉颗粒悬浮于20 μL 甘油和水(1∶1)混合液中。取1 滴淀粉悬浮液于载玻片上,盖上盖玻片后用配备有100×Plan apo/1.4oil 镜头的激光共聚焦扫描显微镜观察荧光染色后淀粉颗粒的内部结构。激光发射波长500~600 nm[16]。
1.3.4 结晶特性的测定 采用步进扫描法。测定条件:特征射线为Cu 靶;管压40 kV;电流100 mA;测量角度4°~60°;步长0.02°;扫描速度6°/min。
1.3.5 膨胀力的测定 参考Hung 等[17]方法称取适量样品置于离心管中,配制成质量分数为2%的淀粉乳。取30 mL 置于恒温振荡水浴锅中,以10℃间隔从50 ℃加热至90 ℃,每个温度保持30 min。将加热的样品在冷水中迅速冷却至室温,以3 500 r/min 离心15 min,弃上清液,称量离心管中沉淀物质量。按公式(1)计算淀粉的膨胀力。
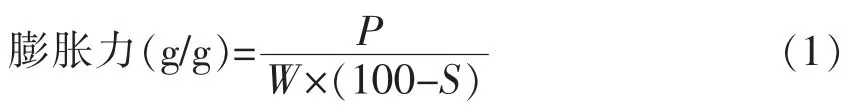
式中,P——离心管中沉淀物质量(g);W——淀粉样品质量(g);S——样品溶解度(%)。
1.3.6 糊化特性的测定 采用快速黏度分析仪(RVA)测定。称取3 g 淀粉,加入25 mL 蒸馏水,在RVA 专用盒内混匀,采用升温-降温循环程序,即:升温至50 ℃保持1 min,然后以12 ℃/min 的速率加热到95 ℃保持2.5 min,再以相同速率从95 ℃降至50 ℃保持2 min,测定糊化黏度曲线。
1.3.7 热力学特性的测定 采用差示扫描量热分析仪(DSC)测定。精确称取3 mg 淀粉于铝制干锅中,加9 μL 去离子水混匀,密封加盖,4 ℃平衡24 h,以空干锅为空白对照,以10 ℃/min 的速率从20℃升温至120 ℃,使用仪器自带软件计算初始温度(To)、峰值温度(Tp)、终止温度(Tc)和糊化焓(ΔH)。
1.3.8 体外消化特性的测定 制备混酶:称取7 g 猪胰α-淀粉酶,加入100 mL 醋酸钠缓冲溶液(pH 5.2),搅拌至溶解,3 000 r/min 离心10 min,取上清液。吸取2.5 mL 糖化酶用醋酸钠缓冲溶液(pH 5.2)定容至100 mL。
参考Englyst 等[18]方法,称取100 mg 样品于100 mL 锥形瓶中,加入10 mL 0.5 mol/L 醋酸钠-醋酸缓冲液 (pH 5.2),37 ℃平衡10 min,加入1 mL 糖化酶(2 500 U/mL)和4 mL 猪胰α-淀粉酶(3 000 U/mL),以200 r/min 转速摇动,分别在20 min 和120 min 取出,立即煮沸5 min,然后3 500 r/min 离心10 min,重复离心1 次,将上清液转移到100 mL 容量瓶中,定容。取1 mL 该溶液,用DNS 法测定还原糖含量。淀粉的各组分按公式(2)(3)(4)进行计算:
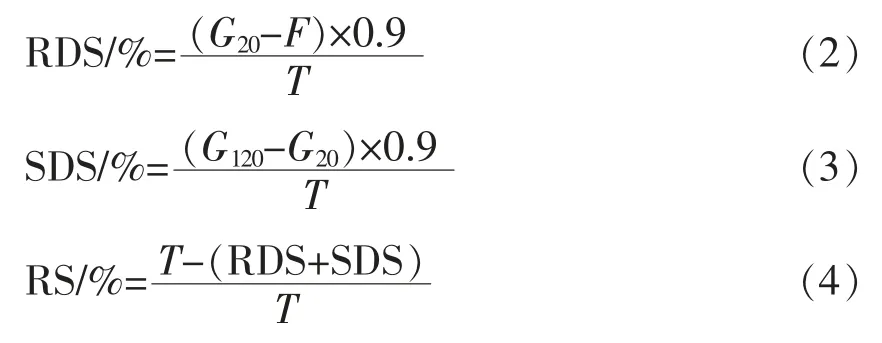
式中,G20——水解20 min 后产生的葡萄糖含量 (mg);F——水解前淀粉中游离葡萄糖含量(mg);G120——水解120 min 后产生的葡萄糖含量(mg);T——总淀粉含量(mg);RDS——快速消化淀粉含量(mg);SDS——慢速消化淀粉含量(mg);RS——抗性淀粉含量(mg)。
1.4 数据统计分析
分别采用SPSS 20.0 和Origin 8.0 对试验数据进行分析和图表制作,所有数据重复测定3 次,取平均值。
2 结果与分析
2.1 淀粉颗粒形态结构
图1显示在扫描电子显微镜下观察到的不同淀粉样品的颗粒形貌,小麦原B 淀粉呈圆形或椭圆形,表面光滑,颗粒较小。反复和连续湿热处理后,淀粉表面变粗糙,并出现孔洞,发生粘结现象,并且,随湿热处理次数和时间的增加,淀粉颗粒被破坏的程度加剧,表面孔洞增加,粘结现象严重,这是因为淀粉在特定水分含量和高温下发生部分或完全糊化[19]。在相同处理时间条件下,与RHMT淀粉相比,CHMT 淀粉的粘结现象更严重。


图1 小麦B 淀粉、CHMT 淀粉和RHMT 淀粉的颗粒形态Fig.1 Particle morphology of wheat B-starch,CHMT starch and RHMT starch
激光共聚焦扫描显微镜(CLSM)是观察淀粉颗粒内部结构的有效工具,常用来观察淀粉颗粒的通道、生长环、孔洞和直链淀粉分布情况等内部结构[20]。由于用CLSM 观察样品时,待测样品需具有荧光性,而淀粉颗粒不能自发荧光,因此用小分子染色剂APTS 提前对淀粉进行染色,APTS 与淀粉分子发生半缩醛反应,使淀粉分子的还原末端得到标记。不同淀粉样品的激光共聚焦显微镜如图2所示,小麦B 淀粉有种脐和生长环,淀粉围绕种脐向外生长,种脐区域的荧光强度高于其它区域,表明淀粉的种脐区域含较高比例的直链淀粉,这是因为与支链淀粉相比,直链淀粉中还原末端含量较高,更易与APTS 发生反应显示更强的荧光[20]。HMT 后,部分淀粉颗粒的荧光区域和种脐区域变暗,边缘和生长环变得模糊不清,这是由于HMT 过程中,直链淀粉-直链淀粉、直链淀粉-支链淀粉之间发生缔合,使淀粉结构被破坏[14]。

图2 小麦B 淀粉、CHMT 淀粉和RHMT 淀粉的激光共聚焦图Fig.2 CLSM images of wheat B-starch,CHMT starch and RHMT starch
2.2 结晶特性
小麦B 淀粉和HMT 淀粉的X 射线衍射图如图3所示,样品的相对结晶度和主要峰强见表1。小麦B 淀粉在15°,17°,18°,20°和23°(2θ)处出现衍射峰,是典型的A 型结晶模式,相对结晶度为28.86%。HMT 后,淀粉仍然为A 型结晶结构,而相对结晶度下降。随着HMT 次数和时间的增加,淀粉结晶度先下降后上升,分别在RHM-5 和CHM-10 时达到最小值。在湿热处理过程中,由于水分子的迁移作用,可导致淀粉分子间氢键断裂,双螺旋解旋,部分结晶结构被破坏,进而相对结晶度降低[9]。RHMT 5 次和CHMT 10 h 后,结晶度增加是因为被破坏的双螺旋结构重新缔合,淀粉链间的连接增强,形成了更稳定的结晶结构[14]。
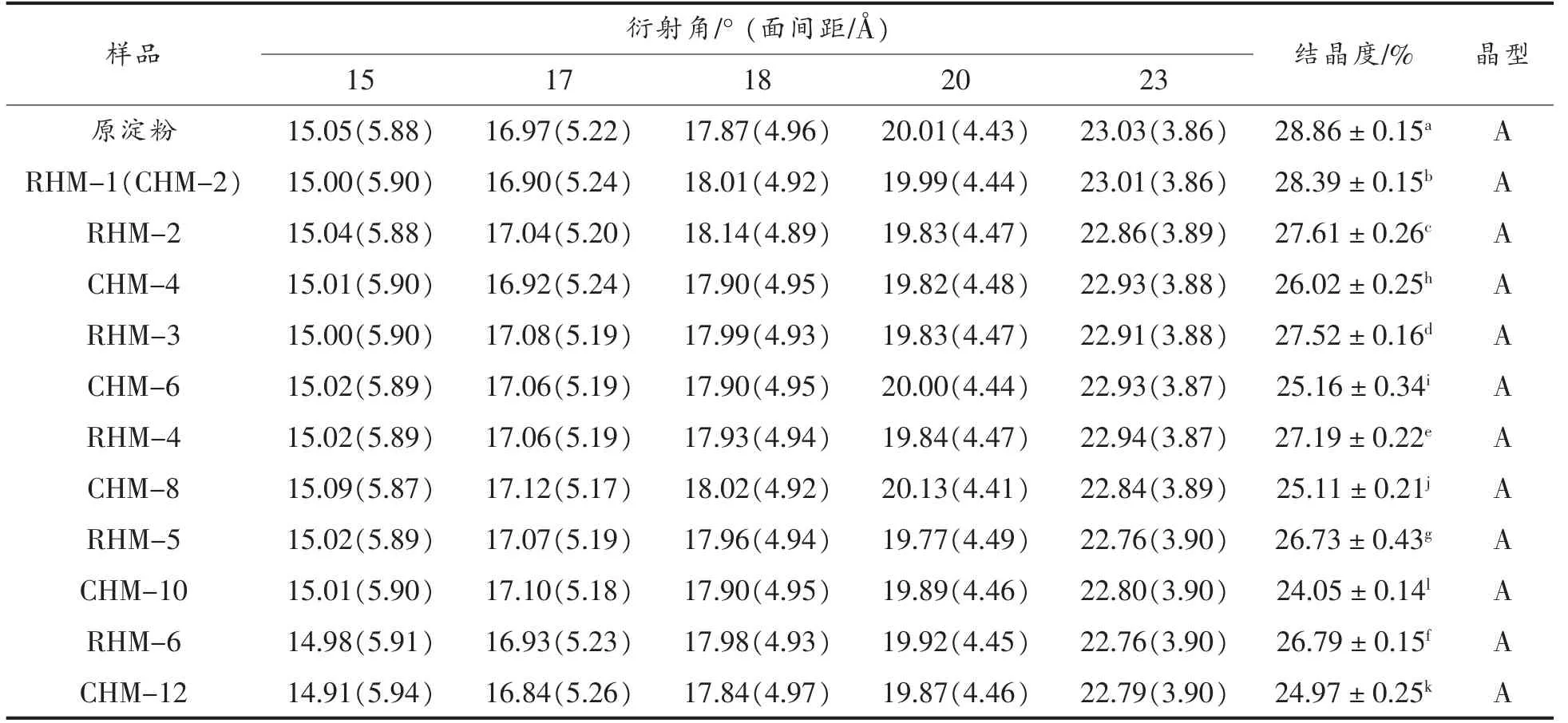
表1 小麦B 淀粉、CHMT 淀粉和RHMT 淀粉的X-射线衍射特征参数Table 1 The characteristic spectrum of X-ray diffraction pattern of wheat B-starch,CHMT starch and RHMT starch
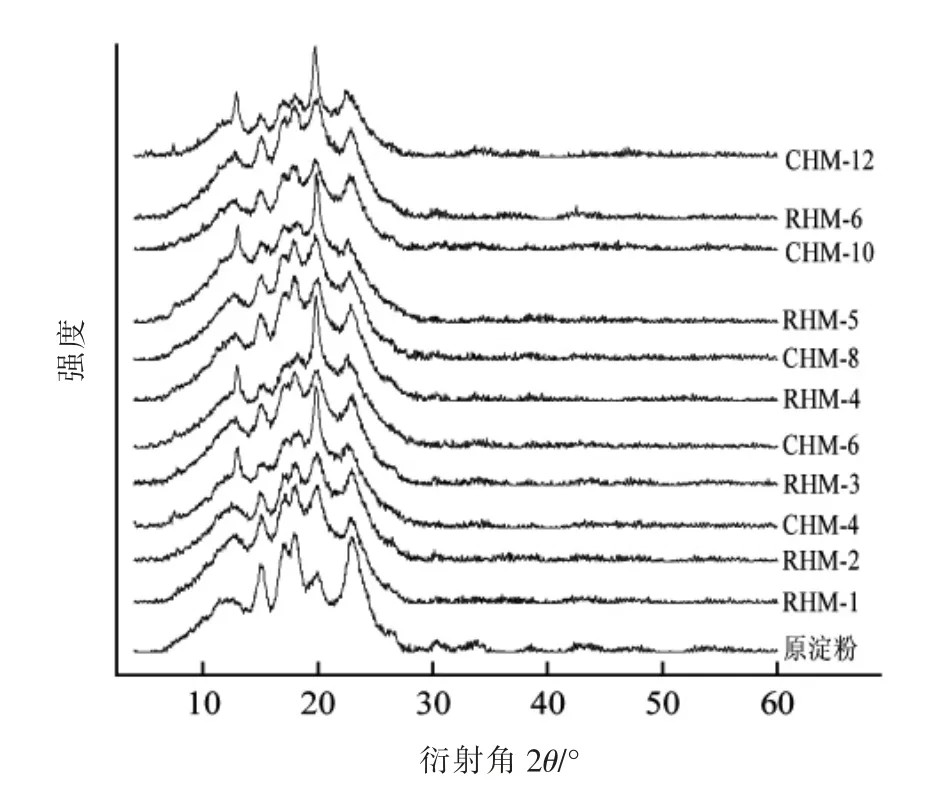
图3 小麦B 淀粉、CHMT 淀粉和RHMT 淀粉的X-射线衍射图谱Fig.3 X-ray diffraction pattern of wheat B-starch,CHMT starch and RHMT starch
在相同的处理时间内,RHMT 淀粉的相对结晶度高于CHMT 淀粉,这是由于在RHMT 的冷却过程中,水分子重新分布,淀粉的重结晶程度增强,形成更稳定的结晶结构。此外,在冷却过程中,水分子在淀粉分子间的重新分布更有利于结构的变化,RHMT 淀粉比CHMT 淀粉的内部作用力更强,从而导致RHMT 淀粉的结晶度更高[21]。
2.3 膨胀力
小麦B 淀粉和HMT 淀粉的膨胀力见表2。随着温度升高,所有淀粉样品的膨胀力显著增加,这是因为淀粉在高温下发生糊化,暴露出较多的羟基,从而结合更多的水分,使淀粉凝胶的膨胀力增大。与小麦B 淀粉相比,HMT 降低了淀粉的膨胀力。在50 ℃和60 ℃时,淀粉的膨胀力随HMT 次数和时间的增加逐渐下降,而在70~90 ℃时,膨胀力表现出先下降后上升的趋势,且在RHM-5 和CHM-10 时达到最小值。在红小豆淀粉中发现了相同的变化规律[14]。膨胀力的降低与淀粉分子重排有关,HMT 过程中结晶区和无定形区淀粉分子链的重排形成了有序的双螺旋支链淀粉簇,这种刚性结构限制了淀粉的膨胀[22]。HMT 过程中直链淀粉-直链淀粉、直链淀粉-支链淀粉之间的缔合增强,直链和支链淀粉的扩散量降低,可用于水合的羟基减少,因此,淀粉的膨胀力降低[8,14,23]。此外,淀粉-脂质复合物的形成也是膨胀力降低的原因[24]。

表2 小麦B 淀粉、CHMT 淀粉和RHMT 淀粉的膨胀力Table 2 Swelling power of wheat B-starch,CHMT starch and RHMT starch
在相同处理时间条件下,RHMT 淀粉的膨胀力低于CHMT 淀粉,这是由RHMT 过程中冷却造成的。在冷却过程中,水分子在淀粉分子之间重新分布,同时淀粉颗粒内直链和支链淀粉之间的进一步缔合增强了淀粉之间的氢键结合力,形成更稳定的结构,提高了RHMT 淀粉的结晶度。RHMT淀粉中支链淀粉的膨胀力和直链淀粉的扩散能力小于CHMT 淀粉[12-13]。
2.4 淀粉的糊化特性
小麦B 淀粉和HMT 淀粉样品的糊化特性见表3。与小麦B 淀粉相比,HMT 淀粉的峰值黏度、谷值黏度、崩解值、最终黏度和回生值显著降低,这与绿豆淀粉[13]、红小豆淀粉[14]、青稞淀粉[25]和小麦淀粉[26]的变化规律一致。这是因为HMT 使淀粉颗粒的结构更加致密,增强了淀粉在糊化过程中的耐热性和耐剪切性。此外,淀粉分子的降解使淀粉颗粒内部较小分子的数量增加,降低了糊化过程中淀粉分子链的缠绕,导致淀粉糊化黏度降低[27]。HMT 促进了更多的直链淀粉-直链淀粉、直链淀粉-支链淀粉的结合,减少了直链淀粉的浸出并降低了回生值[15]。
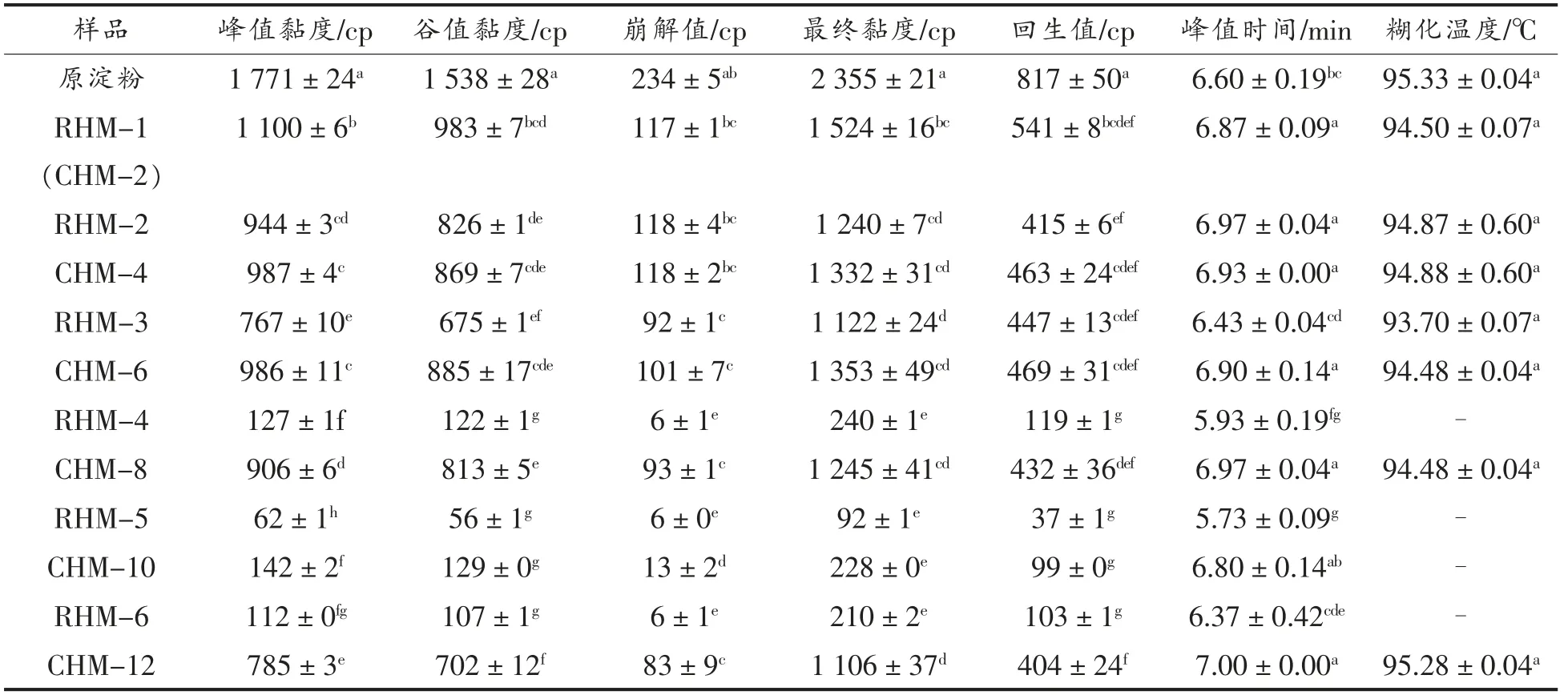
表3 小麦B 淀粉、CHMT 淀粉和RHMT 淀粉的糊化特性参数Table 3 Pasting properties of wheat B-starch,CHMT starch and RHMT starch
峰值黏度代表淀粉颗粒破裂前吸水膨胀的最大程度[28],与淀粉的膨胀力有关。随着HMT 次数和时间的增加,淀粉的峰值黏度先下降后上升,分别在RHM-5 和CHM-10 时达到最小值,这归因于HMT 淀粉颗粒的重结晶导致较低的吸水率,从而使峰值黏度降低。峰值黏度的变化与膨胀力一致(表2)。谷值黏度表示加热阶段结束时淀粉的最低黏度,谷值黏度随HMT 次数和时间的增加先下降后升高,分别在RHM-5 和CHM-10 时达到最小值。最终黏度代表淀粉冷糊的稳定性,与凝胶硬度、回生值和溢出的直链淀粉含量有关[16]。随着HMT 次数和时间的增加,最终黏度呈现先下降后上升的趋势,最终黏度下降是由于HMT 完善了淀粉的晶体结构并减少了直链淀粉的溢出。回生值反映淀粉的老化程度,回生值越低淀粉越难老化,回生值随HMT 次数和时间的增加显示出与最终黏度相同的变化趋势。崩解值表示淀粉糊的热稳定性,是峰值黏度和最终黏度的差值,随着RHMT次数的增加,崩解值逐渐降低,在RHM-4 以后趋于稳定,而随CHMT 时间的增加,崩解值先下降后上升,在CHM-10 时达到最小值,表明湿热处理后淀粉的热稳定性增强[15]。Huang 等[12]研究也表明RHMT 后淀粉的热稳定性增加。峰值时间是淀粉糊达到最大黏度所需的时间[16],反映淀粉糊化的难易程度。RHMT 淀粉的峰值时间随处理次数的增加呈先减少后增加的趋势,在RHM-5 时达到最小值,而CHMT 淀粉的峰值时间随处理时间的延长无显著性变化,表明与CHMT 相比,RHMT 会使淀粉在短时间内大量吸水膨胀。
在相同处理时间条件下,RHMT 淀粉的糊化黏度低于CHMT 淀粉,较低的黏度表明RHMT 后淀粉颗粒的结构更加稳定,分子间的内部作用力更强。其原因是RHMT 的冷却过程中,水分在淀粉分子之间重新分布,直链淀粉和支链淀粉之间的进一步折叠和缔合导致吸水率降低,因此淀粉糊化黏度下降[13-14]。
2.5 淀粉的热力学特性
由表4可知,HMT 淀粉的To、Tp和Tc值均高于小麦B 淀粉,这与Huang 等[12]的研究结果一致。To、Tp和Tc值的变化与直链淀粉含量、结晶区分子结构以及淀粉颗粒内支链淀粉链的形式和分布有关[29]。HMT 过程中,淀粉颗粒发生部分糊化,溶胀的淀粉分子的重排以及淀粉链之间的重新缔合同时发生,导致双螺旋结构的含量降低,晶体完善性提高,因此淀粉需要较高的温度才能发生凝胶化,从而导致To、Tp和Tc值增加[12]。ΔT值反映了淀粉颗粒内微晶体的不均匀性,HMT 淀粉的ΔT高于原淀粉,表明HMT 减弱了淀粉内微晶体的异质性[30]。ΔH反映淀粉解双螺旋结构所需的能量,HMT 导致淀粉的ΔH降低,原因是淀粉颗粒的结晶区和非结晶区域中的双螺旋结构遭到破坏[31],与Chen 等[26]研究结果一致。
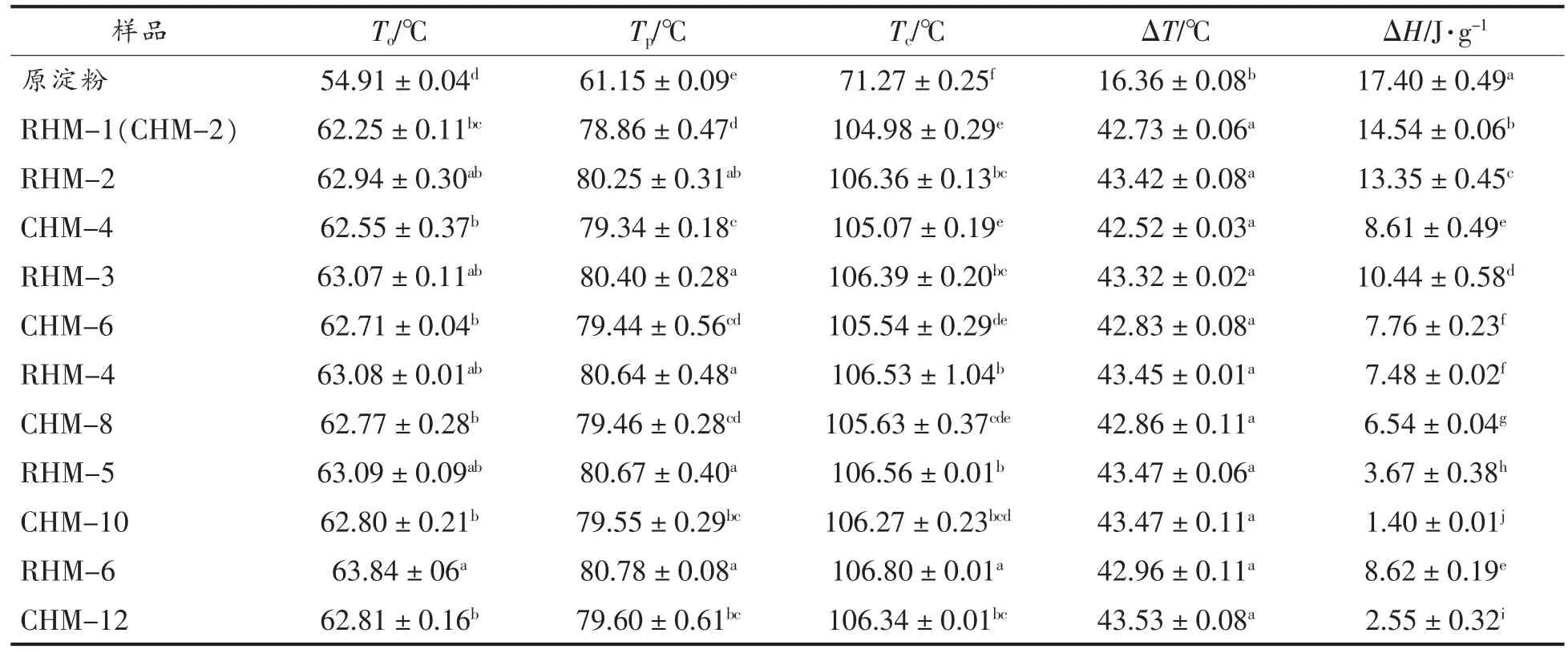
表4 小麦B 淀粉、CHMT 淀粉和RHMT 淀粉的热特征值参数Table 4 Thermal characteristics of wheat B-starch,CHMT starch and RHMT starch
随着HMT 次数和时间的增加,淀粉的To、Tp和Tc值逐渐增加,ΔT无显著性差异(P>0.05),ΔH先减小后增加,分别在RHM-5 和CHM-10 时达到最小值。随着处理时间的延长,淀粉链间的缔合逐渐增加,内部键的结合进一步增强,双螺旋结构变得更完善[12,19]。当处理时间相同时,RHMT 淀粉的ΔT和ΔH高于CHMT 淀粉,表明RHMT 淀粉的结构更稳定,原因可能是在RHMT 冷却阶段,淀粉颗粒内部的直链和支链淀粉的缔合引起淀粉分子重排和水分子重新分布,增强了淀粉分子之间的氢键,使晶体结构更加稳定[12-13]。
2.6 淀粉的体外消化特性
小麦B 淀粉和HMT 淀粉的消化特性见表5。与小麦B 淀粉相比,RHMT 淀粉的RDS 和SDS 含量增加,RS 含量降低,而CHMT 淀粉的RDS 和SDS 含量降低,RS 含量增加。随着HMT 次数和时间的增加,淀粉的RDS 含量先减小后增大,SDS含量先增大后减小,分别在RHM-5 和CHM-10时达到极值。当RHMT 次数少于5 次和CHMT 时间小于10 h 时,SDS 含量增加是由淀粉组织链结构的部分破坏和淀粉分子链之间的缔合减弱引起的。当处理次数和时间继续增加时,SDS 含量降低,可能是高温增强了淀粉链之间的缔合,使淀粉颗粒表面的晶体结构变得更完美[13]。
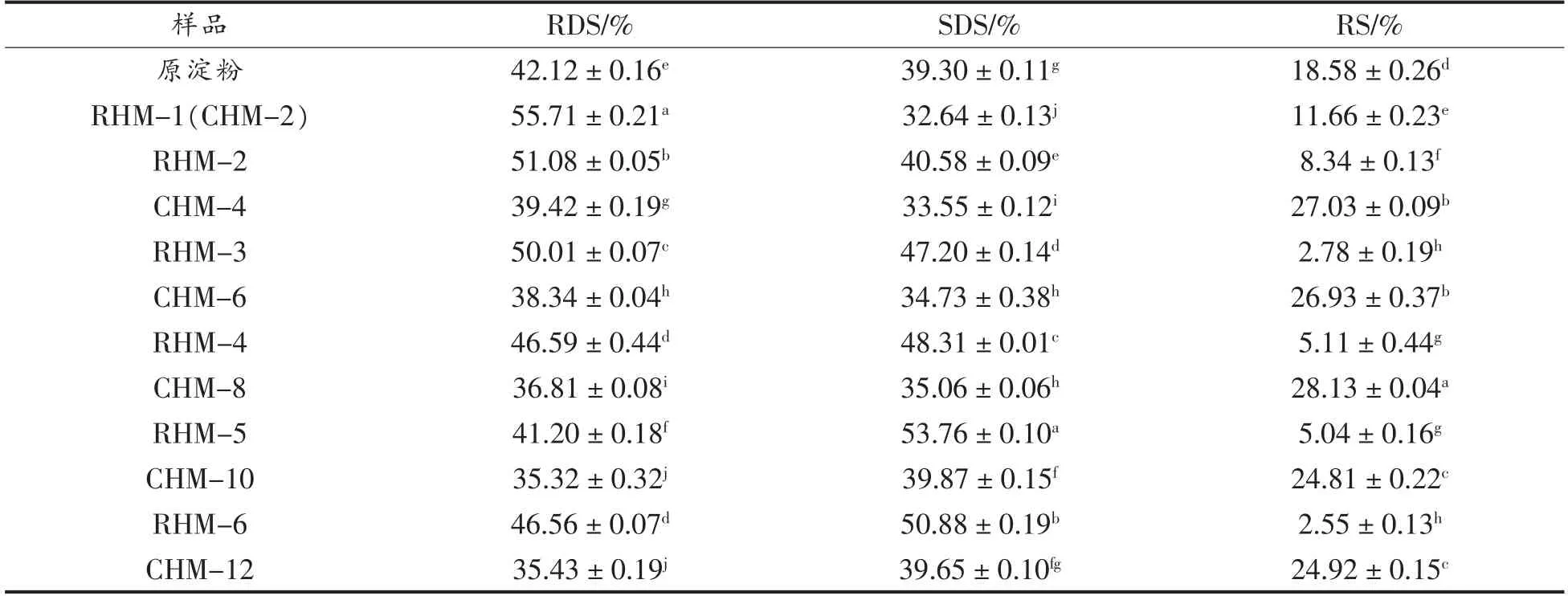
表5 小麦B 淀粉、CHMT 淀粉和RHMT 淀粉的体外消化性Table 5 In vitro digestibility of wheat B-starch,CHMT starch and RHMT starch
有研究表明HMT 可以增加RS 含量,而不会破坏颗粒结构[32]。连续湿热处理4 h 后,淀粉的RS含量显著增加,这是因为被破坏的淀粉分子链的重新组合使淀粉分子的晶体结构重新变得稳定,降低了对酶的敏感性[14]。此外,HMT 过程中淀粉-脂质复合物的形成会限制淀粉链被酶水解[32]。当处理时间相同时,RHMT 淀粉的RDS 和SDS 含量显著高于CHMT 淀粉,而RS 含量正好相反。RHMT 冷却过程中直链和支链淀粉之间的进一步缔合会增强淀粉链之间的氢键结合力,使淀粉的结构更稳定,加快SDS 的形成[13]。富含SDS 和RS的食物消化吸收慢,血糖生成指数低,有利于维持血糖稳定和机体饱腹感,适合糖尿病和肥胖症患者食用[13],因此,CHMT 淀粉比RHMT 淀粉更有利于人体健康。
3 结论
本文研究了RHMT 和CHMT 对小麦B 淀粉的结构、理化性质和消化特性的影响。反复和连续湿热处理后,淀粉颗粒表面出现孔洞,淀粉的To、Tp、Tc增加,而结晶度、膨胀力、糊化黏度和ΔH降低。在相同处理时间条件下,RHM 样品的结晶度、ΔT、ΔH、RDS 和SDS 含量显著高于CHM 样品,而膨胀力和糊化黏度的结果相反。与传统的CHMT相比,RHMT 冷却过程中水分子在淀粉分子之间重新分布,直链和支链淀粉之间的缔合增强了淀粉之间的氢键结合力,对淀粉结构、理化性质和消化特性的改变更为显著。本研究结果可为RHMT和CHMT 的应用提供依据,并为扩大小麦B 淀粉在工业生产中的应用和开发提供参考。
