SIRT3在人胎盘组织的时空性表达及意义*
2021-11-22朱盛兰张慧婷陈玉婷韦丽杰张婧怡
朱盛兰,张慧婷,江 一,陈玉婷,韦丽杰,张婧怡,周 璇,冯 玲
(华中科技大学同济医学院附属同济医院妇产科,武汉 430000)
胎盘作为母亲和胎儿之间唯一的交换器官,对妊娠和胎儿发育至关重要。胎盘发育包括子宫螺旋动脉的重铸,依赖滋养细胞在严格时空控制下的分化、增殖、迁移和侵袭[1]。胎盘发育异常与子痫前期、早产、流产和胎儿生长受限等多种妊娠疾病息息相关[2]。SIRT3,即沉默信息调节因子3(silence information regulator 3),它是由核基因组编码的一种去乙酰化酶。作为Sirtuins家族的一员,SIRT3这一线粒体高保真蛋白在许多生理和病理过程中发挥着重要作用。SIRT3可通过去乙酰化修饰多种线粒体蛋白,影响线粒体形态与功能,参与调节能量代谢、ROS清除、细胞周期、细胞内信号传导、侵袭以及迁移、细胞衰老等[3-4]。SIRT3也已被证实与衰老、神经退行性变、肝病、肾病、心脏病以及其他代谢性疾病相关[5]。SIRT3主要存在于肝脏、心脏及肾脏等富含线粒体、新陈代谢旺盛的器官。研究发现,SIRT3在子痫前期患者胎盘中表达降低,但是关于胎盘组织SIRT3蛋白的时空表达和细胞定位尚无报道[6-7]。本研究应用免疫组化法和免疫印迹法研究SIRT3在早、中、晚孕期人胎盘组织中的定位以及表达,并初步探讨其在胎盘发育中的意义。
1 材料与方法
1.1 临床样本 所用样本组织采集于2019年3月至2019年12月在华中科技大学同济医学院附属同济医院终止妊娠的患者。其中早孕期绒毛组织10例,取自因社会因素行负压吸引术人工流产的孕妇,孕周6~10周。中孕期胎盘组织9例,取自胎膜早破或宫颈机能不全所致流产者,孕周18~27周。晚孕期胎盘组织15例,取自单胎妊娠因合并子宫瘢痕或头盆不称及胎位异常行剖宫产者,孕周37~39周。绒毛、蜕膜及胎盘组织用无菌PBS清洗干净,一部分分装后于-80℃冻存,一部分用多聚甲醛固定,梯度酒精脱水后用石蜡包埋并切片。研究对象均无高血压、糖尿病、甲状腺疾病史,无家族遗传病史、感染性疾病及心血管疾病,无不良孕产史和孕期药物服用史。本研究通过医院伦理委员会批准,参与者均签署知情同意书。
1.2 主要试剂和材料 人早孕绒毛外滋养细胞系 HTR-8/SVneo(ACTT);RPMI 1640培养基(美国Hyclone公司);胎牛血清、Opti-MEM无血清培养基(美国Gibco公司);青链霉素、0.25%胰酶、免疫组化试剂盒(武汉Servicebio公司);Lipofectamine®3000转染试剂(美国Invitrogen公司);si-SIRT3及其非特异性阴性对照si-NC(广州RiboBio公司);逆转录及qRT-PCR试剂盒(南京Vazyme公司);MatrigelTM基质胶(美国BD公司);Transwell小室(美国Corning公司);RIPA裂解液、SDS-PAGE 凝胶配置试剂盒、BCA蛋白浓度测定试剂盒(上海Beyotime公司);PVDF膜(美国Millipore公司);ECL化学发光试剂盒(美国Advansta公司);兔抗人SIRT3单克隆抗体、鼠抗人CK7单克隆抗体(英国Abcam公司);鼠抗人β-actin单克隆抗体、HRP标记山羊抗兔二抗、HRP标记山羊抗鼠二抗(美国Abbkine公司)。
1.3 方法
1.3.1 免疫组化 组织蜡块连续切片,常规烘片、二甲苯脱蜡及梯度酒精水化,3%过氧化氢封闭内源性过氧化物酶,柠檬酸修复液(pH=6.0)高温抗原修复,冷却至室温,山羊血清封闭,滴加一抗(SIRT3,1∶100稀释;CK7,1∶200稀释),PBS代替一抗作为阴性对照,4℃孵育过夜。第二天复温PBS洗涤,滴加二抗工作液孵育30min。显微镜下DAB显色,双蒸水终止显色。苏木素染核,0.1%盐酸分化,双蒸水冲洗后返蓝。梯度酒精脱水,二甲苯透明,中性树脂封片。显微镜下观察并取不同视野拍照。
1.3.2 细胞培养和细胞转染 复苏HTR-8/SVneo细胞,用含10% FBS的RPMI 1640培养基,加1%青链霉素,置5%CO2、37℃恒温培养箱培养。每两天换液1次,待细胞生长至对数生长期时,将细胞按4×105/孔接种至六孔板。六孔板中细胞密度达50%~60%时,按Lipofectamine®3000转染试剂说明书进行转染。分为si-NC、si-SIRT3-1、si-SIRT3-2及si-SIRT3-3四个组,转染后48h,采用qRT-PCR和Western blot验证转染效率。
1.3.3 实时荧光定量PCR Trizol法提取各组细胞总RNA,测定RNA浓度。采用逆转录试剂盒将其逆转录为cDNA。扩增体系(10μL):cDNA 1.0μL,上、下游引物各0.5μL,三蒸水3.0μL,SYBR Green Real time PCR Mix 5.0μL。反应条件:预变性95℃ 10min,变性95℃ 2s,退火60℃ 20s,延伸70℃ 10s,40个循环。引物序列:SIRT3上游为5'-GCTCTACACGCAGAACATCG-3',下游为5'-CATCACGTCAGCCCGAAT-3'。β-actin上游为5'-TGACGTGGACATCCGCAAAG-3',下游为5'-CTGGAAGGTGGACAGCGAGG-3'。采用2-△△CT相对定量法进行分析。
1.3.4 Western blot法检测蛋白表达 RIPA裂解液(含1% PMSF)提取蛋白,BCA法测量蛋白浓度,加1/4体积Loading buffer煮沸。按30μg/孔上样,10%SDS-PAGE凝胶电泳,根据目的蛋白分子量切胶,冰浴下300mA恒流进行转膜1h将蛋白转移至PVDF膜。5% BSA封闭1h,4℃摇床孵育一抗过夜。次日复温TBST洗膜,室温摇床上孵育二抗1h。TBST洗膜3次后采用ECL法显影曝光。Image J软件对条带进行灰度数据分析。
1.3.5 Matrigel侵袭实验 将转染24h后的细胞消化后计数,用无血清RPMI 1640培养基重悬为2×105/mL的细胞悬液。Transwell小室下室加600μL含10% FBS的RPMI 1640培养基,向铺好基质胶(Matrigel基质胶:无血清培养基=1∶7)的小室上室均匀滴加100μL的混匀细胞悬液。37℃培养箱继续培养36h。取出小室,4%多聚甲醛固定,结晶紫染色,棉棒擦去上室面细胞。PBS洗涤晾干,显微镜下取6个视野拍照计数。Image J统计穿膜细胞数并取平均值。每次实验每组设3个复孔,且实验重复3次。
1.3.6 划痕实验 六孔板中的细胞转染24h,待细胞贴壁生长至80%时用200μL的枪头进行划痕,PBS轻柔清洗2遍后向六孔板中加2mL无血清RPMI 1640培养基,划痕后0h和24h在倒置荧光显微镜下观察细胞迁移状态,并取6个视野每次于相同位置拍照。使用Image J分析。每次实验每组设3个复孔,且实验重复3次。

2 结 果
2.1 SIRT3在早、中、晚孕期人胎盘组织中的定位 用细胞角蛋白7(CK7)来标记滋养细胞。免疫组化结果表明,妊娠期各阶段胎盘组织均有SIRT3蛋白的表达,且部位大体相同,主要分布于细胞滋养细胞(CTB)、合体滋养细胞(STB)和间质绒毛外滋养细胞(iEVT)的细胞浆,在一些基质细胞中也有表达但显色较弱,见图1。
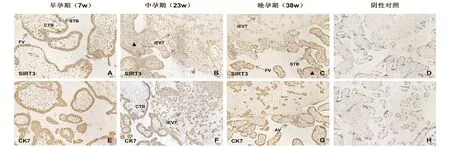
图1 SIRT3在人胎盘组织中的表达模式(40×)A~C:SIRT3阳性染色在CTB、STB和iEVT中较强,而在基质细胞中显色较弱;E~G:CK7染色,用于标记胎盘滋养细胞;D和H:阴性对照;▲:指向间质细胞;AV:锚定绒毛;FV:游离绒毛;STB:合体滋养细胞;CTB:细胞滋养细胞;iEVT:间质绒毛外滋养细胞
2.2 SIRT3在早、中、晚孕期人胎盘组织中的表达 Western blot结果表明,孕晚期胎盘组织中SIRT3蛋白的表达水平显著低于孕早、中期(P<0.05),而早孕期和中孕期胎盘组织SIRT3蛋白表达水平无明显差异(P>0.05),见图2。
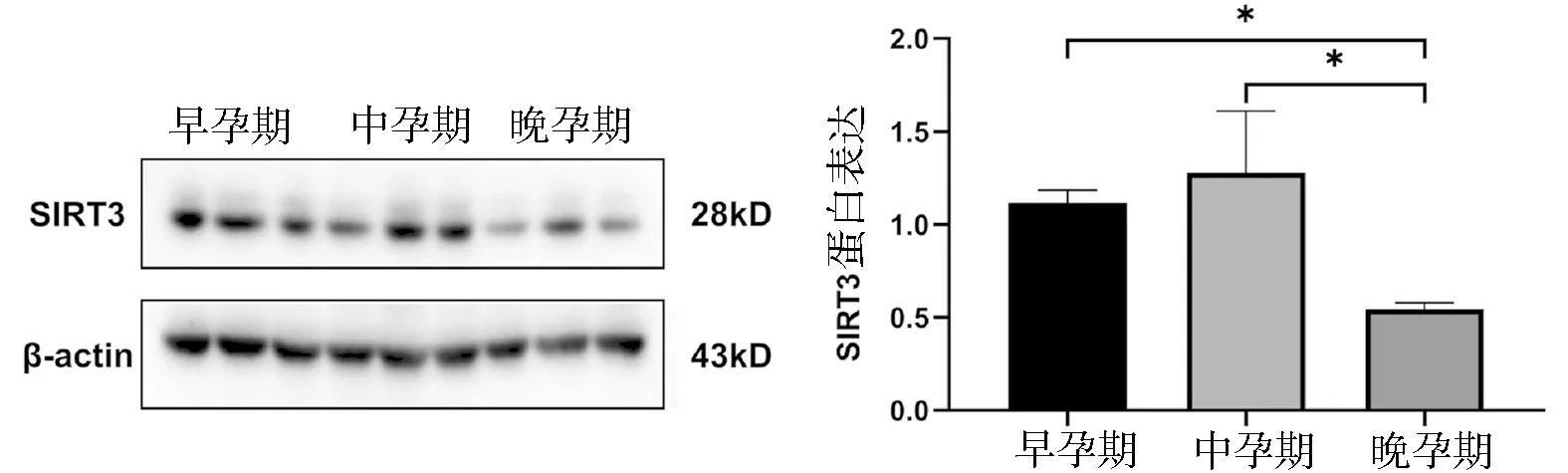
图2 Western blot法检测人胎盘组织SIRT3蛋白表达*P<0.05
2.3 si-SIRT3对细胞中SIRT3的干扰效率 设计并合成3种不同的siRNA(si-SIRT3-1、si-SIRT3-2和si-SIRT3-3),分别靶向SIRT3 mRNA的3个不同位点。通过Western blot和qRT-PCR对转染效率进行验证。结果显示,si-SIRT3-1可显著下调HTR-8/SVneo细胞中SIRT3蛋白表达水平(P<0.05),见图3。因此,后续实验选取si-SIRT3-1对HTR-8/SVneo细胞进行干预,并将其简写为si-SIRT3。

图3 Western blot法和qRT-PCR法检测各组细胞中SIRT3表达水平*P<0.05 vs si-NC
2.4 下调SIRT3表达抑制滋养细胞迁移 划痕实验结果显示,si-SIRT3组细胞迁移能力显著低于si-NC组(P<0.05),见图4。表明下调SIRT3表达后,显著抑制HTR-8/SVneo细胞迁移能力。
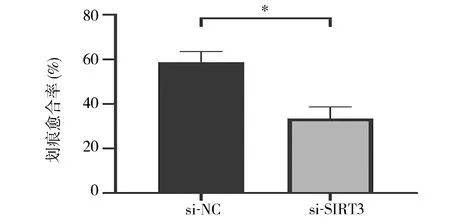
图4 敲低SIRT3基因后细胞迁移能力的变化*P<0.05
2.5 下调SIRT3表达抑制滋养细胞侵袭 Matrigel侵袭实验结果显示,si-SIRT3组细胞侵袭能力显著低于si-NC组(P<0.05),见图5。表明下调SIRT3表达后,显著抑制HTR-8/SVneo细胞侵袭能力。
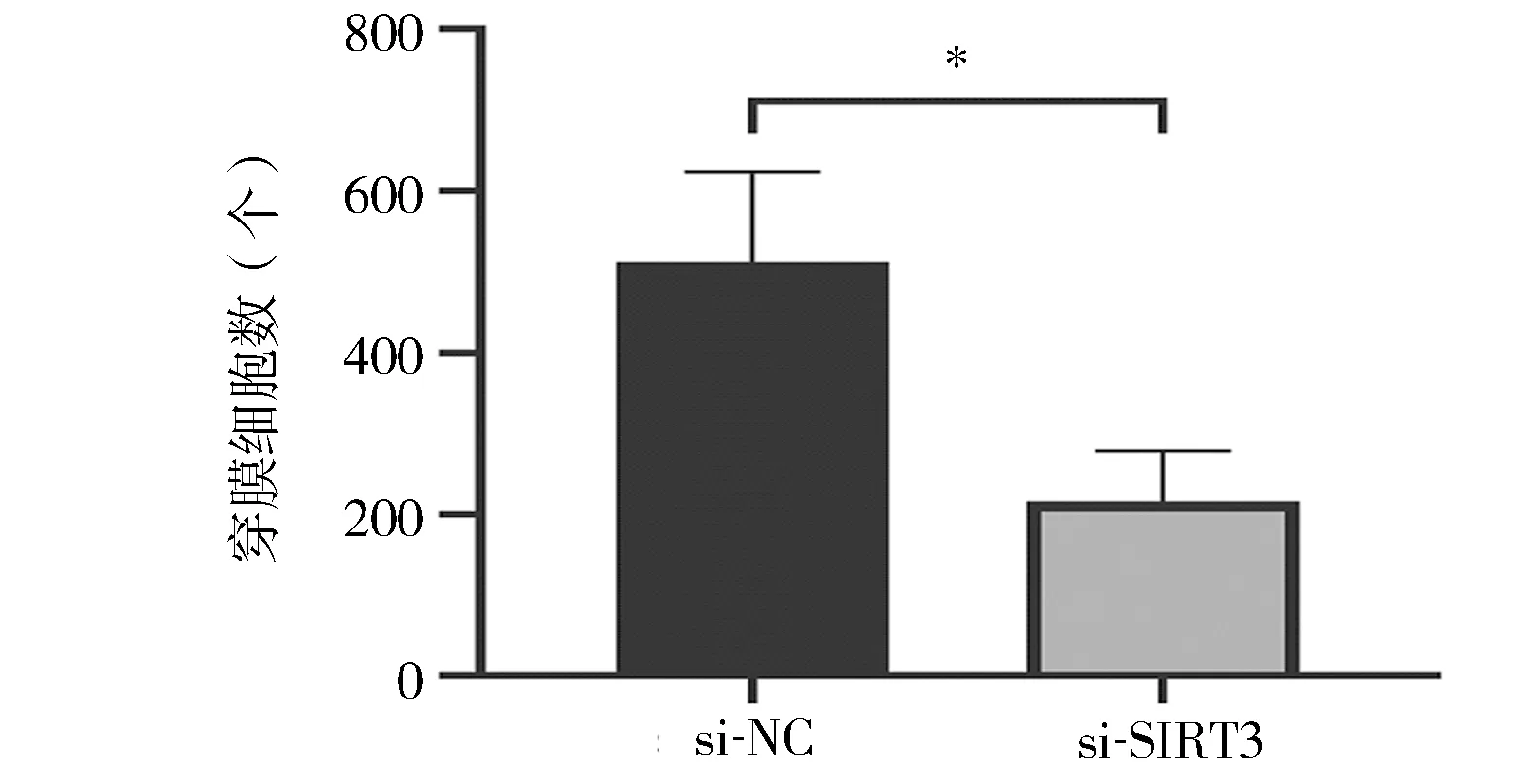
图5 敲低SIRT3基因后细胞侵袭能力的变化*P<0.05
3 讨 论
胎盘起源于滋养外胚层,在妊娠早期迅速发育,其结构和功能也发生动态改变[8]。在人胎盘发育过程中,滋养外胚层中原始的细胞滋养层细胞,以两条主要路径发生分化。一种分化路径为在漂浮绒毛(floating villi,FV)表面,单核的细胞滋养细胞(cytotrophoblast,CTB)融合为多核的合体滋养层细胞(syncytiotrophoblast,STB)。FV悬浮于充满母体血液的胎盘绒毛间隙,其表面的STB主要负责母胎界面间的物质交换、分泌妊娠相关活性物质以及抵御外来微生物等。另外一条路径中,原始细胞滋养层细胞发生增殖,形成锚定于母体子宫壁的锚定绒毛(anchoring villi,AV)。AV中的CTB可获得侵袭性表型,分化为侵入蜕膜或部分子宫肌层的间质绒毛外滋养细胞(interstitial extravillous trophoblast,iEVT),或者位于血管内能重塑母胎界面血管系统的绒毛外滋养细胞(endovascular extravillous trophoblast,enEVT)[9]。妊娠第6~20周,EVT的侵袭性及对子宫螺旋动脉的重塑活动最为活跃。这两条分化途径均受到母胎界面氧张力、激素、转录因子、生长因子及其他信号分子相互作用网络的严格控制[10]。
大量的研究证实,胎盘发育异常与流产、早产、胎儿生长受限和子痫前期等多种病理妊娠息息相关[11-13]。因此明确胎盘发育过程中的滋养细胞分化调控机制,对胎盘源性疾病的早期诊断、治疗乃至预防都极为重要。通常,研究人员收取早、中、晚孕期正常胎盘组织,采用免疫组化、免疫印迹或免疫荧光法等检测某种分子在人类胎盘组织的时空表达模式。有研究发现,ESRP1在早、中孕期表达水平的降低驱动CTB向EVT的分化,且ESRP1负性调控EVT迁移和侵袭能力[14];vWF裂解酶ADAMTS13在中、晚孕期表达显著下降,调控滋养细胞功能和胎盘血管的生成,参与PE的发病[15]。本研究发现,妊娠期各阶段胎盘组织SIRT3的时空表达模式。免疫组化结果表明,SIRT3在早、中、晚孕期胎盘组织中均有表达,主要存在于CTB、STB以及iEVT的细胞浆,而在基质细胞中染色较弱。Western blot结果显示,SIRT3在晚孕期胎盘组织中的表达水平低于早、中孕期。既往研究发现,妊娠第6~20周之间胎盘组织滋养细胞具有较强侵袭和迁移能力,当滋养细胞侵袭功能障碍时胎盘发育异常,诱发胎盘源性疾病的发生[16]。因此,本研究提示SIRT3妊娠期表达水平的动态改变可能是通过调控滋养细胞功能参与胎盘发育。
SIRT3在不同癌症发展中扮演抗癌或促癌基因双重角色[17]。如SIRT3介导的ROS控制可抑制Src/FAK信号转导,SIRT3的过表达抑制乳腺癌细胞的迁移和转移[18]。此外,SIRT3介导的SOD2激活可促进三阴性乳腺癌(triple-negative breast cancer,TNBC)细胞的上皮间质转化(epithelial-mesenchymal transition,EMT)[19]。在宫颈癌细胞中,SIRT3去乙酰化乙酰辅酶A羧化酶(ACC1)以促进脂质代谢。这种脂肪酸代谢的重新编程促进了癌症的迁移和侵袭[20]。以上研究表明,SIRT3可能通过影响肿瘤细胞的侵袭迁移,参与肿瘤的发生和发展。滋养细胞与肿瘤细胞具有类似的生物学功能,推测SIRT3可能同样影响滋养细胞的侵袭迁移。本研究使用siRNA干扰HTR-8/SVneo细胞中SIRT3蛋白的表达,检测其对滋养细胞功能的影响。结果表明,SIRT3表达下调后,显著抑制了HTR-8/SVneo细胞的迁移侵袭能力(P<0.05),这与SIRT3在孕晚期胎盘组织中的表达水平低于早、中孕期相一致。
综上所述,SIRT3在晚孕期胎盘组织中的表达水平低于早、中孕期胎盘组织,且SIRT3表达下调可抑制人绒毛外滋养层细胞系HTR-8/SVneo的迁移与侵袭能力,表明SIRT3可能是胎盘发育形成过程中不可缺少的调控因子。但SIRT3调控胎盘发育的具体机制尚需进一步实验研究,且SIRT3与病理妊娠,如胎儿生长受限和子痫前期的关系还需深入探讨。
