利奈唑胺致药品不良反应文献分析
2021-11-22常苗苗赵冠人解放军总医院医疗保障中心药剂科北京100853
常苗苗,赵冠人(解放军总医院医疗保障中心药剂科,北京 100853)
利奈唑胺于2000年经FDA批准上市,于2007年在我国上市,主要用于严重的革兰阳性球菌感染,同时具有良好的抗结核分枝杆菌的作用,与其他抗菌药物不易产生交叉耐药,在临床应用广泛,其所致药品不良反应(adverse drug reaction,ADR)也随之增加,为了更安全地使用该药,笔者对利奈唑胺上市以来所致ADR个案报道进行统计与回顾性分析,探讨ADR发生规律,为临床安全用药提供参考。
1 资料和方法
1.1 资料来源
检索CNKI、万方、维普、PubMed数据库,收集国内外医药期刊公开发表的关于利奈唑胺所致ADR的个案报道。检索时限为2000年1月 - 2020年6月,中文检索词为“利奈唑胺”、“不良反应”和“案例报道”,英文检索词为“linezolid”、“adverse reaction”和“case report”。逐篇查阅,剔除重复报道、剔除患者资料表述不清或临床资料不完整的文献,得到符合条件的文献共计52篇,其中国内报道39篇,国外报道13篇,共涉及69例患者。
1.2 方法
采用回顾性研究方法,对检索出的52篇文献进行信息提取,包括患者性别、年龄、用药剂量、合并基础疾病及联合用药情况、不良反应发生时间、临床表现、处理及转归等,并进行归纳总结。使用Excel软件、SPSS软件对数据进行分析。
2 结果
2.1 患者性别与年龄分布
发生ADR的69例病例中,男性48例(69.57%),女性21例(30.43%),男女比例为2.29∶1,发生不良反应的患者年龄为4 ~ 102岁,平均年龄为(65.28±24.35)岁,详见表1(根据2020年WHO新的年龄划分标准进行年龄段划分),经χ2检验,不同年龄段的性别构成无统计学差异(χ2= 2.198,P= 0.532)。
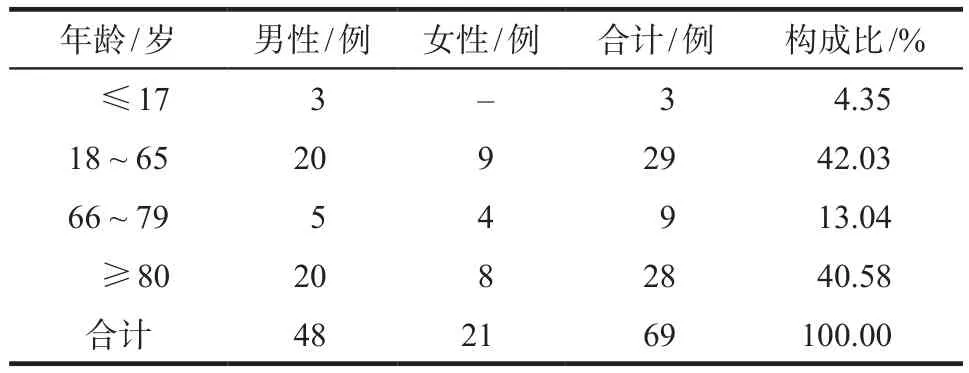
表1 患者性别及年龄分布Tab 1 Distribution of gender and age in patients
2.2 给药剂量和联合用药情况
发生ADR的69例病例中,给药剂量0.6 g·d-1共计62例,1.2 g·d-1共计7例。使用利奈唑胺单药抗感染治疗的占52.17%,联用1种及以上抗菌药物进行抗感染治疗的占47.83%。
2.3 ADR发生时间分布
69例利奈唑胺所致ADR中,有1例用药30 min后即发生,有5例为停药后迟发,ADR多发生在用药30 d内(76.81%),详见表2。根据所统计的患者年龄及用药时间用SPSS软件做如下箱型图,见图1。

表2 利奈唑胺所致ADR的时间分布Tab 2 Distribution of the occurrence time of ADR induced by linezolid

图1 患者发生ADR的年龄及用药时间Fig 1 Age and medication time in patients with ADR
2.4 ADR累及系统/器官和临床表现
利奈唑胺所致ADR主要累及血液系统、神经系统、内分泌系统等,以血液系统ADR发生率最高,详见表3。
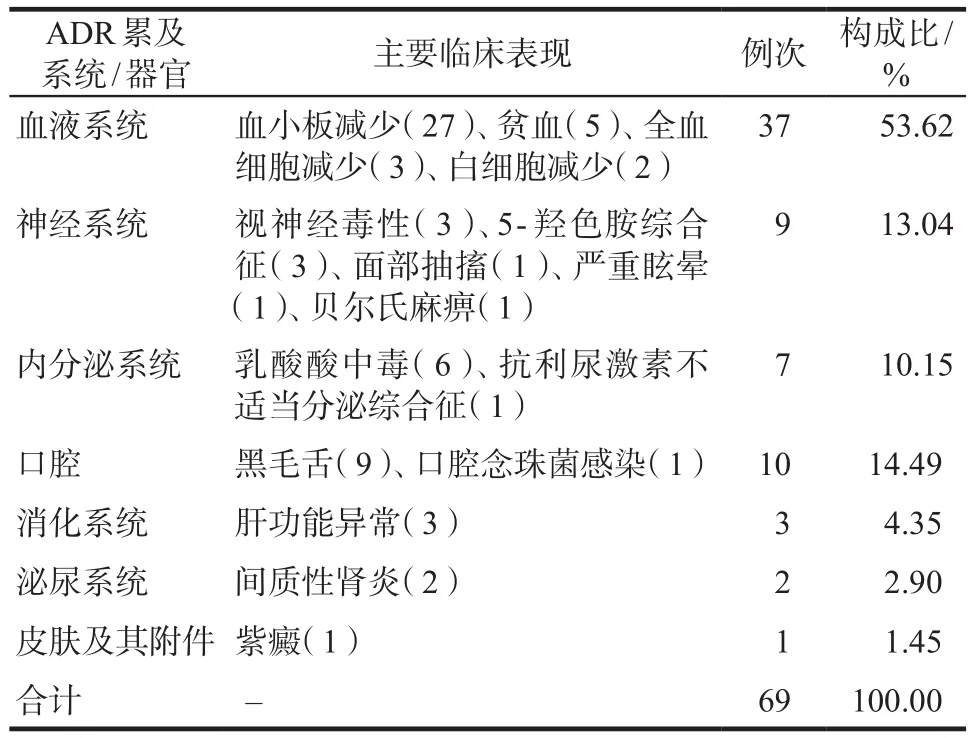
表3 ADR累及系统/器官及临床表现Tab 3 Systems/organs and clinical manifestations involved in ADR
2.5 转归
69例患者中有63例通过减量或停药后症状好转或消失,3例不详,3例死亡。死亡病例中,1例为乳酸酸中毒伴严重的胃肠道不良反应致肝衰竭死亡,1例为尿毒症患者由于药物蓄积引起脑部症状治疗无效死亡,1例为利奈唑胺治疗腹膜后脓肿引起多发性紫癜治疗无效死亡。
3 讨论
3.1 利奈唑胺致ADR与患者年龄和性别的关系
本文收集的69例利奈唑胺致ADR病例中,男女比例为2.29∶1,70岁以上患者男性例数是女性的3倍,可以看出男性患者较多,ADR在各个年龄段均有分布,但不同年龄段中男女发生ADR无统计学差异(χ2= 2.198,P= 0.532)。80岁以上的老年患者占40.58%,可能与老年患者基础疾病多,多脏器功能减退等有关,而且老年患者药物代谢缓慢,可能造成药物在体内蓄积产生毒性。
3.2 利奈唑胺致ADR与患者年龄和用药时间的关系
由图1可以看出,停药后迟发ADR的患者平均年龄最大,用药> 30 d发生ADR的患者平均年龄最小,提示老年或高龄患者应用利奈唑胺时应关注停药后迟发的ADR。76.81%的ADR发生在使用利奈唑胺30 d内,于4 ~ 7 d发生ADR的比例为26.08%,提示在使用利奈唑胺初期应注意监测其可能发生ADR,临床药师除在患者住院用药期间关注利奈唑胺ADR,出院停药后仍应对其进行随访,提示患者监测相关指标。
3.3 利奈唑胺致ADR的临床表现
3.3.1 血液系统不良反应 本研究中利奈唑胺致ADR累及血液系统比例最高(53.62%),表现为血小板减少、贫血、全血细胞减少以及白细胞减少。利奈唑胺引起血液系统不良反应的机制目前尚不完全清楚,有研究[1]报道了1例12岁儿童使用利奈唑胺后发生严重的贫血、轻度血小板减低和白细胞减少,患者血液涂片显示造血功能障碍,作者认为其潜在机制为骨髓抑制。Tajima等[2]研究了利奈唑胺对血小板破坏和生成的影响,认为经利奈唑胺作用后的巨核细胞中肌球蛋白轻链2磷酸化水平升高,从而抑制成熟巨核细胞的血小板释放而导致血小板减少。Wang等[3]研究了使用利奈唑胺后发生血小板减低的患者,发现利奈唑胺诱导血小板减低患者的氧化应激标志物升高,作者认为氧化损伤可能是其潜在机制之一。
有研究[4]探讨了利奈唑胺引起血小板减少的危险因素,最后得出结论是血小板基线值较低(低于200×109·L-1)、低eGFR、与碳青霉烯类抗生素联合治疗的患者会增加发生血小板减少的风险。另一项单中心回顾性研究[5],分析利奈唑胺治疗危重症患者发生血小板减少的危险因素,认为基线血小板计数低于108×109·L-1和药物谷浓度大于4 mg·L-1是危重症患者发生血小板减少的危险因素。巴西的一项回顾性队列研究结果表明肾功能正常患者利奈唑胺所致血小板减少的发生率较低,而在开始治疗前血小板计数≤200×109·L-1或血肌酐> 1.5 mg·dL-1的患者血小板减低发生率较高[6]。本研究收录的27例血小板减低的ADR,70.37%患者治疗前血小板基数值低于200×109·L-1,18.52%患者联用美罗培南,7例患者记录了肌酐值,其中71.42%患者治疗前血肌酐值> 1.5 mg·dL-1,和以上文献报道情况基本一致。综上所述,临床应用利奈唑胺之前应检查血小板计数以及肾功能状态,对于血小板基数较低、血肌酐偏高的患者在使用利奈唑胺3 d后再次检查血小板水平,尽早识别血液系统不良反应。
3.3.2 神经系统不良反应 说明书中利奈唑胺引起的神经系统不良反应有头痛头晕、口腔金属味、惊厥、5-羟色胺综合征和周围神经病变。本文收录的神经系统不良反应主要为5-羟色胺综合征、视神经受损、眩晕等。其中5-羟色胺综合征(serotonin syndrome,SS)是由5-羟色胺受体过度刺激引起的药物性综合征[7]。早在2011年美国FDA指出利奈唑胺与5-羟色胺类精神药物联合使用时,患者可出现严重中枢神经系统毒性。本文报道的3例SS为利奈唑胺和奥氮平、舍曲林、左旋多巴联合使用引起,这三种药物通过不同机制增加体内5-羟色胺的水平,脑内高浓度的5-羟色胺堆积,导致药物毒性。目前还没有SS的治疗指南,一般主张立即停药并对症支持,5-羟色胺综合征往往由于非特异性症状而被忽视,医师对药物-药物相互作用、症状和体征以及鉴别诊断缺乏认识,可能导致漏诊或误诊[8],临床药师应密切关注患者状况,仔细询问患者是否有5-羟色胺能药物使用史,协助医师及时发现SS相关症状。
本文的3例视神经病变患者,1例用药22 d后主诉视物模糊,停药一周后视力模糊症状消失。2例联用乙胺丁醇数月后发生了视神经毒性病变,表现为视力严重下降。目前认为利奈唑胺引起视神经病变的机制是药物相关的线粒体毒性,其通过干扰线粒体氧化磷酸化而损伤视神经,大部分报道认为利奈唑胺引起的视神经病变需要数月甚至一年或更久[9-12],Jaspard等[13]研究结果显示接受利奈唑胺治疗的患者,中位使用时间为13个月,24.6%的患者出现了不同程度的视神经病变。另一篇研究[14]回顾性分析结果示33例利奈唑胺致视神经病变的病例在停用利奈唑胺之后,93.9%症状改善,1例患者症状恶化,1例表现为完全且不可逆的视力丧失。故对于需长期使用利奈唑胺的耐药结核病患者应密切关注和随访,提示患者定期进行眼科检查。
3.3.3 内分泌系统不良反应 本文收录的利奈唑胺致内分泌系统不良反应主要是乳酸酸中毒和抗利尿激素不适当分泌综合征。引起乳酸酸中毒的机制可能是利奈唑胺干扰线粒体三磷酸腺苷的合成。通过结合肽基转移酶中心的A位点,阻止线粒体来源的呼吸复合物的合成。本研究中3例死亡患者有1例为乳酸酸中毒,其应用利奈唑胺5 d后发生乳酸酸中毒伴随严重的胃肠道反应,而且该患者有慢性肝病病史,这也影响利奈唑胺在体内的清除。Mao等[15]研究认为利奈唑胺引起的乳酸酸中毒的死亡率为25.5%,死亡率较高可能是因为乳酸性酸中毒发病突然,多数患者会发展为严重呼吸衰竭。一项回顾性研究[16]认为利奈唑胺引起的乳酸酸中毒病例都发生在接受至少四周治疗的患者中,本研究6例患者中,2例患者乳酸水平升高发生在用药5 d后,4例患者在用药27 d以上发生乳酸酸中毒。
利奈唑胺说明书提示该药会引起低钠血症,本研究中1例患者可能由利奈唑胺引起抗利尿激素不适当分泌综合征,这是低钠血症的常见病因,该患者为老年女性,使用利奈唑胺第22天出现了严重低钠血症(Na+118 mmol·L-1),停药后血清钠浓度上升至135 mmol·L-1。有研究表明,如果血清钠浓度为127 mmol·L-1或更低,不论低钠血症的病因或患者特定的医疗条件,死亡的风险增加15倍。故临床药师应密切关注使用利奈唑胺患者的血钠水平,协助临床医师判断是否存在药物导致的低钠血症并及时纠正。
3.3.4 口腔相关不良反应 本研究共检索出10篇由利奈唑胺引起的与口腔相关的不良反应,其中黑毛舌(black hairy tongue,BHT)的案例报道为9例,说明书将其归为罕见的不良反应,但其在临床中并不罕见。BHT是一种良性疾病,其特征是舌头表面丝状乳头异常肥大和伸长,大多数呈棕色或黑色。已知的诱发因素包括吸烟、过量饮用咖啡/红茶、口腔卫生差、三叉神经痛、全身虚弱、口干症和药物的使用[17]。目前利奈唑胺诱导的药物性黑毛舌机制尚不清楚。Hau[18]研究指出接受利奈唑胺治疗的患者出现黑毛舌的概率为0.2%。Petropoulou等[19]报道了3例患者静脉使用利奈唑胺后发生了BHT,其中有2例发生在用药21 d后,其通过对已有文献的分析认为静脉使用利奈唑胺发生BHT的时间要比口服更长。Luo等[20]报道的患者在静脉使用第11天和口服用药第2天发生了BHT。本文9例患者,5例为口服用药,发生ADR最短时间为用药后3 d。对于发生BHT的患者,如果不能耐受建议停药,用生理盐水或双氧水漱口,用软牙刷清洁舌头,出现严重症状建议进行病原学检查,以确定是否有细菌或真菌感染,根据阳性结果考虑使用抗生素。另外本文检索到1例使用利奈唑胺第5天出现了口腔念珠菌感染的肾移植术后患者,停药后逐渐好转,利奈唑胺说明书提到在临床试验期间,约3%的患者出现了药物相关念珠菌病,虽然临床上较罕见但仍需引起重视。
3.3.5 其他不良反应 利奈唑胺在使用中还可引起肝功能异常、周围神经病变、间质性肾炎、紫癜等药品不良反应,虽然发生率较低,但仍需密切关注。
综上所述,利奈唑胺作为一种应用越来越广泛的抗菌药物,为临床提供新选择的同时其ADR也不容忽视,本文收录的ADR累及多个系统,还有个别案例同时发生多个ADR,临床药师应在用药过程中加强用药监护,特别关注血小板基数值较低、肾功能不全、老年患者以及药物-药物相互作用,及时发现并进行干预,避免严重ADR的发生。
