原发性乳腺弥漫大B细胞淋巴瘤的MRI表现并文献复习
2021-11-22柴维敏严福华
李 雪,孙 琨,柴维敏,严福华
上海交通大学医学院附属瑞金医院放射科,上海 200025
原发性乳腺淋巴瘤(primary breast lymphoma,PBL)仅原发于乳腺,在临床上少见,属于结外淋巴瘤,其在乳腺恶性肿瘤中占比仅有0.04%~0.50%[1-2],在组织学上最常见的类型是弥漫大B细胞淋巴瘤(diffuse large B cell lymphoma,DLBCL),DLBCL占PBL所有组织学亚型的56.0%~84.0%[3]。由于PBL发病率较低,目前PBL影像学方面尤其是在磁共振成像(magnetic resonance imaging,MRI)方面的报道仍显不足。
过去,由于影像学技术的限制及PBL的低发病率,关于PBL临床特征及影像学特点的文献较少。由于认识不足,极易在术前将PBL误诊为乳腺癌或良性肿瘤(如纤维腺瘤等)。因而,临床上相当一部分PBL患者是通过切除肿块后行组织病理学检查和免疫组织化学染色才确诊的。然而,有研究[4-6]提示,患有PBL的患者行乳房切除术既不能改善生存率也不能降低复发风险,因此,一旦误诊极易延误PBL患者的有效治疗。随着影像学技术的发展,MRI越来越多地应用于高危女性人群的乳腺癌筛查及乳腺病变的术前检查,本文回顾并分析了3例原发性乳腺弥漫大B细胞淋巴瘤(primary breast diffuse large B cell lymphoma,PB-DLBCL)患者的MRI图像并对相关的既往文献进行总结,以期提高对其影像学特征的认识,更好地为临床医师制订正确的诊疗方案提供指导。
1 资料和方法
1.1 研究对象
本研究为回顾性研究。参照Wiseman等[7]的诊断标准,纳入标准:① 肿块经病理学检查证实为恶性淋巴瘤浸润;② 乳腺组织与淋巴瘤组织在解剖位置上密切相连;③ 无全身淋巴瘤或既往无乳外淋巴瘤的证据;④ 局限于乳腺和/或同侧腋窝淋巴结。基于以上标准共收集2014年12月—2020年12月于上海交通大学医学院附属瑞金医院就诊并经病理学检查证实为PBL的患者20例。
排除标准:入院前穿刺活检提示为PBL但入院后未行MRI检查(N=5);MRI检查前已于外院行肿块切除术或全乳切除术(N=8);MRI扫描序列不标准或图像质量差者(N=4)。最终本研究纳入3例PBL女性患者。随后,收集上述患者完整的MRI图像、临床病史及病理学诊断资料。
上述资料均由同一名放射科医师进行分析并校对。
1.2 仪器与方法
采用德国Siemens公司MAGNETOM Aera 1.5 T MRI扫描仪及乳腺专用相控线圈18通道采集患者图像。常规序列包括横断位T2快速反转恢复压脂(turbo inversion recovery magnitude,TIRM)序列、平面回波成像(echo planar imaging,EPI)-弥散加权成像(diffusionweighted imaging,DWI)序列(b值为800 s/mm2)及T1加权动态增强扫描(共5期)。扫描时,患者取俯卧位,头向前先进,双乳自然悬垂在专用线圈内。首先扫描TIRM序列,再行EPI-DWI序列扫描。最后采集T1加权动态增强扫描图像,每一动态增强时期扫描时间大约为90 s。
1.3 观察指标
扫描后,表观弥散系数(apparent diffusion coefficient,ADC)图可自动重建,1名放射科医师在ADC图上勾画感兴趣区(region of interest,ROI),重复勾画3次并计算出平均ADC数值。时间-信号强度曲线(time-signal intensity curve,TIC)则由该名放射科医师在图像上病灶强化最明显的区域勾画ROI得到。
同时,以上所得的MRI影像学资料由2名放射科医师(乳腺病变影像诊断经验分别为3、10年)共同阅片,出现不同意见时,由第3名高年资放射科医师(乳腺病变影像诊断经验为13年)共同会诊,达成一致。另外,病灶的影像学特征参照2013版的MRI乳腺影像报告和数据系统(Breast Imaging Reporting and Data System,BI-RADS)来进行标准化的描述和分析。
2 结 果
2.1 基本情况
最终有3例患者纳入研究,3例患者均为女性,年龄范围为47~66岁,平均年龄(55.67±9.61)岁。这3例患者共有6个病灶,病灶大小范围为1.5~3.6 cm,平均大小为(2.69±0.95)cm。
3例患者的病灶均分布于单侧,其中1例为单发病灶,位于右乳;另外2例为单侧多发病灶,1例位于左乳(2个病灶),1例位于右乳(3个病灶)。
病灶位于右乳的2例患者首诊原因分别为“2个月余前偶然扪及右乳肿块”“1d前自觉发现右乳一肿物”,病灶位于左乳的1例患者因“体检发现左乳肿块”就诊。
2.2 MRI影像学表现
3例患者中的6个病灶在乳腺MRI上均表现为肿块型,典型图例见图1~3,具体的影像学特征见表1。

表1 3例肿块型PBL的MRI特征

图1 典型病例1(患者,女性,66岁,PB-DLBCL)MRI表现
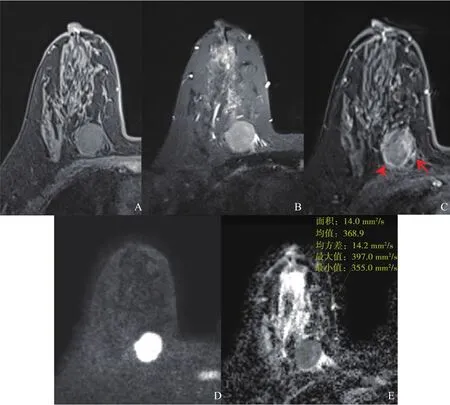
图2 典型病例2(患者,女性,47岁,PB-DLBCL)MRI表现
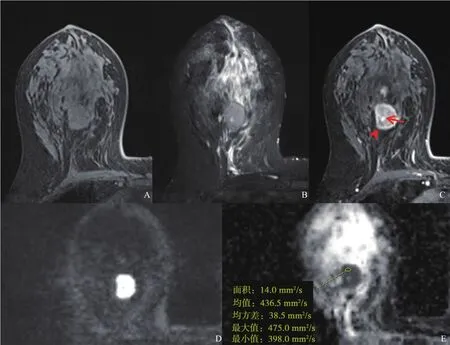
图3 典型病例3(患者,女性,50岁,PB-DLBCL)MRI表现
T1WI图像上,6个病灶信号均匀,T1WI呈低(3/6)或等(3/6)信号。在T2WI图像上,6个病灶均呈稍高信号。在DWI图像中,所有病灶信号均明显增高,ADC图信号明显减低,ADC值的范围为(0.37~0.79)×10-3mm2/s。在动态增强图像中,6个病灶内部强化均匀,病灶边缘清晰(4/6)或不清(2/6),无毛刺(6/6),可见贴边血管(3/6)或血管穿行(3/6)。对延迟期图片进行观察,发现病灶边缘均呈“勾边强化”。TIC呈平台型(2/6)或流出型(4/6)。
2.3 病理学检查结果
左乳1例的2个病灶穿刺结果均显示PBDLBCL,生发中心性。右乳单发病灶术后病理学检查结果显示PB-DLBCL,非生发中心性。右乳多发病灶(3个)穿刺活检结果均为PBDLBCL,非生发中心性。
3 讨 论
PBL的初步诊断标准由Wiseman和Liao[7]于1972年首先提出,此标准在当前研究中应用较多,纳入本文的3例患者均符合此标准。
有研究[8]对比了PBL和乳腺癌在乳腺X线摄影上的表现,发现PBL病灶(4~5 cm)比乳腺癌(2~3 cm)大,并且没有毛刺、钙化等特征。实际上,影像学特征并不能真正确诊PBL,活检或术后病理学检查仍然是确诊PBL的有效手段。此外,充分的病理学取材也是确诊PBL的保障。细胞学检查可以用于鉴别乳腺癌和淋巴瘤,当结合临床及影像学资料解释细胞学结果时,诊断准确度将近100%,但细胞学检查不能对NHL进行准确的分型和分级,因此在诊断程序中的作用是不够的[8]。
乳腺淋巴瘤是一种血液系统肿瘤,主要分为原发性与继发性两种。关于PBL的病理机制尚不清楚,目前主要有两种假说,一种认为淋巴瘤起源于乳腺内的淋巴结;另有观点认为PBL起源于腺泡周围区域的结缔组织,其内含有淋巴细胞、浆细胞和其他未分化间充质细胞[1]。由于乳腺仅有少量的淋巴组织,所以原发于乳腺的淋巴瘤罕见。其中,PBL在所有乳腺恶性肿瘤中占比不足1%,在结外非霍奇金淋巴瘤(non-Hodgkin’s lymphoma,NHL)中占比不足2%[1,3]。PBL病理学类型几乎都为NHL,其中DLBCL最常见。
PBL常见于女性,发生于男性的PBL罕见,其发病的中位年龄介于50~70岁之间,分布以单侧乳腺为主,好发于右乳,多见于外上象限[1,9]。PBL平均直径为2.3~4.6 cm,多数文献[1]报道其体积稍大于继发性乳腺淋巴瘤。因此,在临床上PBL患者多以增大、无痛且可触及的肿块为首发表现,少见弥漫性乳房肿胀、乳头溢液和橘皮样改变。本文的3例PBL患者均因体检发现或触及肿块就诊,3例患者均为单侧病灶,其中2例患者病灶分布于右侧,与既往文献[1,9]一致。6个病灶直径为1.5~3.6 cm,部分病灶直径小于既往研究所报道的范围可能与本文样本量少及患者因体检较早发现肿块有关。
PBL和继发性乳腺淋巴瘤在影像学上较难分辨[10],继发性乳腺淋巴瘤较常累及腋下(包括双侧)淋巴结。同时,由于PBL在影像学上缺乏特征性,也容易高度误诊为乳腺癌或其他良性肿瘤。因此,除了提高对乳腺良恶性病变鉴别诊断的准确度外,对于有恶性征象的病变应注意与淋巴瘤进行鉴别,以免延误患者治疗。
关于PBL的MRI特征目前发表的文献尚且不多并且现有研究结果不同(表2),可能与其发病率低、样本量有限有关。既往诊断PBL主要通过患者自觉肿块或体检时发现肿块,再经穿刺活检或手术后病理学检查确诊,因而行MRI检查者相对较少。随着乳腺MRI技术的飞速发展,临床对其需求(特别是术前检查)日益增多,加强对PBL的MRI影像学特征的认识对临床有一定的指导价值[11]。范林音等[12]在对35例PB-DLBCL患者进行分析时发现此类病灶的ADC值明显降低[(0.43~0.80)×10-3mm2/s]。这与本研究中的ADC值范围基本相符。较低的ADC值可能与淋巴瘤内细胞排列致密有关,淋巴细胞外间隙小使得水分子弥散明显受限。因此,较低的ADC值是诊断乳腺淋巴瘤的重要特征[13]。贴边血管征多见于恶性肿瘤,在良性肿瘤中罕见[14-15]。周长玉等[16]通过与继发性乳腺淋巴瘤对比总结了12例PBL的MRI影像学表现,发现PBL在MRI增强图像上可伴不强化分隔及穿行血管。我们的研究也观察到几乎所有病灶都有贴边血管或血管穿行征象。这与Matsubayashi等[17]学者的观点一致,他们认为血管穿行征是诊断乳腺淋巴瘤的有效征象。另外,Surov等[18]学者发现PBL在MRI增强图像上强化均匀。本文研究亦发现PB-DLBCL病灶在MRI动态增强图像上早期强化均匀。
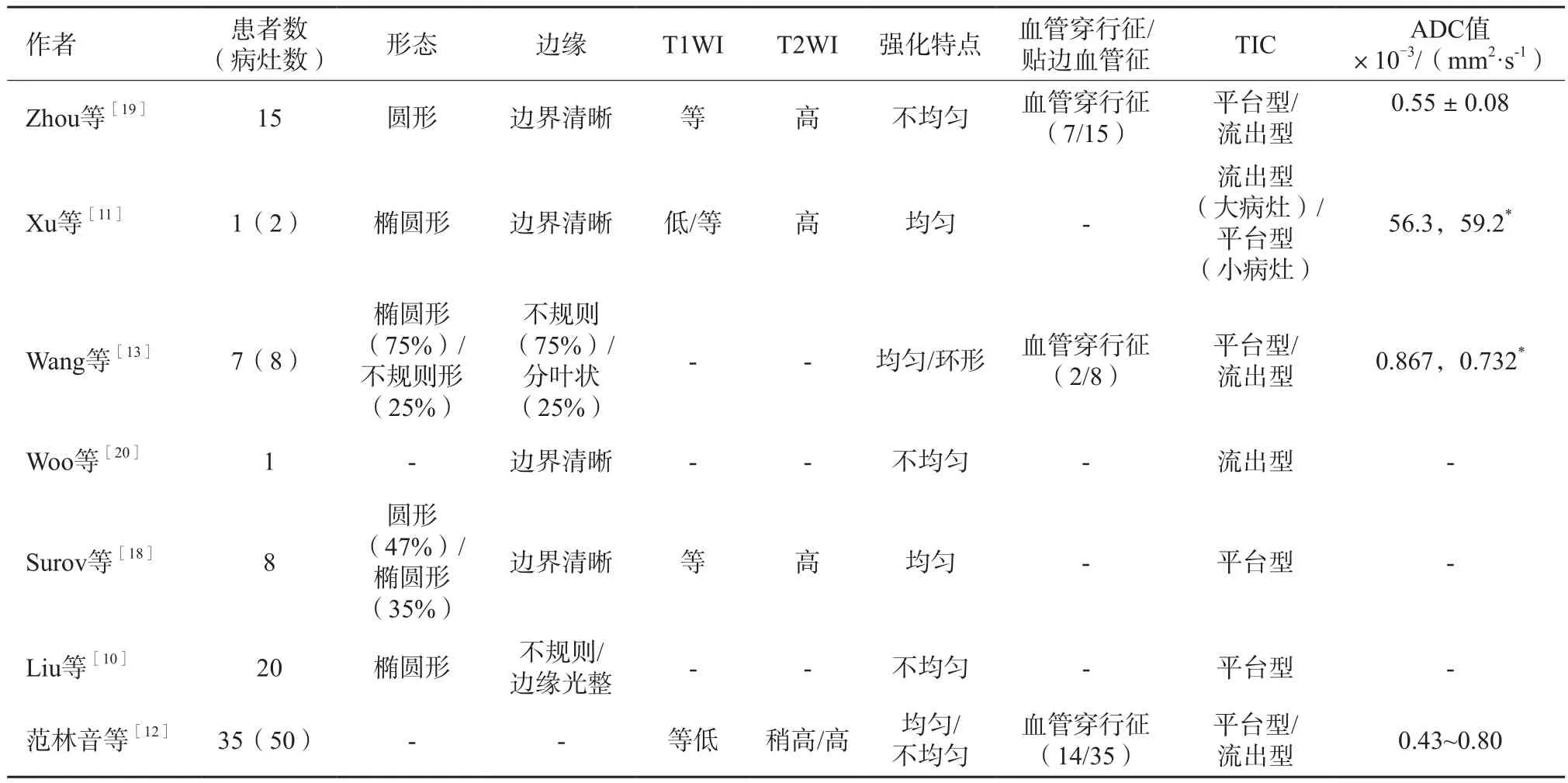
表2 关于PBL MRI特征的部分文献总结
综合我们的研究结果及既往的文献报道[12,14-17],PBL的MRI表现仍可以总结出一些有意义的诊断征象,主要归纳如下:① 病灶边缘境界清晰,毛刺征象少见;② T1WI呈等或稍低信号,T2WI呈稍高信号;③ 早期强化均匀,内部常伴血管穿行,边缘常见贴边血管,TIC以平台型或流出型为主;④ DWI信号明显增高,ADC值显著降低,一般低于乳腺癌。
PBL的治疗方案目前尚无统一标准,多采用手术、含蒽环类药物的化疗及放疗联合治疗。其中,化疗是治疗的关键组成部分。在Ryan等[21]的研究中,含蒽环类药物的化疗与放疗联合使用可以有效地提高患者的总生存率。一项关于PBL患者的随机临床试验[22]也证实,放化疗联合使用比单纯化疗或放疗更能提高总生存率和延长无事件生存期。有文献[1,23]报道,根治性手术并不能给患者带来生存获益,反而与较高的全因死亡率和疾病特异性死亡率相关。因此,除了切除活检以外的手术干预都应该尽量避免。将PB-DLBCL误诊为乳腺癌而行手术切除的患者,应在伤口愈合后尽快接受化疗免疫治疗及放疗[24]。
本文最初收集的20例患者中,有8例患者已于外院行肿块切除术或全乳切除术,这说明术前明确PBL的诊断或在阅片时能将PBL纳入鉴别诊断有助于制订正确的诊疗方案,这也将有利于患者的治疗及预后。
临床上多通过穿刺活检或术后病理学检查确诊PBL。当MRI表现为肿块边界清晰、强化均匀,但ADC值极低,并伴有贴边血管征或血管穿行征时,鉴别诊断应考虑PBL。以下为在MRI表现上需与PBL进行鉴别的几类病灶的诊断要点:① 三阴性乳腺癌,病变生长快速,主要呈环形或不均匀强化,TIC一般呈平台型或流出型,弥散受限,但ADC值一般高于PBL;② 纤维腺瘤,肿块内部可见低信号分隔,一般无弥散受限(ADC值较高),延迟强化可见内部强化趋于均匀,TIC呈上升型;③ 黏液癌,好发于老年女性,乳腺X线摄影可见病灶密度较高,T2WI呈明显高信号,伴或不伴内部低信号分隔,增强扫描呈环形及不均匀强化,延迟期强化仍不均匀,TIC呈上升型,无明显弥散受限。
综上所述,我们认为PB-DLBCL在MRI图像上具有一定的特征。病灶部位及分布、显著降低的ADC值、贴边血管征及血管穿行征,以及延迟强化后的勾边强化等都有助于诊断。由于PBL仅原发于乳腺且不常见,此类病变极易误诊,相关医师在判断乳腺肿块的性质时应提高对其认识,避免不必要的手术治疗。
