胰腺导管内乳头状黏液性肿瘤伴恶变超声造影表现1例
2021-11-22于凌云杨道辉邱艺杰田晓梵王文平
于凌云 ,杨道辉 ,张 琪,邱艺杰,左 丹,田晓梵,董 怡,王文平
1.复旦大学附属中山医院超声科,上海 200032;
2.复旦大学附属中山医院厦门医院超声科,福建 厦门 361015
1 资 料
患者,女性,66岁,中上腹闷胀不适反复3个月,进食后恶心呕吐,无发热、寒战、腹泻等不适。于外院行腹部计算机体层成像(computed tomography,CT)提示胰头囊实性占位性病变,偏恶性,伴胰管扩张。于外院行腹部磁共振成像(magnetic resonance imaging,MRI)提示胰头部囊实性占位性病变伴胆总管下段显示不清。自发病以来,患者体重减轻约5 kg。既往有高血压及糖尿病史。查体无明显阳性体征。实验室检查血常规及肝肾功能无明显异常,肿瘤指标均阴性。
超声检查:① 常规二维彩色多普勒超声,胰头部见73 mm×56 mm×83 mm囊实性占位性病变,边界清,形态不规则,其中央见52 mm×33 mm稍高实质回声,形态不规则,内部回声分布不均匀。病灶内可测及短线状彩色血流,彩色多普勒超声可测及动脉频谱,阻力指数(resistance index,RI)为0.74~0.79。主胰管全程不均匀扩张,内径约5 mm,与病灶内囊性结构相通(图1)。诊断结果为胰腺导管内乳头状黏液性肿瘤(intraductal papillary mucinous neoplasm of the pancreas,IPMN)伴恶变可能,建议行超声造影(contrast-enhanced ultrasound,CEUS)检查。② CEUS检查,经左侧肘浅静脉团注造影剂SonoVue(声诺维)1.5 mL后,CEUS显示胰头部病灶内实质部分17 s开始增强,呈整体不均匀高增强,25 s达峰值,60 s开始减退,静脉期及延迟期均呈低回声改变。CEUS考虑胰头部囊实性占位性病变,IPMN伴局部恶变可能,主胰管迂曲扩张(图2)。
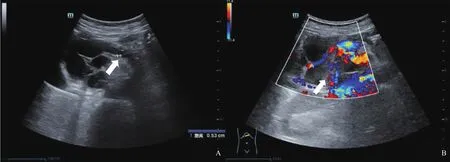
图1 IPMN二维超声图像表现
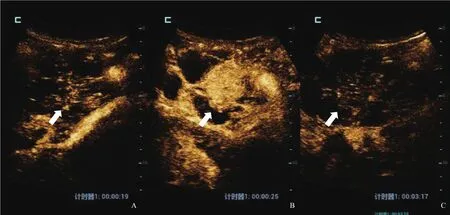
图2 IPMN CEUS表现
CT检查:胰头部见一囊实性团块,大小约7.0 cm×6.4 cm,囊内见多发分隔及结节灶,增强扫描囊壁及结节可见强化,病灶与主胰管相通,其远端主胰管扩张,胰体尾部萎缩。诊断结果为胰头囊实性占位性病变,IPMN伴恶变机会大,病灶由胰十二指肠分支动脉供血,胰体尾萎缩伴胰管轻度扩张(图3)。
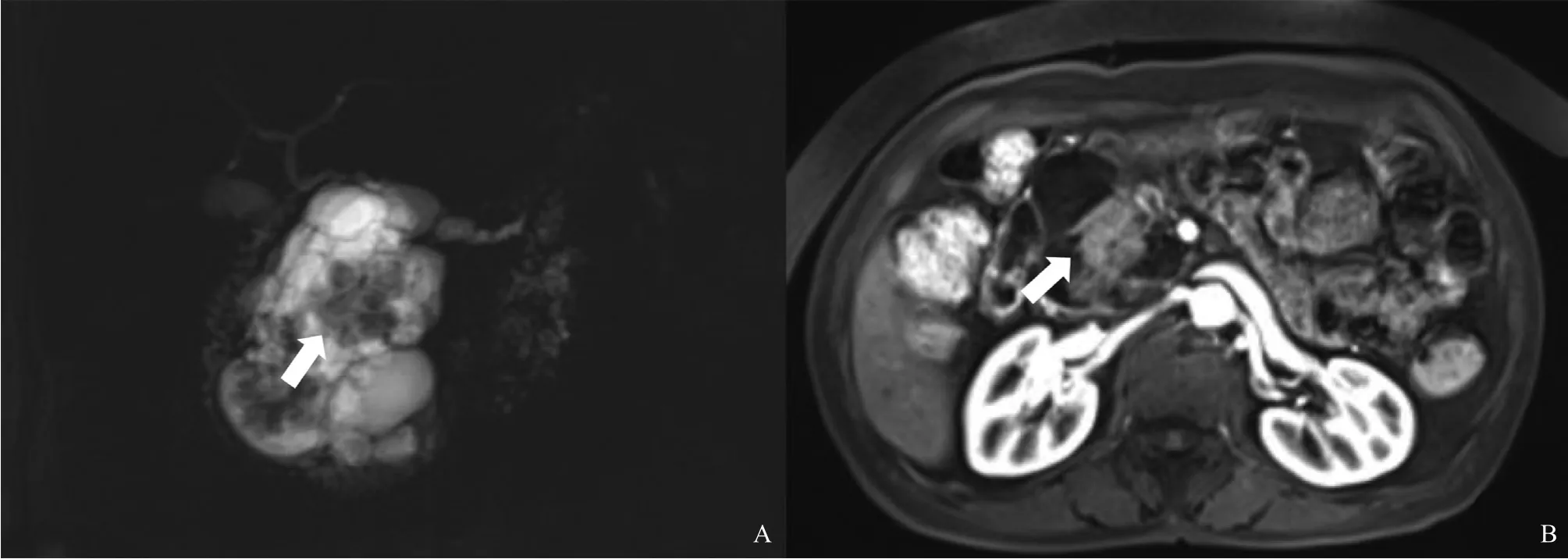
图3 IPMN增强MRI表现
MRI检查:胰头部见一囊性异常信号灶,大小约7.0 cm×6.1 cm,以囊性成分为主,T1加权成像(T1-weighted imaging,T1WI)呈低信号,T2加权成像(T2-weighted imaging,T2WI)呈高信号,增强后无强化,内见实性成分,T1WI呈等信号,T2WI呈稍高信号。增强后中度强化,病灶与主胰管可见相通,胰体尾缩小,其内胰管稍扩张,胆总管未见扩张。诊断结果为胰头部占位性病变,IPMN机会大,内见强化结节,恶变可能,胰体尾萎缩伴胰管轻度扩张(图4)。
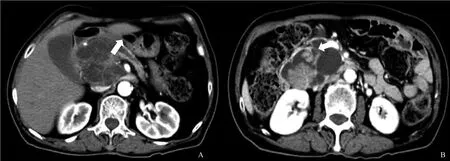
图4 IPMN增强CT表现
患者入院后,行“胰十二指肠切除术(Whipple手术)”,术中胰头颈部见多房囊性肿瘤,大小70 mm×61 mm,质硬,活动固定。术后病理学检查结果:(胰十二指肠)IPMN,伴腺上皮重度异型增生,癌变(腺癌,Ⅱ级),癌组织累及胰腺周围纤维脂肪组织,并由外向内侵至十二指肠壁浆膜下层。免疫组织化学染色:CK(+),Muc-2(-),CDX2(-),Muc-4(-),Muc-6(+),SMAD4(-),CD10(-),ER(-),PR(-),CK7(+),Ki-67(15%阳性)。
2 讨 论
近年来,胰腺囊性肿瘤的诊断率明显增加。在17项研究的48 860例患者的系统回顾中,胰腺囊性肿瘤的综合发病率为8%[1]。其中大部分是IPMN,IPMN是以胰管上皮腺瘤性增生为特征的一类病变,可累及主胰管、分支胰管或两者兼而有之[2]。IPMN多发生于老年人(中位年龄65岁,范围40~75岁),男性较多见。大多数IPMN的患者无症状,多因无关原因行腹部影像学检查时偶然发现,少部分患者会出现症状,包括黄疸、腹痛、急性胰腺炎、新发或恶化的糖尿病、体重减轻和脂肪泻[3-4]。本例患者处于高发年龄,且已出现相关临床症状。IPMN可分为3种类型,即主胰管型(main-duct,MD)、分支胰管型(bruch-duct,BD)和混合型(mixed-type,MT)[5]。本例患者即属于MD,病灶位于胰头部,主胰管全程不均匀扩张。在手术切除的患者中,MD/MT-IPMN的平均侵袭性癌变率为43%,而BD-IPMN的仅为16.5%。且需要注意的是,由于大多数BD-IPMN患者都是非手术处理的,因此,所有BD-IPMN患者的恶性程度可能低于5%[4,6]。根据2017年的国际指南[4]及2018年的欧洲指南[6],缺乏高风险特征/绝对适应证和令人担忧的特征/相对适应证的患者应进行非手术治疗[4,6-7]。因此,术前准确诊断IPMN,进而鉴别MD-IPMN及BD-IPMN,对于临床选择正确的治疗方法及改善患者的预后十分重要。
2017年福冈共识会议提出,影像学根据IPMN的肿瘤大小、主胰管内径、壁上实质结节大小和相关病变(淋巴结病变)可进行术前诊断及鉴别诊断[4]。根据2018年欧洲指南[6],进一步分析所有绝对(肿瘤相关性黄疸,存在≥5 mm增强的壁结节,固体成分,主胰管扩张≥10 mm)和相对(生长速度快,主胰管扩张在5.0~9.9 mm,囊性肿块直径≥40 mm,新发的糖尿病,IPMN引起的急性胰腺炎)的手术标准[8]。在本例报道中,病灶大小虽然在不同的影像学检查中略有差异,但其大小均已超过4 cm。在常规二维灰阶超声扫查及CT平扫时,均可见病灶与主胰管相通,主胰管由近至远呈不均匀扩张,这一征象在MRCP上显示得更加清晰。常规二维灰阶超声能敏感地检出胰腺内的囊性病变,在本例报道中常规二维超声检查可见胰头部病灶,呈多房囊性结构,且与主胰管明显相通。彩色多普勒超声可以测及分隔及实质回声内的血流信号,然而其对于病灶良恶性的诊断特异度和准确度较低。进一步增强扫描后CEUS及CT、MRI均可见病灶内部分隔及结节的明显强化。但CT及MRI检查存在操作复杂、造影剂致敏率高,且无法实时观察等缺点。随着CEUS检查技术的发展,其在胰腺肿瘤诊断方面的应用也越来越多。造影剂SonoVue是一种纯血池超声造影剂,可以实时、动态地显示病灶内的微循环血流灌注。在本例患者中,CEUS可以动态、实时地显示病灶内实质回声的微循环血流灌注增强-消退的情况,注射超声造影剂SonoVue后可见病灶内实质回声动脉期呈快速整体增强,迅速达峰值后相对周围胰腺实质呈相对高增强,静脉期开始逐渐减退,延迟期呈稍低回声改变。在一项对符合PRISMA标准的文献进行的系统综述,以及对选定的研究进行的荟萃分析[9]中指出,壁结节的存在及其大小对预测IPMN中浸润性癌(invasive cancer,iCa)或高度不典型增生(high-grade dysplasia,HGD)具有实质性的作用。这一结果与2017年修订的国际IPMN管理共识指南[10],≥5 mm的壁结节这一影像学特征与IPMN的恶性关联最强相一致。文中所选定的研究分析认为对比增强的超声检查可以作为鉴别实质性壁结节和粘蛋白凝块的准确诊断工具,其假阴性率非常低,因此可以用来表征壁结节的特征,比如大小[9],从而更加准确地判断IPMN的良恶性。与其他影像学技术相比,其独特的优势在于可实时、动态地观察病灶,操作方便,与常规二维超声结合有助于术前早期发现、定位及识别IPMN中恶变(从HGD到iCa)的风险,使临床决策更加准确和全面,特别是对于手术并发症风险较高的患者。
目前,国内外通过CEUS诊断IPMN的患者报道较少,这可能与该病本身的发病率低有关,另一方面是由于目前CEUS对于胰腺囊实性病变的研究相对较少。IPMN是具有一定的恶性潜能的胰腺囊实性病变,本例报道旨在提高超声科医师对CEUS诊断胰腺导管内乳头状肿瘤及其恶性表现的认识,为临床决策提供更加有价值的参考意见。
