先天性心脏病术后人细小病毒B19 感染患儿的临床特征分析△
2021-11-22郭予雄吴家兴郑贵浪孙跃玉陈佩玲刘晓冰温树生
胡 燕,王 春,郭予雄,王 静,吴家兴,郑贵浪,孙跃玉,陈佩玲,刘晓冰,温树生
[1.广东省人民医院(广东省医学科学院)儿科重症监护病房,广州 510080;2.广东省心血管病研究所小儿心脏外科广东省华南结构性心脏病重点实验室广东省人民医院(广东省医学科学院),广州510080]
人细小病毒B19(human parvovirus B19,HPVB19)是一种无包膜的单链线性DNA 病毒,主要通过呼吸道途径从急性感染患者的气溶胶中获得,也可通过受感染的血液和血液制品经肠道外传播[1-2]。人群普遍易感,在冬末至初夏其传染性达到高峰[3]。HPV-B19 感染因宿主对感染的免疫反应和血液学状态而异,可从亚临床感染到皮肤和关节症状,严重者甚至可能出现致死性血液学影响[4-5]。目前国内鲜见小儿先天性心脏病(congen⁃ital heart disease,CHD)术后并发HPV-B19 感染的报道。本文回顾性总结分析2019 年6 月至2021年6 月在广东省人民医院确诊的CHD 术后并发HPV-B19 感染患儿的诊疗经过,以提高医师对该病的认识。
1 资料和方法
1.1 一般资料
收集广东省人民医院儿科重症监护室(PICU)于2019 年6 月至2021 年6 月确诊的10 例CHD 矫治术后并发HPV-B19 感染患儿的临床资料,回顾性分析其临床资料,包括临床表现、实验室检查及治疗结果。本研究通过广东省人民医院医学伦理审查委员会批准(批准文号:KY-Q-2021-155-01),患儿监护人均知情同意。
1.2 临床资料收集
收集HPV-B19 感染患儿的性别、年龄、CHD类型、手术方案、发病时间、首发症状、主要症状、血细胞变化,骨髓检查结果、治疗、疗效及转归,总结其临床特征。
1.3 人细小病毒B19 检测
采集疑似HPV-B19 感染的患儿血清样本并采用定量聚合酶链反应(quantitative polymerase chain reaction,qPCR)方法对血清样本进行HPV-B19 DNA快速定量检测,qPCR 检测结果≥250 copies/mL 即为HPV-B19 DNA 阳性。
1.4 人细小病毒B19 感染诊断标准
临床有HPV-B19 感染相关的症状,同时符合下列条件之一:(1)特异性IgM 抗体阳性,并HPVB19 DNA 阳性;(2)特异性IgG 由阴性转为阳性或效价≥4倍升高;(3)qPCR检测HPV-B19 DNA阳性,并达到>104 IU/mL(6.5×103copies/mL)或逐渐上升;(4)骨髓或其他组织中B19 病毒抗原阳性或检测出病毒颗粒[6]。
2 结果
2.1 患儿的临床资料
本院同期行小儿CHD 手术共4 004 例,10 例患儿术后发生HPV-B19 感染,发生率为0.25%。男4 例,女6 例,年龄0.84(0.3~9.0)岁,体质量为9.0(3.5~14.5)kg,见表1。7 例复杂型CHD,2 例简单型CHD,1例扩张型心肌病;9例心内畸形矫治术,1 例心脏移植术。8 号患儿于术前由于严重心力衰竭给予静脉-动脉体外膜肺氧合(VA-ECMO)支持,术前使用美罗培南、万古霉素、大扶康、更昔洛韦防治感染,其余9 例术前均无发热等感染表现。
2.2 患儿的临床症状和体征
10 例患儿均出现反复发热,高热为主,最高达40.4 ℃,无伴寒战、疲乏、精神差等全身症状;4 例(例1、例2,例3,例5)合并“肺部感染”,1 例合并脓毒症并肺部感染(例8);10 例均在早期经验性使用抗菌治疗,但仍反复发热或热退而复升(见表1)。2 例(例2,例5)起病后很快出现躯干弥漫充血性皮疹(见图1)。10 例均出现不同程度贫血[血红蛋白88.7(75~99)g/L],4 例轻度贫血,6 例中度贫血;4 例白细胞减少[3.08(2.70~3.93)×109],1 例粒细胞减少,2 例粒细胞缺乏;5 例血小板减少[44.2(9~87)×109];血细胞三系减少1 例(例8);6 例行骨髓涂片检查,3 例骨髓增生减低,3 例单纯红系增生减低(见图2)。
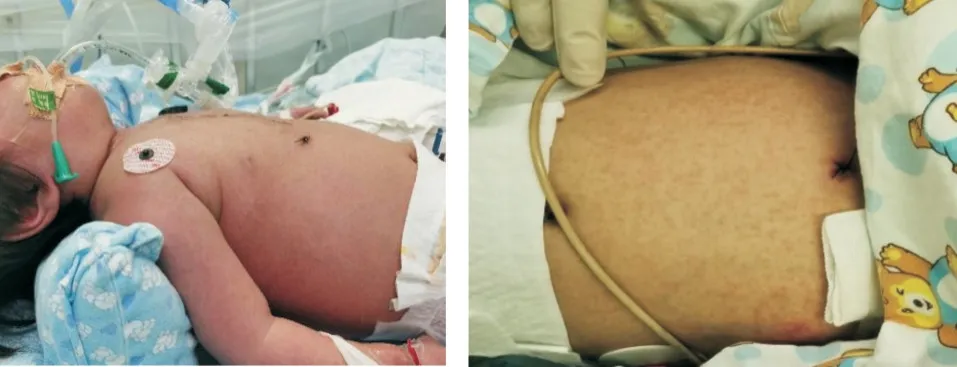
图1 HPV-B19 感染患儿的皮疹图像

图2 6 例患儿术后血象变化趋势图(血象的变化综合了输血、IVIG 等综合治疗,10 例中6 例患儿出现显著血象变化。A:患儿1;B:患儿2;C:患儿3;D:患儿5;E:患儿8;F:患儿10)
2.3 实验室检测结果
1 例(例3)痰培养示肺炎克雷伯氏菌(产超广谱β内酰胺酶),余9 例多次痰培养、血培养均阴性;2 例(例5、例8)血液及肺泡灌洗液宏基因组学新二代测序技术(mNGS)检出HPV-B19 序列;9 例C-反应蛋白、降钙素原(PCT)浓度有不同程度升高,C-反应蛋白浓度为56.5(23.3~147.3)mg/L,降钙素原浓度为2.8(0.5~11.4)pg/mL,1 例(例7)C-反应蛋白、降钙素原浓度正常。
10 例qPCR 检测HPV-B19 DNA 阳性,符合诊断标准(1):例3、例7;符合诊断标准(3):例1、例4、例8、例9、例10;同时符合诊断标准(1)+(3):例2、例5、例6。血清样本于术后第12.8(7~23.0)天进行qPCR 检测,3 例HPV-B19 拷贝数达3.87(1.40~8.61)×106copies/mL,3 例拷贝数<6.5×103copies/mL[1.9(1.3~3.2)×103copies/mL]。9例HPVB19 感染患儿的肝及肾功能、电解质、血氨、血糖、血乳酸、尿酸及肝、脾、泌尿系多普勒超声检查均未见异常。
2.4 治疗及转归
患儿确诊后即给予调整治疗方案,停用抗生素并给予对症治疗(见表1)。服用布洛芬退热,中度贫血、血小板重度减少患儿给予成分输血治疗;7 例患儿输注红细胞悬液,输注量为200(100~400)mL;2 例(例1,例8)输注机采血小板,输注量为1 625(250~3 000)mL;9 例给予静脉输注注射丙种球蛋白(intravenous injection of gamma globulin,IVIG)治疗,输注量为466.7(300~700)mg·kg-1·d-1,连续使用2~5 d,累计用量1.9(1.0~2.8)g·kg-1;1例(例9)仅高热合并轻度贫血,未使用IVIG。1例(例8)合并急性肾损伤需连续肾脏替代治疗。
8 例应用IVIG 患者于第4.4(2~9)天内热退,3 例第4.3(2~7)天(血小板恢复正常,4 例第5.3(3~8)天白细胞恢复正常,4 例第12.5(5~17)天血红蛋白逐渐恢复;5 例应用IVIG 前输注了浓缩红细胞,血红蛋白无继续下降;6 例贫血完全纠正,3 例轻度贫血。1 例(例8)为心脏移植后使用他克莫司、赛可平等免疫抑制药物,免疫功能低下,虽使用足量IVIG 治疗,3 d 后仍因原发病死于心源性休克,死亡时血小板及血红蛋白均未恢复正常;1 例(例10)未使用IVIG 治疗,给予退热、输血等对症治疗后血红蛋白逐渐恢复正常。8 例于第13.0(7~23)天动态检测HPV-B19 病毒载量,7 例于应用IVIG 后qPCR 检测提示HPV-B19 拷贝数下降,1 例拷贝数降为0 copies/mL。9 例患儿治愈出院,1 例死亡(见表1)。

表1 10 例HPV-B19 感染患儿的临床特征
3 讨论
HPV-B19 最初是在1974 年乙肝检测中被发现[7],1985 年被正式确认为细小病毒科的一员[1]。HPV-B19 可引起多种临床疾病,但由于缺乏认识和临床影响不明,未能成为全球关注的病毒病原体。HPV-B19 感染虽有较高的发病率和病死率,但仍然被严重低估[8]。临床对HPV-B19 感染的态度通常是保守的,认为感染通常是轻微的、自限性的,并通过一种特定的免疫反应来控制。然而,临床情况可能更加复杂。急性感染在临床上可能是严重的,而免疫反应受损可能导致持续性感染[9]。HPV-B19 已被逐步检测到并与许多涉及不同组织和器官的临床情况有关,特别是它已被认为是一种相关的嗜心病毒,与急性心肌炎有关,并可能参与慢性心肌病的发生[10]。
HPV-B19 感染在世界范围内传播,显示出区域流行病学差异,通常超过一半的成年人受到感染[5]。在受感染的宿主中,HPV-B19 感染可通过呼吸道途径、内源性再激活或血液制品获得[3]。直接输注含有HPV-B19 的血液和血液成分可以感染易受感染的受体[11]。有先天性、获得性和医源性免疫缺陷的患者易受感染,共同点是在初次感染后不能产生足够的中和抗体来控制病毒[3]。人群中HPV-B19 特异性抗体的患病率随年龄增长而增加,个人感染的典型年龄为5~15 岁。感染会引发免疫反应,从而提供终身保护,防止再次感染。中和抗体在感染后约2 周形成,对从血液中清除病毒非常有效[5]。在具有免疫能力的人中,病毒血症通常在感染后几周即可清除[12]。HPVB19 爆发大多发生在冬季和春季,每隔几年就会发生重大疫情。在疫情爆发期间,病毒向血清阴性个体传播是常见的[13]。传播的高风险期是在感染的急性期早期,在皮疹或关节痛出现之前,此时病毒载量最高。一个康复中的孩子,即使反复出现皮疹,也不再具有传染性[5]。目前,小儿CHD 术后HPV-B19 流行情况未见有文献报道,本研究中HPV-B19 感染发生率为同期小儿CHD 手术的0.25%。心内直视体外循环手术常需输注血制品,且早期胸腺切除是接受心脏手术的婴儿的常规手术,本研究中2 例切除了大部分胸腺,2 例切除了全部胸腺。有文献报道,即使在胸腺切除18 年后,仍存在持续严重的免疫功能障碍[14]。此外,本研究中1 例为心脏移植术后使用免疫抑制药物,存在免疫功能低下。有关小儿CHD术后发生HPVB19 感染的高危因素及发病率情况,仍有待进一步研究。
HPV-B19 感染可引起无症状性感染和症状性感染,其临床表现谱广而复杂,可有单系统及多系统受损害的综合征[15-16]。在健康人群中,常发生无症状性HPV-B19 感染,而在基础疾病患者中的临床表现比以往的健康患者有更大的多样性[17]。HPV-B19 是儿童传染性红斑的病原体,在本研究中所有患儿均出现发热,予经验性抗菌药物治疗,热仍不退或热退而复现,且2 例患儿出现躯干弥漫充血性皮疹,文献报道指出,在评估病因不明的发热和皮疹患者时,应注意HPV-B19 感染[5,18]。
有多种血液疾病和血细胞减少症是HPV-B19感染的临床表现。破坏骨髓中的红系祖细胞是HPV-B19 的标志,贫血是HPV-B19 感染最常见的临床表现[19],其中纯红细胞再生障碍性贫血(purered cell aplasia,PRCA)是众所周知的典型血液学表现。本研究中所有患儿均出现不同程度贫血,骨髓涂片提示骨髓增生减低,特别是红系增生减低,与文献报道相符。本研究中患儿还出现了白细胞减少及中性粒细胞减少或缺乏。通过对人类实验性HPV-B19 感染的研究证明了HPV-B19感染和中性粒细胞减少之间的关系[1]。McClain等[20]对20 例原发性中性粒细胞减少症患儿进行研究,其中15 例骨髓HPV-B19 DNA 阳性,6 例血清抗HPV-B19 IgG 阳性。本研究中部分患儿还出现了血小板减少,已知某些血小板具有HPV-B19 受体,HPV-B19 感染也可导致血小板减少伴贫血或双核细胞减少[21]。在免疫抑制人群中,HPV-B19感染期间血小板减少的发生率似乎增加,在一项关于肾移植后发生HPV-B19 感染的98 例患者的研究中,21%的患者出现血小板减少[19]。HPVB19 已被认为是免疫性血小板减少性紫癜的诱因之一[22]。在健康人即使没有贫血也有中性粒细胞减少和血小板减少的情况下,应考虑对HPV-B19感染进行评估,以此作为鉴别诊断[23]。
大多数HPV-B19 感染患儿不需要隔离,也不需要特殊治疗。对于有症状的贫血患者,可能需要包括补液和输血在内的对症支持治疗[24]。目前还没有针对HPV-B19 感染的特异性抗病毒治疗或强化免疫球蛋白产品[3,5]。IVIG 是HPV-B19 抗体的良好来源,IVIG 治疗已被证明是有效的,但尚未开展对照研究。文献报道,以400 mg/kg 的IVIG应用5 d 疗程可导致网织红细胞数量、血红蛋白浓度的增加和病毒载量的迅速下降[25]。目前,当患者需要控制HPV-B19 感染时,慢性感染或临床上严重的急性感染,以及无法建立有效的免疫反应时,IVIG 是首选的治疗方法[9]。Modrof 等[26]对评价IVIG 治疗HPV-B19 感染相关的PRCA 的疗效的小样本研究中,认为IVIG 治疗似乎在短期内对免疫低下的HPV-B19 感染PRCA 患者有效。本研究中9 例采用足量IVIG 治疗有效,7 例复查病毒载量迅速下降;1 例轻症患儿虽未使用IVIG,但经输血及对症支持治疗后症状亦得到改善,提示合并HPV-B19 感染是否需使用IVIG 治疗需结合临床及患儿免疫功能状态等综合评估。
综上,小儿CHD 术HPV-B19 感染临床表现多样化,可伴有发热或皮疹,出现轻度和短暂的血液学影响,如术后出现病因不明的发热,伴有血细胞减少,贫血加重或皮疹需注意排除HPV-B19 感染。HPV-B19 感染患儿确诊后早期应用IVIG 可缩短热程,加速血细胞恢复。因本研究患儿数少,尚需扩大样本量进一步观察总结。
