除湿健脾汤对溃疡性结肠炎小鼠IL-10/JAK1/STAT3通路及肠上皮细胞凋亡的影响*
2021-11-21陈志涛卢亚奇
陈志涛,郑 轶,杨 静,卢亚奇
(武汉市中心医院,湖北 武汉 430014)
溃疡性结肠炎(ulcerative colitis,UC)是一种慢性炎症性肠病,多种因素刺激可导致机体免疫反应异常,放大炎症反应,引起肠黏膜组织持续损伤,因此抑制免疫炎症是治疗溃疡性结肠炎的核心[1-2]。Janus激酶(Janus kinase,JAK)为非受体蛋白酪氨酸激酶家族,信号转导转录活化因子(signal transducer and activator of transcription,STAT)是一种能与靶基因调控区DNA结合的胞质蛋白家族,JAK家族成员可与STAT家族成员组成多条JAK/STAT信号通路[3]。其中,白介素-10(IL-10)就可通过激活炎性细胞内JAK1/STAT3通路而发挥抗炎作用[4]。除湿健脾汤,出自《万病回春》卷三,具有健脾除湿的功效,主治“久泻色苍而齿疏倦怠,食减下坠”[5]。健脾除湿法可显著改善肠道菌群[6],因此本研究推测除湿健脾汤加减可能治疗UC,并通过使用葡聚糖硫酸钠(dextran sulfate sodium salt,DSS)诱导小鼠建立UC模型,观察除湿健脾汤对UC的治疗效应并分析与IL-10/JAK1/STAT3通路的关系,以期为除湿健脾汤应用于UC治疗提供理论参考。
1 材料与方法
1.1 实验动物 健康雄性SPF级BALB/c小鼠60只,体质量20 g左右,购自北京北生研生物制品有限公司,动物许可证号:SYXK(京)2016-0051。饲养环境为温度(25±2)℃,湿度50%,正常饮食,光照明/暗(12/12h)。本实验经本院动物伦理委员会批准,并遵守3R保护原则进行实验。
1.2 药物与试剂 除湿健脾汤,方药组成:白术5 g,苍术3 g,白茯苓3 g,白芍3 g,当归2 g,厚朴2 g,陈皮2 g,猪苓1.5 g,泽泻1.5 g,柴胡2 g,升麻2 g,防风2 g,甘草1 g。
本研究所需中药均购自北京同仁堂。参考文献[7]将上述药材加水煮,过滤浓缩,提取有效成分,制得干膏。葡聚糖硫酸钠(DSS)(美国Sigma Aldrich公司,批号:D4911);美沙拉嗪(上海爱的发制药有限公司,国药准字H20143164);IL-10抗体(货号:ab189392)、JAK1抗体(货号:ab133666)、STAT3抗体(货号:ab68153)、β-actin抗体(货号:ab8226)、山羊抗兔IgG多克隆抗体(货号:ab150077)(英国Abcam公司);小鼠IL-6 ELISA试剂盒(货号:BMS603-2)、IL-10 ELISA试剂盒(货号:88-7105-22)、TNF-α ELISA试剂盒(货号:BMS607-3)[赛默飞世尔科技(中国)有限公司];伊红苏木精试剂盒(货号:C0105)、蛋白提取试剂盒(货号:P0028)、BCA试剂盒(货号:P0012)、TUNEL细胞凋亡检测试剂盒(货号:C1098)(上海碧云天公司)。
1.3 主要仪器FC型酶标仪(上海沃元科技有限公司);RM2235手动轮转式切片机(德国Leica公司);MM800型光学显微镜(日本尼康公司);PowerPac HC型蛋白电泳仪、Trans-Blot SD半干转膜仪(美国Bio-Rad公司);GIS-500凝胶成像仪(杭州Miulab公司)。
1.4 造模与分组 小鼠适应性饲养1周后,随机分为空白对照组,模型组,美沙拉嗪组和除湿健脾汤低、中、高剂量组,每组10只。参照文献[8],采用DSS诱导法建立UC模型。除空白对照组外,其余小鼠每天自由饮用5% DSS溶液100 mL,连续1周;空白对照组小鼠每天正常饮水。待小鼠出现腹泻血便、体质量下降等症状,表明溃疡性结肠炎模型复制成功。
1.5 实验给药 根据实验动物等量剂量换算,使用蒸馏水将除湿健脾汤提取物分别配制为5、10、15 mg/mL溶液,从造模第1天起,除湿健脾汤低、中、高剂量组小鼠按照1 mL/kg剂量灌胃,美沙拉嗪组灌胃给予美沙拉嗪片剂水溶液,0.4 g/kg[9],空白对照组和模型组灌胃给予等体积蒸馏水,1次/d,连续14 d。动物饲养期间自由饮食饮水。
1.6 观察指标
1.6.1 一般情况观察 实验过程中,每天观察小鼠的精神活动状态、记录小鼠体质量变化,观察粪便性状及便血情况。参照文献[10],计算疾病活动指数(disease activity index,DAI)评分,评分标准见表1。DAI=(体质量减轻率分数+大便性状分数+便血程度分数)/3。
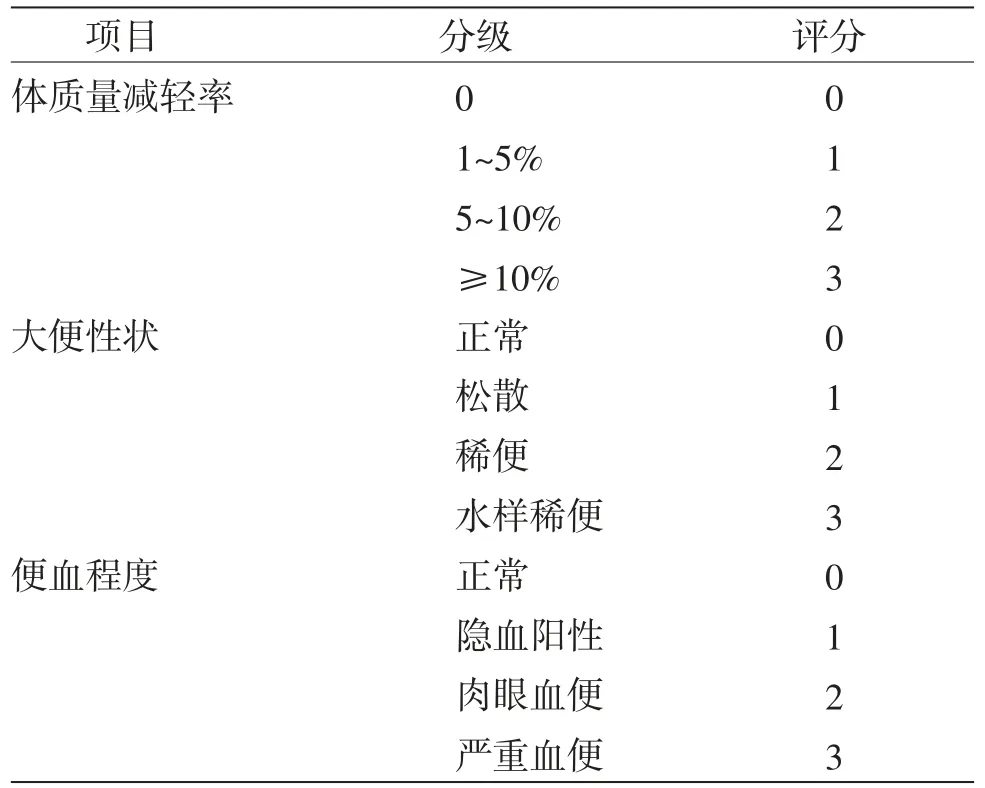
表1 DAI评分标准
1.6.2 标本采集 最后一次灌胃24 h后,小鼠经眼球取血后断颈处死。血液经过离心后取血清,-20℃中保存备用。解剖小鼠,取出整段结肠,并测量长度及质量。从结肠病变处截取2~3 cm,置于10%甲醛溶液中固定,其余病变结肠组织置于-80℃中冻存。
1.6.3 结肠组织病理学检测 取出在甲醛中固定的结肠组织,梯度乙醇脱水,石蜡包埋,HE染色后观察病理学变化。并参照文献[11]对结肠组织进行组织损伤指数(tissue damage index,TDI)评分。
1.6.4 ELISA检测血清中IL-6、IL-10和TNF-α(肿瘤坏死因子-α)含量 根据ELISA试剂盒说明书检测血清中IL-6、IL-10和TNF-α含量。使用酶标仪测定OD450值,计算样品浓度。
1.6.5 肠上皮细胞凋亡情况检测 利用TUNEL细胞凋亡检测试剂盒对小鼠肠上皮细胞的凋亡情况进行检测。操作步骤:脱蜡,蛋白酶消化20 min后清洗,加入TUNEL反应混合液,于37℃下封闭30 min,加底物显色,苏木素复染,脱水,封片。每组分别随机选取10张切片,每张切片选择10个具有代表性的高倍视野(×400),计数500个细胞中TUNEL染色的阳性细胞数,采用凋亡指数表示,凋亡指数=(凋亡细胞数/细胞总数)×100%。
1.6.6 Western blotting检测小鼠结肠组织中IL-10、JAK1、STAT3蛋白表达水平 取出在-80℃冻存的结肠组织,按照蛋白提取说明书提取总蛋白并测定蛋白含量。每孔上样50 μg,经过电泳转膜,加一抗、二抗,显色曝光,拍照,分析数据。其中,β-actin为内参蛋白,灰度值比值为该蛋白的相对表达量。
1.7 统计学方法 采用SPSS 22.0软件对数据进行统计,计量资料以(±s)表示,多组间比较采用单因素方差分析,进一步两两比较采用SNK-q检验,P<0.05为差异有统计学意义。
2 结 果
2.1 各组小鼠一般情况及DAI评分比较 空白对照组小鼠精神状态良好,饮食饮水正常,大便正常无隐血现象,体质量均无明显下降;模型组小鼠精神呆滞,行动缓慢,进食少,体质量明显下降,大便隐血或便血,并且症状逐渐加重;给药后,美沙拉嗪组和除湿健脾汤低、中、高剂量组小鼠精神状况改善,饮食饮水恢复正常,体质量有所增加,无肉眼便血,少数大便隐血。与空白对照组比较,模型组小鼠DAI评分明显升高(P<0.05);与模型组比较,除湿健脾汤高剂量组和美沙拉嗪组小鼠DAI评分明显下降(P<0.05);除湿健脾汤高剂量组小鼠DAI评分与美沙拉嗪组比较,差异无统计学意义(P>0.05)。(见表2)
表2 各组小鼠DAI评分比较(±s,分)
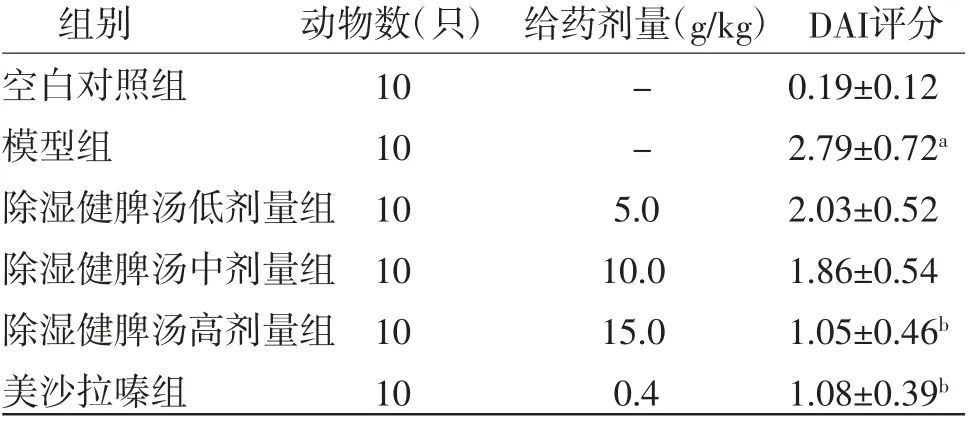
表2 各组小鼠DAI评分比较(±s,分)
注:与空白对照组比较,aP<0.05;与模型组比较,bP<0.05
组别 动物数(只) 给药剂量(g/kg)DAI评分空白对照组 10 - 0.19±0.12模型组 10 - 2.79±0.72a除湿健脾汤低剂量组10 5.0 2.03±0.52除湿健脾汤中剂量组10 10.0 1.86±0.54除湿健脾汤高剂量组10 15.0 1.05±0.46b美沙拉嗪组 10 0.4 1.08±0.39b
2.2 各组小鼠结肠长度和质量比较 模型组小鼠单位结肠整体长度明显短于空白对照组(P<0.05),单位结肠质量明显高于空白对照组(P<0.05);除湿健脾汤高剂量组小鼠单位结肠长度明显长于模型组(P<0.05),单位结肠质量明显低于模型组(P<0.05);除湿健脾汤低、中剂量组小鼠单位结肠长度和质量均有所改善,但与模型组比较,差异均无统计学意义(P>0.05);除湿健脾汤高剂量组小鼠单位结肠长度和质量与美沙拉嗪组比较,差异无统计学意义(P>0.05)。(见表3)
表3 各组小鼠单位结肠长度和质量比较(±s)
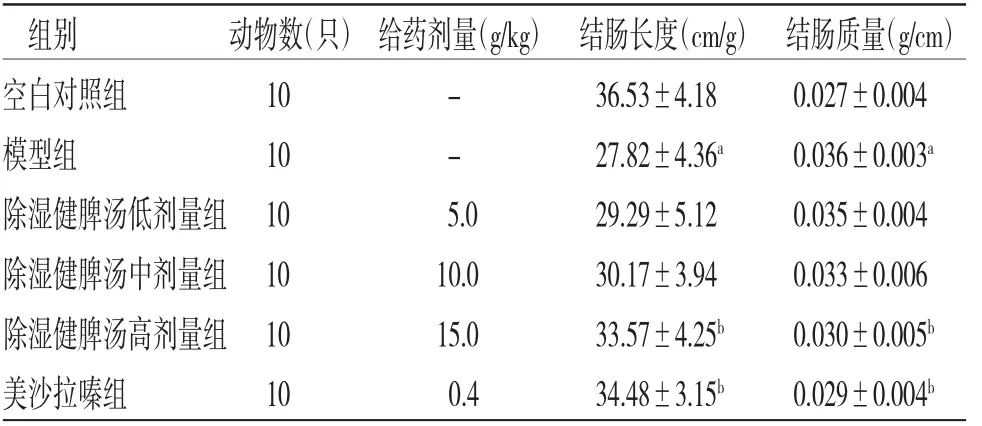
表3 各组小鼠单位结肠长度和质量比较(±s)
注:与空白对照组比较,aP<0.05;与模型组比较,bP<0.05
组别 动物数(只)给药剂量(g/kg) 结肠长度(cm/g) 结肠质量(g/cm)空白对照组 10 - 36.53±4.18 0.027±0.004模型组 10 - 27.82±4.36a 0.036±0.003a除湿健脾汤低剂量组10 5.0 29.29±5.12 0.035±0.004除湿健脾汤中剂量组10 10.0 30.17±3.94 0.033±0.006除湿健脾汤高剂量组10 15.0 33.57±4.25b 0.030±0.005b美沙拉嗪组 10 0.4 34.48±3.15b 0.029±0.004b
2.3 除湿健脾汤对UC小鼠结肠组织病理学的影响 空白对照组小鼠结肠组织完整,结构清晰,腺体排列整体,上皮细胞排列整齐,无缺损,无病变;模型组小鼠结肠组织结构异常,腺体排列紊乱,广泛缺失,黏膜表层破坏,可见炎症细胞大量浸润;美沙拉嗪组和除湿健脾汤中、高剂量组小鼠结肠组织结构基本恢复正常,黏膜缺损减轻,炎症细胞浸润减少,较模型组明显改善;除湿健脾汤低剂量组小鼠结肠组织病理变化程度介于模型组和除湿健脾汤中剂量组之间。(见图1)
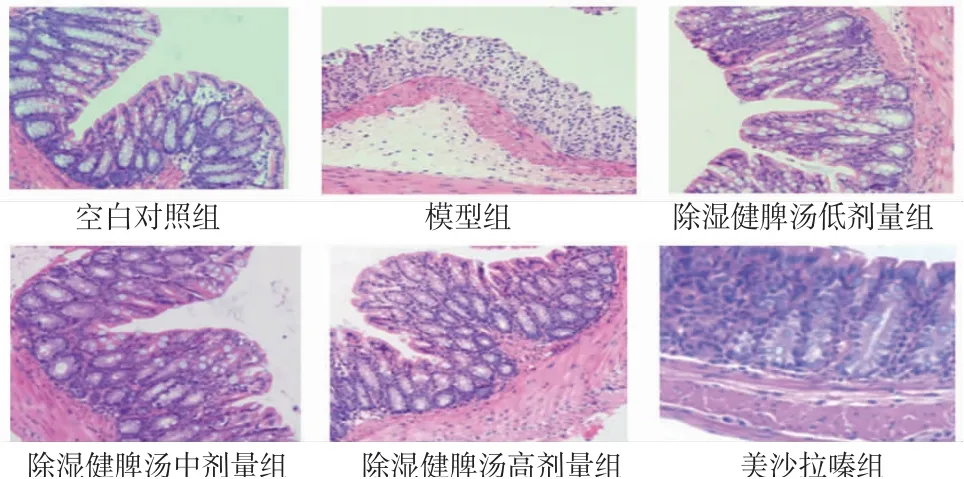
图1 各组小鼠结肠组织病理切片图(HE,×200)
模型组小鼠TDI评分明显高于空白对照组(P<0.05),除湿健脾汤低、中、高剂量组小鼠TDI评分明显低于模型组(P<0.05),且呈剂量依赖性。除湿健脾汤高剂量组小鼠TDI评分与美沙拉嗪组比较,差异无统计学意义(P>0.05)。(见表4)
表4 各组小鼠TDI评分比较(±s,分)
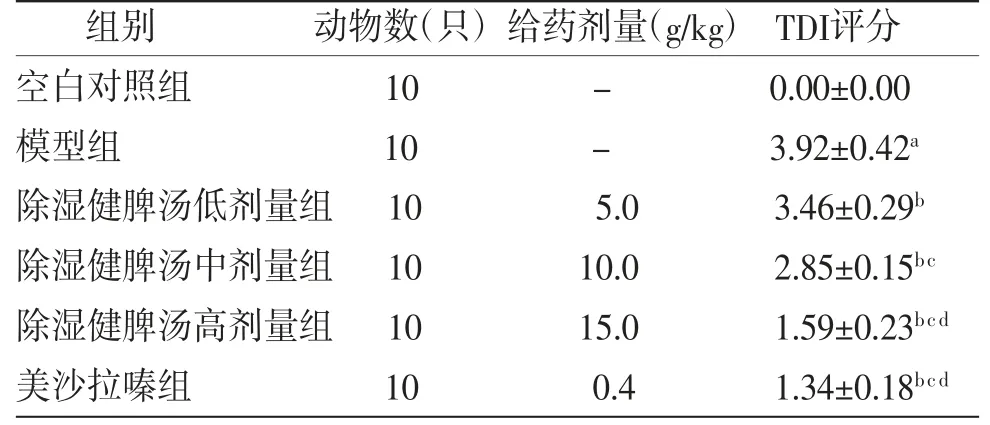
表4 各组小鼠TDI评分比较(±s,分)
注:与空白对照组比较,aP<0.05;与模型组比较,bP<0.05;与除湿健脾汤低剂量组比较,cP<0.05;与除湿健脾汤中剂量组比较,dP<0.05
组别 动物数(只)给药剂量(g/kg)TDI评分空白对照组 10 - 0.00±0.00模型组 10 - 3.92±0.42a除湿健脾汤低剂量组10 5.0 3.46±0.29b除湿健脾汤中剂量组10 10.0 2.85±0.15bc除湿健脾汤高剂量组10 15.0 1.59±0.23bcd美沙拉嗪组 10 0.4 1.34±0.18bcd
2.4各组小鼠血清中IL-6、IL-10和TNF-α含量比较 模型组小鼠血清IL-6、IL-10、TNF-α含量明显高于空白对照组(P<0.05),除湿健脾汤低、中、高剂量组小鼠血清IL-6、IL-1β、TNF-α含量明显低于模型组(P<0.05),且呈剂量依赖性。除湿健脾汤高剂量组小鼠血清IL-6、IL-10、TNF-α含量与美沙拉嗪组比较,差异无统计学意义(P>0.05)。(见表5)
表5 各组小鼠血清中IL-6、IL-10、TNF-α含量比较(±s,pg/mL)
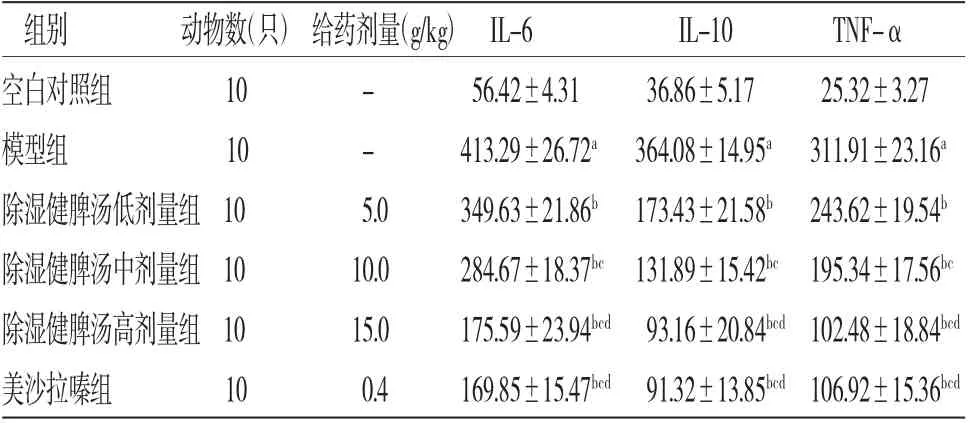
表5 各组小鼠血清中IL-6、IL-10、TNF-α含量比较(±s,pg/mL)
注:与空白对照组比较,aP<0.05;与模型组比较,bP<0.05;与除湿健脾汤低剂量组比较,cP<0.05;与除湿健脾汤中剂量组比较,dP<0.05
组别 动物数(只)给药剂量(g/kg)IL-6 IL-10 TNF-α空白对照组 10 - 10 - 56.42±4.31 36.86±5.17 25.32±3.27模型组 413.29±26.72a 364.08±14.95a 311.91±23.16a除湿健脾汤低剂量组10 5.0 349.63±21.86b 173.43±21.58b 243.62±19.54b除湿健脾汤中剂量组10 10.0 284.67±18.37bc 131.89±15.42bc 195.34±17.56bc除湿健脾汤高剂量组10 15.0 175.59±23.94bcd 93.16±20.84bcd 102.48±18.84bcd美沙拉嗪组 10 0.4 169.85±15.47bcd 91.32±13.85bcd 106.92±15.36bcd
2.5 各组小鼠肠上皮细胞凋亡情况比较 空白对照组小鼠结肠组织偶尔可见凋亡细胞;模型组小鼠上皮细胞凋亡指数明显高于空白对照组(P<0.05);与模型组比较,除湿健脾汤低、中、高剂量组小鼠上皮细胞凋亡指数明显降低(P<0.05),且呈剂量依赖性。其中,除湿健脾汤高剂量组小鼠上皮细胞凋亡指数与美沙拉嗪组比较,差异无统计学意义(P>0.05)。(见图2、表6)
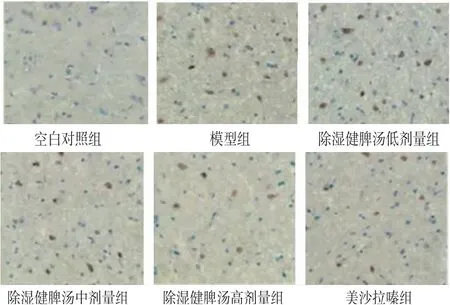
图2 各组小鼠结肠组织上皮细胞凋亡图(×200)
表6 各组小鼠上皮细胞凋亡指数比较(±s)
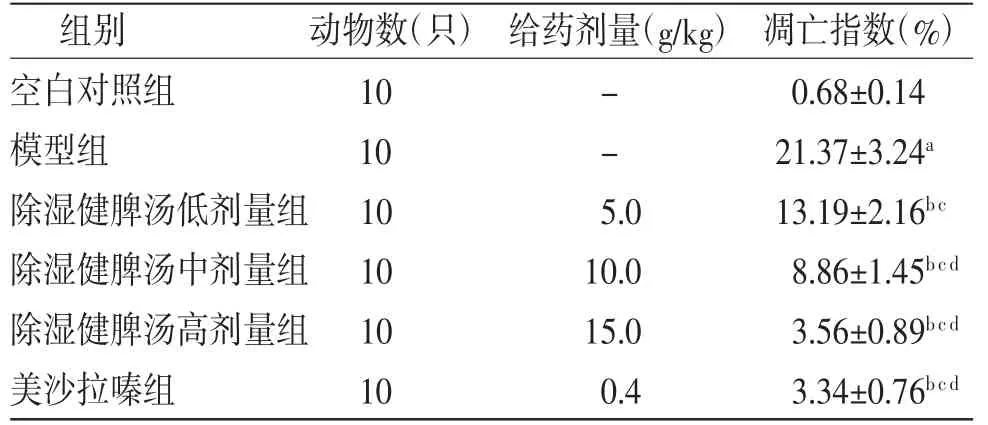
表6 各组小鼠上皮细胞凋亡指数比较(±s)
注:与空白对照组比较,aP<0.05;与模型组比较,bP<0.05;与除湿健脾汤低剂量组比较,cP<0.05;与除湿健脾汤中剂量组比较,dP<0.05
组别 动物数(只)给药剂量(g/kg)凋亡指数(%)空白对照组 10 - 0.68±0.14模型组 10 - 21.37±3.24a除湿健脾汤低剂量组10 5.0 13.19±2.16b c除湿健脾汤中剂量组10 10.0 8.86±1.45b c d除湿健脾汤高剂量组10 15.0 3.56±0.89b c d美沙拉嗪组 10 0.4 3.34±0.76b c d
2.6 各组小鼠结肠组织中IL-10、JAK1、STAT3蛋白表达水平比较 与空白对照组比较,模型组小鼠结肠组织中IL-10、JAK1、STAT3蛋白相对表达量明显升高(P<0.05);与模型组比较,美沙拉嗪组和除湿健脾汤低、中、高剂量组小鼠结肠组织中IL-10、JAK1、STAT3蛋白相对表达量明显下降(P<0.05),且呈剂量依赖性。除湿健脾汤高剂量组小鼠结肠组织中IL-10、JAK1、STAT3蛋白相对表达量与美沙拉嗪组比较,差异无统计学意义(P>0.05)(见图3、表7)
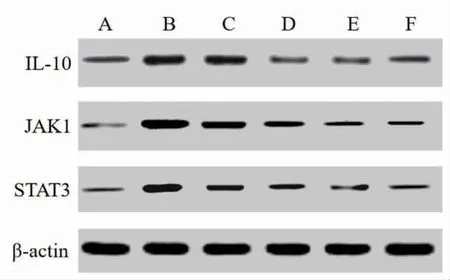
图3 各组小鼠结肠组织Western blotting图
表7 各组小鼠结肠组织IL-10、JAK1、STAT3蛋白表达水平比较(±s)
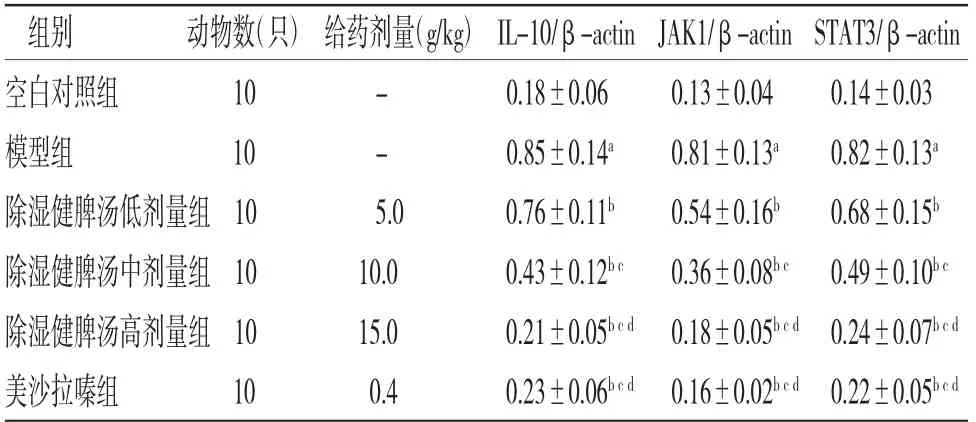
表7 各组小鼠结肠组织IL-10、JAK1、STAT3蛋白表达水平比较(±s)
注:与空白对照组比较,aP<0.05;与模型组比较,bP<0.05;与除湿健脾汤低剂量组比较,cP<0.05;与除湿健脾汤中剂量组比较,dP<0.05
组别 动物数(只)给药剂量(g/kg)IL-10/β-actin JAK1/β-actin STAT3/β-actin空白对照组 10 组 10 - 0.18±0.06 0.13±0.04 0.14±0.03模型- 0.85±0.14a 0.81±0.13a 0.82±0.13a除湿健脾汤低剂量组10 5.0 0.76±0.11b 0.54±0.16b 0.68±0.15b除湿健脾汤中剂量组10 10.0 0.43±0.12b c 0.36±0.08b c 0.49±0.10b c除湿健脾汤高剂量组10 15.0 0.21±0.05b c d 0.18±0.05b c d 0.24±0.07b c d美沙拉嗪组 10 0.4 0.23±0.06b c d 0.16±0.02b c d 0.22±0.05b c d
3 讨 论
溃疡性结肠炎是一种影响结肠的慢性、特发性炎症性疾病,最常见于30~40岁的成年人,并导致残疾[12]。其特征临床表现为黏膜炎症的复发和缓解,开始于直肠,并延伸至结肠的近段。其中,结肠的慢性炎症是UC的主要临床表现[13]。本研究采用DSS诱导小鼠建立UC模型,结果显示小鼠体质量明显下降,小鼠隐血或便血,单位结肠整体程度缩短,单位结肠质量升高,DAI评分明显升高,血清中IL-6、IL-10、TNF-α含量明显升高。显微镜下观察到小鼠结肠组织结构破坏,腺体紊乱,黏膜表层严重破坏,可见大量炎症细胞浸润,肠上皮细胞大量凋亡,表明模型建立成功。
除湿健脾汤具有健脾滋阴、养胃和胃、清热祛湿的作用,在临床应用上具有悠久历史。方中茯苓、白术为君药,茯苓归脾、肾经,既能补脾虚,又是祛湿圣药,白术归脾、胃经,可强脾胃,除湿燥;臣药陈皮和气健脾,祛湿化痰[14];炙甘草为使药,调和诸药,诸药合用,相辅相成,标本兼治,共奏益气健脾、祛湿化浊之功效[15]。现代药理学研究发现,茯苓中有效成分能够抑制炎症因子释放[16];参苓白术散可以通过抑制肠道黏膜组织中细胞因子(IL-6、IL-10、TNF-α)释放,从而缓解DSS结肠炎大鼠的炎症反应[17];贺燕林等[18]研究发现陈皮提取物可降低模型细胞NO释放量,具有显著抗炎作用。
本研究根据参考文献制备除湿健脾汤提取物[7],并治疗UC小鼠,结果显示,小鼠结肠组织结构损伤、炎性细胞浸润等症状减轻,结构基本恢复,小鼠体质量升高,肠上皮细胞凋亡数量减少,DAI评分明显降低,血清中炎症因子IL-6、IL-10、TNF-α含量明显降低,且呈剂量依赖性,表明除湿健脾汤可减轻小鼠炎症反应,缓解结肠组织病变,并随剂量升高作用增强。
IL-10是一种多细胞源、多功能的细胞因子,可与单核细胞、巨噬细胞等细胞表面IL-10受体(IL-10R)结合,进而激活JAK1/STAT3通路,调节细胞生长与分化,参与炎症反应和免疫反应等。本研究结果显示,与空白对照组比较,模型组小鼠结肠组织IL-10、JAK1、STAT3蛋白相对表达量明显升高,说明IL-10可激活JAK1/STAT3通路,增强UC小鼠自身抗炎作用。汤托等[19]研究发现金盏花苷E可通过抑制JAK1/STAT3通路,抑制LPS诱导的炎症反应。李自立等[20]研究发现白藜芦醇可能通过抑制JAK1/STAT3通路减少小鼠动脉血管内的氧化应激及炎症损伤。本研究采用除湿健脾汤提取物处理后,UC小鼠结肠组织IL-10、JAK1、STAT3蛋白相对表达量明显降低,且随着药物剂量增加而更显著,表明除湿健脾汤可减少IL-10炎症因子,下调JAK1/STAT3通路蛋白表达,推测除湿健脾汤可能通过抑制IL-10/JAK1/STAT3蛋白,减轻UC小鼠炎症反应,从而起到治疗作用。
综上所述,除湿健脾汤可能通过抑制IL-10/JAK1/STAT3通路,减轻UC小鼠炎症反应,修复小鼠结肠组织,减少肠上皮细胞凋亡,改善肠道功能,为临床溃疡性结肠炎的治疗提供了新思路,但具体作用机制仍有待于进一步研究。
