地西他滨与DNA相互作用的光谱研究
2021-11-20张璨
张 璨
(天津生物工程职业技术学院,天津 300462)
DNA 是遗传信息的贮存和携带者,是生命体重要的遗传物质,也是细胞和病毒的主要组成部分。DNA 上平行堆积的碱基、聚合的阴离子磷酸骨架及两条由核苷酸链形成的大沟、小沟组成了药物分子识别的位点[1]。研究药物与DNA 的相互作用有助于阐明药物的作用机制。地西他滨(Decitabin, 分子式为C8H12N4O4)是一种DNA甲基转移酶抑制剂。此药可抑制DNA 甲基转移酶,减少DNA 的甲基化,从而可起到抑制肿瘤细胞增殖的作用。有研究指出,用地西他滨治疗骨髓增生异常综合征可取得良好的效果[2]。在本文中,笔者主要是研究DNA 对地西他滨的荧光猝灭机制,并通过紫外法和黏度测定法进一步确认地西他滨与DNA 的结合方式。
1 材料与方法
1.1 实验仪器
本研究中所用的仪器主要包括:Qubit ™ Flex 荧光分光光度仪;紫外可见分光光度计(UV-1800);pHS-s 型pH 计;乌贝路德黏度计;微量注射器;电子分析天平。
1.2 实验试剂
本研究中所用的试剂主要包括:鲱鱼精DNA、地西他滨、盐酸小檗碱溶液、二次蒸馏水等。
1.3 实验方法
配制DNA 溶液,方法是:用电子分析天平称取一定量的鲱鱼精DNA(简称DNA),加入100 mL 的容量瓶中,并用二次蒸馏水定容至刻度。用紫外可见吸收光谱法确定其浓度和纯度,并将其置于0℃~4℃的环境中保存。配制地西他滨溶液,方法是:用电子分析天平称取一定量的地西他滨,加入100 mL 的容量瓶中,并用二次蒸馏水定容至刻度(使其浓度为10-3mol/L)。将其置于0℃~4℃的环境中保存。配制缓冲溶液:将稀盐酸滴加到0.1 mol/L 的三羟甲基氨基甲烷(Tris)溶液中,借助pH 计将该溶液的pH 调节至4.0,即制得Tris-HCl缓冲溶液。用微量注射器在10 mL 的容量瓶中依次加入相同剂量的地西他滨溶液及不同剂量的DNA 溶液, 再加入相同量的Tris-HCl 缓冲溶液,加水稀释至刻度,摇匀静置,并测定荧光激发光谱和发射光谱。荧光测量的激发波长为241 nm,荧光发射波长为530 nm,激发和发射狭缝均为10 nm。用微量注射器在10 mL 的容量瓶中依次加入相同剂量的DNA 溶液及不同剂量的地西他滨溶液,再加入相同量的Tris-HCl 缓冲溶液,加水稀释至刻度,摇匀静置后用乌贝路德黏度计测定黏度。用微量注射器在10 mL 的容量瓶中依次加入相同剂量的地西他滨溶液、DNA 溶液及不同量的KCl 溶液,然后再加入相同量的Tris-HCl 缓冲溶液,加水稀释至刻度,摇匀静置后,测定荧光强度。荧光测量的激发波长为241 nm,荧光发射波长为530 nm,激发和发射狭缝均为10 nm。用微量注射器在10 mL 的容量瓶中依次加入相同剂量的盐酸小檗碱溶液、DNA 溶液及不同剂量的地西他滨溶液,然后再加入相同量的Tris-HCl 缓冲溶液,加水稀释至刻度,摇匀静置后,测定荧光强度。荧光测量的激发波长为241 nm,荧光发射波长为530 nm,激发和发射狭缝均为10 nm。
2 结果与讨论
2.1 荧光光谱实验
2.1.1 DNA 存在下地西他滨的荧光发射光谱 本实验的结果显示,地西他滨的荧光发射光谱在530 nm 处出现最大发射峰,随着DNA 的加入,530 nm 处荧光发射峰的荧光强度逐渐降低,说明DNA 和地西他滨可能通过结合形成了复合物。详见图1。

图1 DNA 存在下地西他滨的荧光发射光谱
2.1.2 荧光猝灭机制 本实验的结果显示,DNA 对地西他滨的猝灭速率常数远大于各猝灭剂对生物大分子最大扩散控制的碰撞猝灭常数;在温度升高后,其猝灭常数基本不变。在地西他滨发生动态猝灭时,其猝灭常数会随温度的升高而升高。由此可见,DNA 对地西他滨的荧光猝灭作用并非由分子间动态碰撞引起,而是由二者形成复合物所引起的静态猝灭作用。
2.1.3 地西他滨与DNA 二元络合物的组成及其结合常数通过荧光-猝灭分子间的结合常数可推出静态猝灭荧光强度与猝灭剂的关系[3]。本实验的结果显示,在25℃下,地西他滨与DNA 之间的结合常数为2.51×104L·mol-1,结合位点数为1.1151,线性相关系数为0.9986。在40℃下,地西他滨与DNA 之间的结合常数为2.86×104L·mol-1,结合位点数为1.1227,线性相关系数为0.9908。
2.1.4 地西他滨与DNA 结合反应的作用力 不同药物与DNA 之间相互作用力的类型也不尽相同。药物与生物大分子最常见的作用力有氢键作用力、范德华作用力、静电作用力、疏水作用力等。有研究表明,可根据热力学公式计算出药物与生物大分子之间作用力的热力学参数,并据此判断其相互作用力的类型。ΔH >0 及ΔS >0 可判定为疏水作用力;ΔH <0 及ΔS >0 可判定为静电作用力;ΔH <0 及ΔS <0 可判定为氢键作用力或范德华作用力[4]。根据地西他滨与DNA 的结合常数进行计算,可得出二者结合过程的热力学函数,从而可判定地西他滨与DNA 之间的主要作用力为疏水作用力。
2.2 地西他滨对小檗碱-DNA 体系荧光强度影响的研究
盐酸小檗碱(又叫黄连素)是一种异喹啉生物碱,由于其与DNA 有较强的相互作用,且可显示出较好的光敏作用,故可将其作为荧光指示剂进行研究[4]。其原理是在盐酸小檗碱嵌入DNA 双螺旋的碱基对之间后,可使原来较弱发射带的荧光强度增强。本实验的结果数据证实,随着地西他滨浓度的增大,小檗碱-DNA 体系荧光强度无明显的变化。这说明,地西他滨与DNA 之间的结合方式并非嵌入。
2.3 地西他滨与DNA 作用的黏度研究
黏度法是检测溶液状态下药物与DNA 作用模式的重要手段之一。当药物与DNA 以静电作用结合时,DNA溶液的黏度无明显变化;当药物与DNA 的结合方式为嵌入时,为容纳嵌入的配体,DNA 相邻碱基对的距离会变大,导致DNA 螺旋增长,从而使DNA 溶液的黏度增大[5]。本研究中为进一步确定地西他滨与DNA 的结合方式,用乌贝路德黏度计测定了DNA 溶液在不同浓度地西他滨存在下的黏度变化。即向固定浓度的DNA 溶液中加入不同剂量的地西他滨,并计算其相对黏度。实验结果显示,DNA 溶液的相对黏度基本不变。这说明,地西他滨与DNA 之间的结合方式并非嵌入。
2.4 离子强度对地西他滨-DNA 体系荧光强度的影响
某些盐类阳离子(如K+)与DNA 的磷酸基可通过产生静电作用的方式发生强烈的相互作用。若地西他滨与DNA 的相互作用为静电作用,在地西他滨与DNA 溶液中加入K+时,K+会与地西他滨产生竞争,从而可减弱地西他滨与DNA 之间的作用,使荧光猝灭程度减弱。本实验的结果显示,当离子强度升高时,地西他滨和鲱鱼精DNA 的荧光强度都基本不变,猝灭程度无明显变化。这表明,地西他滨与鲱鱼精DNA 之间的相互作用类型并非静电作用。详见图2。

图2 离子强度对地西他滨-DNA 体系荧光强度的影响
为进一步确定地西他滨和鲱鱼精DNA 之间的作用模式,本实验用紫外光谱法研究了在不同浓度DNA 存在下地西他滨的图谱变化。实验结果显示,在pH=4.0 的Tris-HC1 缓冲溶液中,地西他滨在194 nm 和238 nm 处有两个吸收峰。这表明,鲱鱼精DNA 的加入未对地西他滨UV 峰的位置产生影响。其在194 nm 处的吸收峰有下降趋势,而在238 nm 处吸收峰的峰位和峰强均没有变化。可见,地西他滨与DNA 的结合方式为沟槽结合。详见图3。
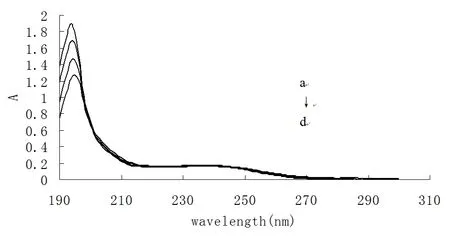
图3 不同DNA 浓度下地西他滨的紫外吸收光谱图
3 小结
本研究采用荧光法和紫外法对DNA 与地西他滨的相互作用进行研究。研究结果表明,在Tris-HCl 缓冲溶液(pH=4.0)中,DNA 对地西他滨荧光(530 nm) 产生了猝灭作用。根据其猝灭常数未随温度升高而变化,得出了其荧光猝灭机制是由形成复合物而引起的静态猝灭。进一步通过计算,分析出DNA 与地西他滨的相互作用类型为疏水作用。根据地西他滨对配合物荧光强度的影响和与DNA 作用的黏度变化情况可知,地西他滨与DNA 的结合方式并非嵌入结合。由离子强度对地西他滨-DNA体系荧光强度的影响可知,地西他滨与DNA 的相互作用类型并非静电作用。结合紫外光谱变化情况可知,地西他滨与DNA 的结合方式为沟槽结合。
