草乌甲素的研究进展
2021-11-19林彦君宋流东
林彦君 宋流东
昆明医科大学药学院暨云南省天然药物药理重点实验室,云南 昆明 650500
乌头属(Aconitum)植物,隶属于毛茛科(Ranunculaceae),其在我国西南横断山区分布较广,常以块根、根入药,多具有祛风除湿、温经止痛的作用[1]。如云南人喜食的草乌,其具有较好的抗炎镇痛、抗病毒、改善内分泌等生理活性,故在民间应用极广,但若处理不当或食用剂量过大也极易出现中毒症状,以心律失常最为常见[2]。究其原因发现:乌头属植物中所含的二萜类生物碱既是主要的药理活性成分,又是毒性成分(指神经毒性和心脏毒性;神经毒性主要表现为麻木,头晕恶心,呕吐,甚至昏迷等症状,而严重的心脏毒性可能诱发房颤致死)。学者们普遍认为,毒性主要是由二萜类生物碱与钠通道相互介导所产生的[3]。同理不难得出:从滇西乌头(AconitumL.bulleyanumDiels)中分离到的二萜双酯型生物碱-草乌甲素,也应该是活性与毒性兼具。我们认为:草乌甲素与同属的滇乌碱相比具有更低的毒性,更宽的治疗窗,未来或许可以通过一些手段使草乌甲素的活性与毒性作用分离开[4][C-8位乙酰酯基、C-14位苯甲酰酯基是乌头碱刺激脊髓小胶质细胞中强啡肽A表达及产生抗过敏活性的必需基团;从作用机制分析,这两个基团的治疗作用可与其神经毒性分离开,而草乌甲素(图1)与乌头碱在这两个位点具有完全一致的必需基团[5]]。早在1986年,就有学者通过扭体法、热板法、光热一甩尾法和甲醛致痛法证实了草乌甲素的镇痛作用[6],并于2013年将其被编入了《神经病理性疼痛诊疗专家共识》[7]。据报道,草乌甲素用于临床治疗骨关节炎、肩周炎、腰肌拉伤、扭伤等慢性疼痛(指病理性疼痛,又细分为炎性疼痛及神经病理性疼痛[8];前者是由周围神经机制介导的,后者是由神经异位放电引起的[9]),已长达三十余年[10]。
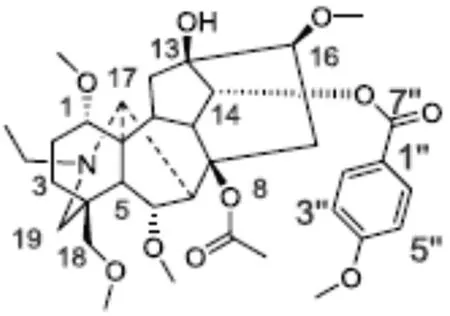
图1 草乌甲素的化学结构式[4]
1 草乌甲素的作用机制
1.1 镇痛作用机制 就目前的研究而言,草乌甲素分子的镇痛机制尚不完全清楚,仍存在很多有争议的观点,主要分为以下三种。
其一:有研究[1, 11-12]显示紫杉醇会导致64%的癌症患者产生四肢感觉异常及严重的疼痛感,而草乌甲素既可以通过抑制突触递质的释放进一步抑制紫杉醇诱导的脊髓背角C-纤维突触的长程增强效应(LTP)以实现镇痛作用,又可以通过去甲肾上腺素能神经和5-羟色胺能神经激活下行疼痛抑制系统,还可以通过阻断脊髓背角突触前末梢的N型钙离子通道来抑制LTP[8](LTP或许与机体耐药性有关)。
其二:Xu, Li, Wang等[13-16]提出乌头提取物(包括草乌甲素)不仅能促进脊髓胶质细胞中强啡肽(一种内源性阿片神经递质)的释放,进而激活脊髓κ-阿片受体产生镇痛效应,还能抑制吗啡的镇痛耐药性及瞬时感受器电位香草酸受体1。然而,阿片类药物引发的耐药性,临床上可能无法与痛觉过敏区分。有学者[14, 17]认为神经病理性疼痛可能是阿片类药物耐药性的一种表现形式,也有可能和阿片类药物产生耐药性共享同一种机制。随着研究的深入,Li等学者[5, 18]又进一步补充论证了其观点:草乌甲素是通过Gs/cAMP/PKA/p38β/CREB信号传导机制刺激小胶质细胞分泌强啡肽A实现镇痛的。此外,Huang,Li等[13, 19-20]发现:因强啡肽A的表达介导了内脏及身体的抗疼痛致敏效应,草乌甲素还可以作为治疗内脏疼痛及肠易激综合征的潜力药物,但需要强调的是:强啡肽A与草乌甲素的抗焦虑作用无关。
其三:神经病理条件下,SNI模型中肢体未损伤侧的背根神经节(DRG)神经元的蛋白激酶C(PKC)会发生上调,而损伤侧的DRG神经元的PKC会发生下调。PKC的上调可促进电压门控钠通道尤其是神经元河豚毒素敏感型(TTX-S)钠通道的开放,而草乌甲素可通过抑制PKC而选择性地、状态依赖型地阻断未损伤侧的TTX-S通道开放(痛觉传递所依赖的电生理基础[21]),进而抑制异位放电以达到镇痛的目的。根据草乌甲素对大鼠SNI模型中肢体损伤侧及未损伤侧的DRG神经元TTX-S和TTX-R通道的影响分析:静息状态下,相较于神经元河豚毒素不敏感型(TTX-R)的钠通道,草乌甲素能更好地阻断失活的神经元河豚毒素敏感型(TTX-S)的钠通道[22-23]。比起Nav1.8 通道(与慢性炎症性痛觉过敏以及急性炎症性高伤害感受有着密切的联系),草乌甲素能更好地阻断Nav1.3 及 Nav1.7通道的开放[23]。
1.2 抗炎作用机制 草乌甲素既可以通过抑制NF-κB炎症信号通路(①影响破骨细胞的分化、融合,从而抑制破骨细胞的形成、促进造骨细胞的生成;②下调肺组织里NF-κB1及PKC-δ 蛋白的表达以减轻肺部的炎症[24-25]),又可以通过抑制MAPK 炎症信号通路的活化及iNOS、COX-2、TLR4 的表达进而抑制由脂多糖(LPS)诱导小鼠RAW264.7巨噬细胞分泌的IL-6、IL-1β、TNF-α致炎因子及单核趋化蛋白MCP-1的表达所产生的细胞炎症反应[26-27]。
1.3 免疫调节机制 草乌甲素能有效抑制致裂原诱导的T、B淋巴细胞转化,一定程度上避免了因二者的高度活化使自身抗体升高而造成的免疫复合物的堆积。此外,草乌甲素还可以抑制巨噬细胞的吞噬功能及NO的分泌[28]。
2 草乌甲素的药理作用
2.1 镇痛作用 草乌甲素具有较好的外周镇痛作用,无心理依赖性及器质性脏器毒性,不失为一种更优的药物选择[29-30]。它既可以用于治疗类风湿性关节炎、骨关节炎、癌性疼痛、带状疱疹痛,缓解风湿及类风湿性关节炎所致的红、肿、热等;又可以作为术后镇痛剂使用,帮助膝关节术后功能性恢复,改善膝关节的运动性疼痛,间接地促进膝关节术后消肿[31-32];还可以用于需要长期镇痛的患者,有助于提高其生活质量。如对比草乌甲素及布洛芬缓释胶囊治疗轻、中度癌痛患者的疗效发现:前者起效慢,直到用药第三天,其疗效才能与后者持平,但前者的不良反应明显少于后者[33]。
2.2 抗炎及免疫调节作用 草乌甲素不但可以通过提高如佐剂性关节炎(AA)大鼠的疼痛阈值、提升血清中β-内啡肽(一种具有镇痛作用的神经肽)的表达,进而抑制炎性趋化因子驱使特定细胞到达炎症部位诱发的自身免疫反应,还可以降低血清中TNF-α、PGE2炎性致痛因子(可增加局部血管通透性、加重炎症程度、促使成纤维细胞增值、血管新生,进而导致骨和软骨产生病理性损伤)的含量进而改善关节炎的肿胀程度[34-35]。与此同时,草乌甲素在治疗哮喘方面也具有潜在的价值:它能够通过恢复Th1/Th2的平衡来缓解鸡卵白蛋白所致的气道、肺部阻塞,进而重塑气道、从而抑制肺炎的发生[36]。
3 草乌甲素不同给药途径的应用
从上世纪八十年代起,国家食品药品监督管理局就批准了草乌甲素肌肉注射剂、片剂、软凝胶胶囊在临床的应用[37]。
3.1 注射给药 草乌甲素注射剂(肌注、穴位注射)除可用于治疗常见慢性疼痛之外,还可用于缓解晚期癌性疼痛。有学者提出,普通的肌肉注射会有一定的刺激性,若采用草乌甲素多囊脂质体或DSPE-PEG2000胶束肌注给药,能显著降低注射部位的刺激性,且运用脂质体载药可以加快吸收速率,延长镇痛作用时间[38]。
动物实验[5, 13]表明,皮下或鞘内注射草乌甲素及其类似物,均可有效抑制福尔马林引起的强直性疼痛,减轻因接种癌细胞而引起的骨痛及因周围脊神经结扎或给予紫杉醇诱发的神经痛。
3.2 口服给药 草乌甲素片和草乌甲素胶囊均可用于治疗骨关节炎(OA)及类风湿关节炎(RA) ,且这两种剂型针对OA的疗效均优于RA。然而,根据20年来的临床用药统计显示,草乌甲素片比胶囊剂应用范围更广、应用时间更长。草乌甲素片既可以治疗各类型的慢性疼痛,如轻、中度烧伤所致的创面疼痛[39],又可以抑制具有剂量依赖性的组胺和氯喹宁诱导的抓挠行为及瘙痒致敏,消除急性瘙痒症状[12],且无成瘾性、耐药性、肾功能损伤等副作用。
3.3 经皮给药 有学者认为注射及口服草乌甲素均不是理想的给药途径,原因如下:①草乌甲素对皮肤黏膜、肌肉均有刺激性且部分患者胃肠道的副作用也较明显,如口唇发麻、恶心呕吐等,严重影响了患者的依从性;②草乌甲素治疗窗窄、半衰期短(约5 h)、生物利用度低、血药浓度波动大,药物的安全性及有效性不能得到很好的控制[40]。
动物实验[40]表明:将草乌甲素制成透皮贴剂或将其微乳制成水性基质贴片,既能避免肝脏的首过效应及肌肉注射的疼痛反应(经皮给药对皮肤的刺激性很小,皮肤反应可在停药后较短时间内自行消退),有效改善其稳定性,提高其透皮速率,在保证释药速率平稳的同时,加快体内吸收,进而使其生物利用度提高3~4倍;又能通过局部用药达到靶向治疗的目的,避免全身给药带来的毒副作用[41]。
4 联合用药的策略
4.1 与吗啡或非甾体类抗炎药联用 90%的疼痛治疗使用的都是非甾体类抗炎药及阿片类药物,前者主要通过抑制COX进而抑制炎症因子的释放以达到抗炎镇痛的作用,但具有损伤胃肠道及心血管事件的风险;后者主要通过作用于阿片受体,使中枢神经递质的释放减少进而阻断神经冲动的传递以达到镇痛的目的,但具有心理依赖性、药物依赖性、呼吸抑制等不良反应,虽有研究[42-43]表明D-氨基酸氧化酶(DAAO)抑制剂CBIO可有效调节、抑制或逆转吗啡的镇痛耐受性,但临床证据还不够充足,所以二者在镇痛方面的应用均不是很理想。
临床发现草乌甲素既可以替代NAISDs联合硫酸吗啡缓释片治疗中晚期癌症,进而减少硫酸吗啡缓释片的使用剂量,降低其毒副作用[44];又可以联合NAISDs用于缓解肩周炎、类风湿性关节炎带来的疼痛感,降低夜间痛醒频率,改善睡眠质量;还可以提高胃肠、肝肾功能不好的患者对镇痛药物的耐受性,减少NAISDs的使用频次[45]。
动物实验[8]表明:草乌甲素因不受阿片受体阻滞剂纳洛酮的影响,它能更好地协同吗啡镇痛以消除其耐药性,但需要注意:米诺环素、利血平会拮抗草乌甲素的镇痛作用,使用草乌甲素时应避免与这两种药物联用[13]。
4.2 与其他药物联用 草乌甲素既可以联合筋骨痛消丸或玻璃酸钠治疗膝关节骨性关节炎,联合低频脉冲治疗膝关节炎[46-47],又可以联合甲氨蝶呤治疗类风湿性关节炎,改善关节功能,增大关节活动度,缓解关节肿胀[21]。
动物实验[48]表明:草乌甲素可作为佐剂与利多卡因或肾上腺素联用以阻断家兔的运动功能,麻痹坐骨神经的感觉(联用使镇痛效应延长至24 h,阻断作用直到6 d之后才会完全消失),因利多卡因的麻醉作用能使血流变慢,一定程度上可使草乌甲素的毒性降低。
5 结语
草乌甲素具有很好的抗炎、镇痛、免疫抑制等作用。近年来其在治疗各种原因引起的慢性疼痛方面发挥着重要作用,因其不产生耐药性、毒副作用小,非常适合需要长期镇痛的患者使用。未来的研究重点应该放在如何设计出更优的药物剂型、提高草乌甲素的生物利用度;如何完善临床用药监察、系统追踪草乌甲素的用药安全性评价上,争取最大化地发挥利草乌甲素的药用价值。通过查阅相关文献,本文对草乌甲素的镇痛、抗炎等作用机制、药理作用、不同的给药途径及联合用药的策略进行了综述,旨在为草乌甲素更好地应用于临床提供支撑材料。
