一株微杆菌CBA01对球形棕囊藻的溶藻特性与生理响应研究
2021-11-19王灵向文洲卫华宁吕金亭吴华莲吴后波
王灵 向文洲 卫华宁 吕金亭 吴华莲 吴后波
(1. 中国科学院南海海洋研究所 中国科学院热带海洋生物资源与生态重点实验室 广东省海洋药物重点实验室,广州 510301;2. 中国科学院大学,北京 100049;3. 南方海洋科学与工程广东省实验室(广州),广州 511458;4. 中国科学院南海生态环境工程创新研究院,广州 510301)
随着社会经济的快速发展,工业化和城市化的迅速推进,海洋水体的污染和富营养化日趋严重,其中最显著的就是赤潮爆发的频率和规模也逐渐呈现增长趋势[1]。赤潮发生后,严重危害海水养殖业和渔业资源,导致海洋环境恶化从而严重破坏海洋生态系统[2]。棕囊藻(Phaeocystis)是一种广温广盐性的定鞭金藻,广泛分布在我国沿海海域,是我国南海海域频繁爆发赤潮的藻种之一[3]。近年来,我国沿海地区棕囊藻引发的赤潮频繁爆发,棕囊藻藻体含有的胶质和糖的囊体会紧紧贴在鱼鳃上,引起鱼类窒息死亡,同时分泌溶血毒素破坏水体环境,影响近海鱼虾养殖,造成重大经济损失[4]。因此,解决棕囊藻赤潮危机也成为了当前海洋环境研究的重点问题。
目前,治理赤潮普遍采用传统的物理和化学方法,如机械除藻、使用化学除藻药剂等方法。然而这些传统方法却存在诸多因素的限制,如成本、安全性等,且治理效率低易造成二次污染[5-7]。随着对赤潮防治研究的深入,人们渐渐发现海洋细菌对藻类的生长发育起着潜在的调控作用。在利用传统的物理和化学方法防治效果收效甚微的情况下,人们开始把研究重点转移到海洋细菌上,通过细菌溶藻来抑制藻体生物量,从而抑制有害藻华的爆发[8-9]。如今,溶藻细菌作为赤潮防治的新方法,开始引起国内外研究人员的广泛关注。目前关于溶藻细菌如何裂解藻细胞进行溶藻的机理以及溶藻细菌中具有溶藻作用的活性物质的分离鉴定都仍处于研究阶段[10]。因此,研究溶藻细菌对球形棕囊藻的作用机制对当前生物防治赤潮爆发具有重要意义。
本课题组之前从位于海南省三亚市天涯镇的能源绿藻Picochlorum sp. SCSIO-45015开放池中,分离出一株入侵生物蓝细菌Cyanobacterium sp SCSIO-45682[11]。经实验室前期研究发现在该蓝细菌培养物对微藻的侵染过程中,起主导作用的不是蓝细菌自身,而是附生于该蓝细菌的多株细菌。实验室前期已探究了一株对盐生杜氏藻有强烈溶藻作用的细菌CBA02[11]。本研究将对另一株同样具有溶藻效应的细菌CBA01的溶藻特性及其作用机制展开研究。经实验室前期研究,初步鉴定其为微杆菌属Microbacterium sp. CBA01,且在对该株菌溶藻范围的广谱性测定中发现该菌对球形棕囊藻Phaeocystis globosa SCSIO-45315具有强烈的溶藻效应。因此,本研究以球形棕囊藻为研究对象,对细菌CBA01的溶藻特性和溶藻机制进行初步探究,确定其溶藻方式及溶藻活性特性,并测定了该菌株在溶藻过程中藻细胞生理活性变化,初步揭示其作用机制,为生物防治赤潮奠定理论基础。此外,该株溶藻菌发现于微藻户外养殖池中,对其溶藻机制的挖掘,也有效推动了防治微藻大规模养殖中溶藻菌入侵污染的技术研究。
1 材料与方法
1.1 材料
菌株CBA01为实验室分离得到的蓝细菌Cyanobacterium sp. SCSIO-45682的共附生细菌,属微杆菌(Microbacterium sp.)。该蓝细菌于2013年由本实验室从海南省三亚市天涯镇的被污染微藻开放养殖池中分离获得。实验藻种球形棕囊藻Phaeocystis globosa SCSIO-45315藻种由中国科学院南海海洋研究所经济微藻种质库提供。
1.2 方法
1.2.1 藻株的培养方法 菌株CBA01培养采用2216E培养基[12-13],于 28℃,200 r/min 条件下培养。实验所用藻种均采用 F/2 培养基[14],于温度25±1℃、光照强度 4 000 lx、光暗比12 h∶12 h条件下培养。
1.2.2 菌株CBA01生长曲线的测定 挑取固体培养基上的菌株CBA01单菌落接种至2216E液体培养基中,设置3组平行,28℃、200 r/min 振荡培养。每12 h取样测定OD600,用测定的数据构建细菌的生长曲线,分析各生长阶段。
1.2.3 叶绿素a含量和溶藻率的测定 采用丙酮法测定叶绿素a的含量[15]。溶藻率计算公式:

其中,CC表示对照组叶绿素浓度,CT表示实验处理组叶绿素浓度。
1.2.4 菌株CBA01的溶藻效应研究
1.2.4.1 不同发酵时间的菌液对溶藻活性的影响 分别取5 mL培养了24 h、48 h、72 h、120 h、192 h、240 h的CBA01菌液加入到100 mL处于对数生长期的球形棕囊藻藻液中,以在藻液中加入等量 2216E 培养基作为空白对照组,每组设2个平行,于温度(25±1)℃、光照强度 4 000 lx、光暗比12 h∶12 h条件下培养。藻菌共培养,每隔2 d定时取样,测定藻液中叶绿素a的含量并计算溶藻率。
1.2.4.2 不同添加量的菌液对溶藻活性的影响 细菌CBA01于2216E液体培养基中培养72 h,分别取2 mL、3 mL、5 mL的菌液量加入到100 mL对数生长期的球形棕囊藻藻液中,空白对照组处理和培养条件同上。藻菌共培养,定时取样并计算溶藻率。
1.2.4.3 藻液不同初始浓度对溶藻活性的影响 细菌CBA01于2216E液体培养基中培养72 h,分别将球形棕囊藻液的OD680调至0.1、0.2、0.3、0.4、0.5,各组取100 mL藻液加入5 mL的菌液,空白对照组处理和培养条件同上。藻菌共培养,定时取样并计算溶藻率。
1.2.4.4 细菌CBA01的溶藻作用方式 细菌CBA01于2216E液体培养基中培养72 h,取菌液10 000 r/min离心10 min,分别收集上清液和细菌菌体。菌体用无菌水洗涤3次后重悬,上清液过0.22 μm 滤膜后4℃冰箱保存待用。分别吸取5 mL原细菌培养液、上清液和菌体重悬液,分别加入到100 mL藻液中,空白对照组处理和培养条件同上。藻菌共培养,定时取样并计算溶藻率。
1.2.4.5 温度对细菌CBA01无菌上清液溶藻活性的影响 制备细菌CBA01无菌上清液,分别在30℃、70℃和 100℃水浴以及 121℃高压蒸汽灭菌锅中处理30 min,自然冷却至室温,并各取5 mL无菌上清液加入到100 mL藻液中,空白对照组处理和培养条件同上。藻菌共培养,定时取样并计算溶藻率。
1.2.4.6 pH对细菌CBA01无菌上清液溶藻活性的影响 收集细菌CBA01无菌上清液,分别调节其pH至2.0、4.0、6.0、8.0 和 10.0,过夜处理后将其调回初始pH值。并各取5 mL无菌上清液加入到100 mL藻液中,空白对照组处理和培养条件同上。藻菌共培养,定时取样并计算溶藻率。
1.2.5 细菌CBA01无菌上清液对球形棕囊藻细胞生理活性的影响
1.2.5.1 粗酶液制备 取对数期的球形棕囊藻藻液,加入5 mL的CBA01无菌上清液进行培养,以加入等量 2216E培养基作为空白对照组。分别收集处理0 h、24 h、48 h 的藻液,6 000 r/min、4℃离心10 min,收集藻细胞。将收集的藻细胞重悬于相应匀浆介质中,4℃ 超声波破碎后细胞匀浆以 6 000 r/min、4℃离心10 min,上清液即为粗酶液[16]。
1.2.5.2 酶活性的测定 细胞抗氧化系统相关的丙二醛(malondialdehyde,MDA)含量、超氧化物歧化酶(superoxide dismutase,SOD)、过氧化物酶(peroxidase,POD)活性均采用相应试剂盒(南京建成生物工程公司、北京百奥莱博科技有限公司)进行测定。
1.2.6 数据处理 本试验数据统计使用Oringin软件,用One-way ANOVA分析进行单因素方差分析,所有数据用平均值±标准误差表示,P<0.05 表示差异性显著。
2 结果
2.1 菌株CBA01的生长曲线
每隔12 h取样,测定菌株Microbacterium sp.CBA01的OD600,绘制生长曲线如图1所示。从图1中可以看出,CBA01生长延滞期为0-12 h,对数生长期为12-72 h,72 h后进入稳定期,168 h后进入衰退期。由此可选取细菌浓度较高的稳定期进行后续溶藻相关试验。

图1 细菌CAB01的生长曲线Fig. 1 Growth curve of symbiotic bacteria CAB01
2.2 细菌CBA01的溶藻效果
菌液的发酵时间、添加量以及藻液初始浓度都是细菌溶藻作用强度的影响因素。其中细菌CBA01的溶藻作用与发酵时间成正相关(图2-A),发酵时间为24 h和48 h时溶藻率较低,第6天溶藻率为10.23%±0.99%和37%±0.89%,从72 h后,各组中溶藻率变化趋势类似,到第6天溶藻率分别为68.48%±0.92%、73.78%±7.55%、74.50%±8.79%和64.58%±1.53%,因此以72 h作为菌液的发酵时间。细菌CBA01的溶藻能力随菌液添加量增加而增加(图2-B)。当菌液添加量为2 mL和3 mL时,溶藻率虽在上升但变化幅度不明显,培养第6天溶藻率仅为14.08%±8.46%和49.63%±1.85%,而添加量为5 mL时,第6天溶藻率达到最大,为88.17%±0.94%,以此作为菌液最适添加量。藻液初始浓度越高,菌株CBA01溶藻效果越不明显(图2-C),藻菌培养第6天时,藻液初始OD680为0.1和0.2时,溶藻效果最好,为80.24%±5.43%和59%±0.34%;而藻液初始OD680为0.3、0.4和0.5时,第6天时溶藻率并不明显,分别为23.05%±9.26%、29.53%±2.08%和20.40%±4.59%。

图2 菌液不同发酵时间(A)、菌液不同添加量(B)及藻液不同初始浓度(C)对溶藻活性的影响Fig. 2 The effect of different fermentation time (A) and addition amount of bacterial solution (B) and different initial concentration of P. globosa (C) on algicidal activity
2.3 细菌CBA01的溶藻作用方式
为探究溶藻菌对球形棕囊藻的溶藻作用方式,分别对溶藻菌发酵液经离心、过滤收集菌体和无菌上清液的溶藻效果进行测定,结果如图3所示。实验结果表明,藻菌共培养过程中,细菌发酵液组与无菌上清液组的溶藻率几乎同步增长,至培养第6天时,两组溶藻率分别达到96.06%和95.39%,均显著性高于细菌菌体组的溶藻率(P<0.05)。
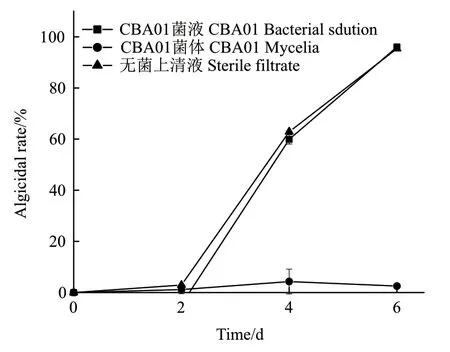
图3 菌液不同处理对溶藻活性的影响Fig. 3 The effect of different addition treatment of bacterial solution on algicidal activity
2.4 细菌CBA01无菌上清液溶藻物质的特性
溶藻细菌CBA01的无菌上清液经过不同温度处理后,如图4-A所示。对棕囊藻仍表现出较高的溶藻效应,但溶藻活性整体较之前的处理组出现略微下降,尤其是121℃处理组,溶藻率为42.95%±3.88%,其余组别溶藻率变化不大,分别为 51.32%±0.54%、53.22%±3%、53.75%±2.97%。上清液经过不同pH处理后,溶藻效果如图4-B所示。当pH偏酸性时,各组溶藻率随pH的增加而增加,且随藻菌共培养时间而上升,上清滤液pH为 2.0、4.0、6.0时,培养至第6天时溶藻率分别为56.38%±3.96%、64.62%±8.26%、63.64%±0.34%;当pH偏碱性时,CBA01溶藻物质表现出对强碱较敏感,溶藻率显著降低,上清滤液pH为8.0和10.0时,到第6天溶藻率分别为 53.95%±9.24%和18.13%±4.17%。

图4 不同温度(A)和酸碱(B)条件处理后的CBA01无菌上清液对球形棕囊藻的溶藻效果Fig. 4 Algicidal efficiency of CBA01 sterile filtrate treated with different temperature (A) and pH (B)conditions on P. globosa
2.5 细菌CBA01无菌上清液对球形棕囊藻细胞生理活性的影响
MDA作为细胞膜脂过氧化判断的重要指标,反映了机体细胞膜氧化损伤的程度。加入CBA01无菌上清液处理后,细胞内MDA含量明显上升,上清液处理48 h时实验组的MDA含量显著高于对照组(P<0.01)(图5-A)。SOD能够清除细胞内超氧阴离子自由基,防止其在细胞内积累,从而对细胞产生危害。添加上清液处理后,藻细胞内 SOD 活性先上升后下降,而对照组的藻液 SOD 活性基本保持不变,培养24 h时,加入无菌上清液的藻液中SOD 的活性是对照组的1.8倍(P<0.01),48 h时,实验组SOD活性有所下降,但仍是对照组的1.5倍(P<0.01)(图5-B)。POD能催化体内过氧化氢反应,有效降解细胞内H2O2,从而防止H2O2在有机体内积累,导致有机体伤害。加入上清液处理后,POD活性呈逐渐升高的趋势,实验组均显著高于对照组,且处理24 h和24 h 后活性分别升高至对照组的13.89倍和32.71倍(P<0.01)(图 5-C)。
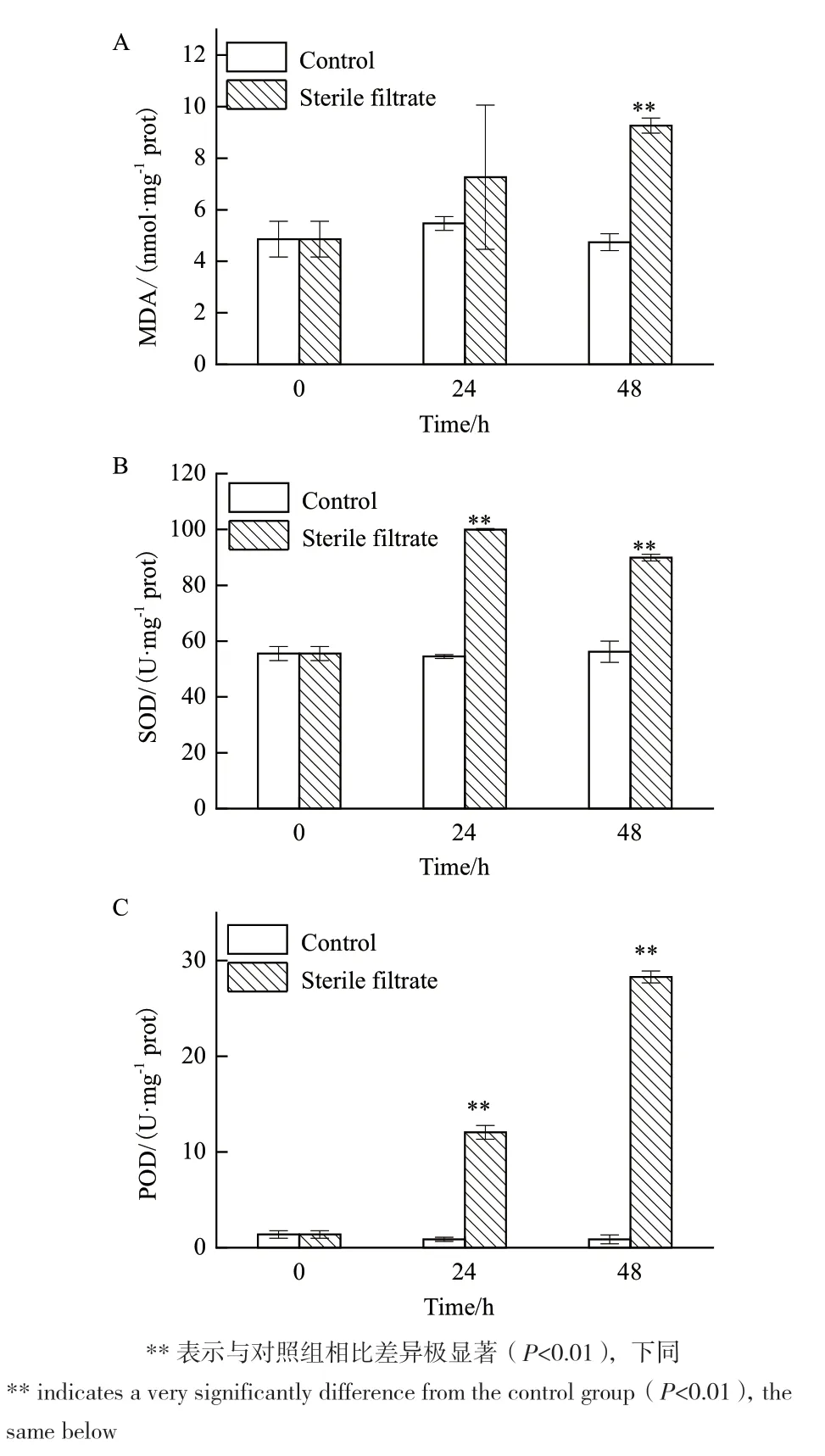
图5 无菌上清液对球形棕囊藻细胞抗氧化系统相关酶活性的影响Fig. 5 Effect of sterile supernatant on the activity of antioxidant enzymes of P. globosa cells
2.6 叶绿素a含量的测定
CBA01无菌上清液对球形棕囊藻叶绿素a含量的影响见图6。随共培养时间的增加,经上清液处理的藻液叶绿素a含量逐渐降低,至培养第6天时,叶绿素a含量降到最低为(0.14±0.01)μg/mL,较对照组下降95%(P<0.01)。结果表明,溶藻物质会破坏藻细胞的光合作用活性,影响光合作用效果,最终导致藻细胞缺少能量供给而死亡。

图6 无菌上清液对球形棕囊藻细胞叶绿素a含量的影响Fig 6 Effect of sterile supernatant on chlorophyll a activity of P. globosa cells
3 讨论
3.1 溶藻细菌与赤潮的生物防治
有害藻华目前已成为全球性的海洋生态问题,对海洋环境、渔业养殖以及人类健康等都造成了严重威胁。近年来许多研究表明,将这类可抑制藻细胞生长,溶裂或杀死藻细胞的细菌称为溶藻细菌,将这种特性称为溶藻特性,但在部分文献中,也有用杀藻活性来表示[17-18]。由于这类细菌易培养,能高效裂解藻细胞,安全性高等特性,深入研究溶藻细菌对藻类的溶藻特性以及作用机理有助于开发经济高效、环境友好型生物除藻剂,现已成为当今生物防治赤潮的研究热点。
球形棕囊藻作为有害藻华的代表藻种之一,国内外目前有关细菌对球形棕囊藻的溶藻作用研究相对较少,已有报道溶藻细菌多为链霉菌属(Streptomyces)、 芽 孢 杆 菌 属(Bacillus) 等[19-21]。Zhang等[22]分离出一株链霉菌属RPS(Streptomyces alboflavus RPS)通过分泌胞外活性物质能抑制球形棕囊藻鞭毛活性,致使其鞭毛脱落而裂解死亡。Tan等[18]发现芽孢杆菌Ts-12(Bacillus sp. Ts-12)可分泌一种环肽对球形棕囊藻表现出显著的杀藻活性。陈丽娜报道了一株芽孢杆菌B1分泌的L-组氨酸对球形棕囊藻有明显的溶藻效果[23]。本研究首次报道了从蓝细菌中分离出的一株对球形棕囊藻具有很强的溶藻能力的菌株CBA01,该菌属于放线菌类群(Actinobacteria)中的微杆菌属(Microbacterium sp.),这进一步丰富了球形棕囊藻的溶藻细菌资源库,有助于开发综合性多样化的新型生物除藻剂,这对赤潮生物防治有重要的意义和应用前景。
3.2 菌株CBA01的溶藻特性及溶藻机制
已有研究表明,溶藻细菌的溶藻特性受光照、温度、pH、培养时间、菌和藻的生长状态等多种因素的影响[24]。本研究首先对菌株CBA01菌液的溶藻特性进行了初步分析,摸索CBA01菌液达到最佳溶藻活性的测试条件,为进一步揭示溶藻作用机理奠定基础。结果发现在一定范围内,细菌的溶藻作用效应与菌液发酵时间、菌液添加量成正相关关系,随着菌液发酵时间的增长和菌液浓度提高,溶藻效应随之提高;而细菌的溶藻效应与藻细胞初始浓度成负相关,藻细胞初始浓度越高,溶藻效应越差。
在最适溶藻效应条件下,本文进一步对溶藻活性的成分进行了确定。相关研究报道,溶藻细菌主要通过直接溶藻和间接溶藻两种方式进行溶藻作用,两者区别在于,前者是细菌直接接触藻细胞表明或侵入细胞内导致藻细胞死亡,后者是细菌分泌胞外活性物质抑制或溶解藻细胞[25-26]。Imai等[27]1993年发现的一株噬胞纤维菌Cytophaga sp.能直接与藻细胞表面接触将蓝藻杀死。Zhao等[9]从一株Bacillus sp. B1 中分离得到多种能够杀死球形棕囊藻的活性物质。与前人结果相似,本研究结果表明,上清液溶藻率与对照组细菌发酵液结果相似,远高于菌体组溶藻率,且在显微镜观察下,菌体处理组藻细胞生长状态正常,并无明显溶藻现象,因此初步判断菌株CBA01通过分泌具有胞外活性物质间接溶藻,而菌体本身并无溶藻作用。同时,对CBA01的无菌上清液进行不同温度、pH处理,结果表明,CBA01分泌的胞外溶藻物质在高温处理下仍具有较高的溶藻活性,说明溶藻活性物质具有一定耐高温性,高温下不易变形失活,因此初步推测该物质不是易受高温影响的蛋白质或核酸等生物分子。同时,根据结果分析,pH对CBA01的溶藻活性也有显著影响,尤其强碱条件下,溶藻效应显著降低,而酸性条件下,溶藻物质的活性相对稳定,并随pH的增加而增加,这表明酸碱强度会影响溶藻物质的结构及溶藻活性强度。对细菌CBA01溶藻特性的探索分析,有助于进一步确定溶藻物质的种类和化学结构,为探索细菌CBA01的作用机制奠定基础。
3.3 溶藻物质对藻细胞生理活性的影响
外界环境刺激会引起机体发生氧化胁迫,细胞内通过自身产生的抗氧化系统(包括酶类抗氧化剂和非酶类抗氧化物质)清除体内过量的活性氧(ROS)来维持细胞内平衡状态,以保护机体免受外界环境的损害。通过对细菌CBA01溶藻过程的观察发现,CBA01溶藻物质会破坏棕囊藻细胞内部,致使细胞膨胀破碎,胞内物质外流,进而细胞死亡。因此,本研究探究了溶藻作用初期藻细胞生理活性的变化,以进一步揭示菌CBA01的溶藻作用机制。
机体通过非酶系统产生ROS,会攻击生物膜中的多不饱和脂肪酸,导致脂质过氧化作用。因此作为膜脂过氧化终产物的丙二醛常作为反映机体非酶类抗氧化能力的指标[28]。在本研究结果中,作为细胞膜完整性判断指标的MDA含量上升,说明溶藻物质作用下,藻细胞细胞膜的脂质过氧化反应加剧,破坏细胞膜的完整性,进而导致藻细胞死亡。SOD作为第一个参与清除活性氧的保护酶,能清除细胞内超氧阴离子自由基[29]。POD能催化体内过氧化氢反应,防止过氧化氢过多累积。本研究中两种抗氧化酶,在溶藻作用下,酶活性整体呈上升趋势,表明溶藻物质损伤了球形棕囊藻细胞,刺激藻细胞内产生了过量的有害自由基,机体自身的防御机制开启,清除体内的有害自由基,因而SOD和POD活性上升。而后SOD活性变化趋势逐渐减弱,说明随着有害自由基的不断积累,超出藻细胞自身修复力,酶活力下降,藻细胞受损程度逐渐加剧甚至死亡,达到溶藻目的。
这一结果也与已有研究结果相似。韩贝贝等[17]研究发现溶藻作用下中肋骨条藻细胞与抗氧化系统相关的MDA含量、SOD、POD的活性显著上升。牛丹丹等[30]发现溶藻细菌YZ无菌滤液主要是通过降低保护酶活性、加大膜脂过氧化发挥对铜绿微囊藻的溶解作用。综合上述研究结果,推测溶藻细菌CBA01入侵球形棕囊藻细胞,一方面可能通过刺激藻细胞内短时间产生过量的有害自由基导致细胞内抗氧化系统失衡,从而影响藻细胞膜系统的完整性,改变膜通透性,大量溶藻活性物质进入藻细胞内,最终细胞破裂死亡;另一方面也可能是CBA01溶藻物质本身具有较强的氧化性,产生大量有害自由基,破坏细胞膜系统后进入藻细胞后破坏细胞结构致使细胞死亡。初步确定了CBA01对藻细胞生理活性的影响,但对其溶藻机理的深入研究仍需继续,可在之后通过检测溶藻物质是否具有强氧化性来进一步揭示溶藻作用的过程及作用部位。
3.4 溶藻物质对藻细胞光合系统的影响
叶绿素a 能影响光能的吸收与能量转换,是反映光合作用能力的重要指标[31]。本研究中,溶藻细菌CBA01作用下,棕囊藻细胞叶绿素a含量显著下降,表明溶藻物质会损伤藻细胞的光合系统,抑制机体有机物供给和能量运输,影响藻细胞正常生长甚至引起藻细胞死亡。与本文研究结果相似,Hu等[32]研究发现芽孢杆菌 Y4 胞外活性物质会加速球形棕囊藻细胞光合色素分解,叶绿素a 含量显著下降,影响光合系统Ⅱ光能转化效率,从而对藻细胞损伤甚至死亡。
4 结论
本研究发现菌株Microbacterium sp. CBA01通过胞外分泌溶藻物质经间接溶藻作用而导致球形棕囊藻的裂解,其分泌的溶藻活性物质能耐高温、适合酸性或中性环境,且溶藻活性受菌液发酵时间、添加量和藻液初始浓度等因素影响;菌株CBA01分泌的溶藻活性物质在溶藻过程中,刺激藻细胞内产生过量的有害自由基,引起藻细胞应激反应,细胞内抗氧化系统失衡,细胞膜系统氧化损伤改变其通透性,大量胞外物质侵入细胞内导致藻体死亡;同时导致细胞内叶绿素a合成受阻,从而抑制细胞正常生长代谢过程,最终细胞停止分裂,由此形成溶藻效应。