激活转录因子 3对巨噬细胞M2型极化的影响及其机制
2021-11-19陈昭琳
程 希,陈昭琳,黄 成,李 俊
(1.中国科学技术大学附属第一医院药剂科,安徽 合肥 230002;2.安徽医科大学药学院,安徽 合肥 230032)
巨噬细胞是天然免疫系统的重要组成细胞,同时也是维持自身代谢稳定的关键因素。巨噬细胞还具有在不同病理条件下分化异常的特点,称之为巨噬细胞极化[1]。巨噬细胞在不同细胞因子的刺激下可极化为M1型和M2型 2 种不同的功能状态。巨噬细胞可在脂多糖(lipopolysaccharide,LPS)诱导激活下转化为M1 型,同时可分泌肿瘤坏死因子-α(tumor necrosis factor-α,TNF-α)、白细胞介素(interleukin,IL)-1、IL-6、一氧化氮合酶(nitric oxide synthase,iNOS)等促炎因子和趋化因子;M1型巨噬细胞通过分泌各类细胞因子来激活免疫应答,发挥抗原提呈细胞的作用,从而杀灭病原微生物,破坏肿瘤细胞等。M2 型巨噬细胞可由IL-4诱导活化,M2 型巨噬细胞可分泌精氨酸酶-1(arginase-1,Arg-1)和IL-10,主要与寄生虫感染、组织重塑和肿瘤进展有关[2-3]。巨噬细胞的极化过程依赖于许多关键转录因子的调控,在不同疾病中,相关转录因子可直接或间接作用于目标基因的调控区域,调节促炎或抗炎细胞因子的表达,促进巨噬细胞功能表型极化。
激活转录因子3(activating transcription factor 3,ATF3)是ATF/环磷酸腺苷的反应元件结合蛋白(ATF/cAMP-response element binding protein,ATF/CREB)家族的转录因子成员,通过其碱性亮氨酸拉链结构域与ATF/CREB 顺式作用元件结合调控基因表达。有研究表明,ATF3是一种应激反应基因,可被一系列细胞应激信号诱导,通过抑制ATF3的表达和活性,改善非酒精性脂肪性肝炎病理过程中的胰岛素抵抗、肝脂肪变性、炎症和纤维化[4]。BAE等[5]研究发现,ATF3可能参与小檗碱的抗炎作用,小檗碱对ATF3 mRNA和蛋白表达的抑制作用呈浓度依赖性,同时其可以抑制LPS介导的炎症相关因子TNF-α、IL-6和IL-1β的表达,当ATF3被敲除后,这种抑制作用也随之消失。另有研究发现,从丹参中分离出的ST32da可诱导ATF3表达,下调脂肪因子基因表达水平,从而通过诱导脂肪细胞褐变来治疗肥胖和相关代谢疾病[6]。信号传导及转录激活蛋白(signal transducer and activators of transcription,STATs)是一组广泛表达于哺乳动物不同类型细胞和组织中的、能够与目的基因调控区 DNA 结合的转录因子。活化的 STATs参与巨噬细胞极化,不同的细胞因子如干扰素-γ(interferon-γ,IFN-γ)、IL-4等活化STATs信号通路可产生不同的生物学应答。GLAL等[7]研究指出,ATF3可通过靶向调控上皮细胞中IL-22-pSTAT3信号和Th17细胞中的IL-6-pSTAT3信号来维持黏膜的稳态和免疫功能。目前,尚无关于ATF3是否可以通过STAT3来影响巨噬细胞极化方面的报道。基于此,本研究探讨ATF3是否可通过STAT3信号通路来调节巨噬细胞极化。
1 材料与方法
1.1 细胞株、主要试剂与仪器小鼠来源的巨噬细胞株RAW264.7购自中国科学技术大学生命科学院;高糖达尔伯克改良伊格尔培养基(Dulbecco′s modified Eagle′s medium,DMEM)购自江苏凯基生物技术股份有限公司,胎牛血清购自杭州四季青生物工程材料有限公司,IFN-γ、IL-4 购自英国Peprotech公司,ATF3小干扰RNA(small interfering RNA,siRNA)购自上海吉玛技术有限公司,TRIzol Reagent RNA 提取试剂、LipofectamineTM2000 购自美国Invitrogen公司,ATF3、Arg-1抗体及反转录试剂盒购自美国Santa Cruz Biotechnology公司,STAT3、磷酸化STAT3(phospho-STAT3,p-STAT3)抗体购自常州安博生物技术有限公司,β-actin抗体、二抗购自北京中山金桥生物技术公司,2 000 bp DNA marker、DNA上样缓冲液购自日本TaKaRa公司;Pikoreal 定量聚合酶链反应仪购自北京九宇金泰生物技术有限公司,CO2培养箱NAPCO-6100购自美国杜邦公司,电泳仪、湿转膜仪等Western blot实验设备购自美国伯乐公司。
1.2 实验方法
1.2.1 细胞培养和分组将RAW264.7细胞接种于DMEM(含体积分数10 %胎牛血清及100 kU·L-1青霉素和100 mg·L-1链霉素),于37 ℃ 含体积分数5% CO2的细胞培养箱中培养。待细胞融合达50 %~60%时,吹打下来传代,按所需浓度接种至培养瓶、培养板。诱导分组:取对数生长期RAW264.7细胞,均匀接种至6孔板中,将细胞分为对照组、M1组、M2组;对照组细胞未做任何处理,M1组细胞用IFN-γ(10 μg·L-1)和LPS(10 μg·L-1)诱导6 h,M2组细胞用IL-4(15 μg·L-1)诱导48 h。收集各组细胞,置于-80°冰箱保存备用。转染分组:将对数生长期RAW264.7细胞分为对照组、空白转染组、M2对照组、M2 ATF3转染组;对照组细胞未做任何处理,空白转染组细胞转染空白siRNA,M2对照组细胞用IL-4(15 μg·L-1)诱导48 h,M2 ATF3转染组细胞用IL-4(15 μg·L-1)诱导48 h,然后转染ATF3 siRNA序列。
1.2.2 ATF3 siRNA转染RAW264.7细胞委托上海吉玛公司设计合成ATF3 siRNA,序列如下:ATF3 siRNA上游引物序列为5′-CACCCUUUGUCAAGGAAGATT-3′,下游引物序列为5′-UCUUCCUUGACAAAGGGUGTT-3′;空白siRNA上游引物序列为5′-UUCUCCGAACGUGUCACGUTT-3′,下游引物5′-ACGUGACACGUUCGGAGAATT-3′。按照LipofectamineTM2000说明书用ATF3 siRNA 转染RAW264.7细胞,采用通用型荧光标记的阴性对照siRNA进行转染条件的优化。取对数生长期RAW264.7细胞,吹打均匀后,等体积接种于24孔板,用含体积分数10%胎牛血清、不含抗生素的DMEM培养24 h,细胞贴壁后弃去旧培养液待转染。siRNA与LipofectamineTM2000分别用适量不含血清和抗生素的DMEM稀释,5 min内将其混合,室温静置20 min后加入24孔板中,然后置于培养箱常规培养6 h后荧光显微镜下观察转染情况。
1.2.3 定量反转录聚合酶链反应法检测诱导分组RAW264.7细胞中ATF3 mRNA及转染后各组RAW264.7细胞中ATF3、TGF-β、IL-10 mRNA的表达按TRIzol试剂说明书提取经处理后的RAW264.7细胞的总RNA,再立即用ND2000测定总RNA浓度。取1 μg RNA反转录得到cDNA后进行扩增,扩增反应体系20 μL,包括cDNA 2 μL、上下游引物各0.4 μL、sybrgreen 10 μL、Rox 0.4 μL、无酶水6.8 μL。引物序列由上海吉玛公司设计合成。Arg-1上游引物序列为5′-TGACATCAACACTCCCCTGACAAC-3′,下游引物序列为5′-GCCTTTTCTTCCTTCCCAGCAG-3′;TGF-β上游引物序列为5′-CTCCACCTGCAAGAC-3′,下游引物序列为5′-CTGGCGAGCCTTAGTTTGGA-3;IL-10上游引物序列为5′-GCTGCCTGCTCTTACTGACT-3′,下游引物序列为5′-CTGGGAAGTGGGTGCAGTTA-3′;β-actin上游引物序列为5′-TCAGGTCATCACTATCGGCAAT-3′,下游引物序列为5′-AAAGAAAGGGTGTAAAACGCA-3′。以内参β-actin的循环数作为对照,根据2-ΔΔCt计算ATF3、TGF-β、IL-10 mRNA相对表达量。实验重复3次,取均值。
1.2.4 Western blot 法检测诱导分组RAW264.7细胞中ATF3、STAT3、p-STAT3蛋白及转染后各组RAW264.7细胞中ATF3、Arg-1、STAT3、p-STAT3蛋白的表达取各组RAW264.7细胞用预冷的RIPA裂解缓冲液加苯甲基磺酰氟在冰上裂解60 min,每10 min振荡1次,收集细胞裂解物,于4 ℃下13 000 r·min-1离心30 min,吸取上清液,蛋白定量试剂盒测定蛋白浓度。蛋白上样量为30 μg,体积分数10%聚丙烯酰胺凝胶电泳2 h,再转移至聚偏氟乙烯膜上,非特异性封闭1 h,加入一抗,4 ℃过夜。次日用含辣根过氧化物酶标记的二抗孵育1 h,缓冲液洗膜4次,每次10 min,最后用化学发光法进行显影。以 β-actin为内参,以目的蛋白灰度值与β-actin灰度值比值表示目的蛋白的相对表达量。

2 结果
2.1 对照组、M1组、M2组RAW264.7细胞中ATF3 mRNA及ATF3、STAT3和p-STAT3蛋白的相对表达量比较结果见表1和图1、图2。M2组细胞中ATF3 mRNA及ATF3、p-STAT3蛋白相对表达量均显著高于对照组,差异有统计学意义(P<0.05);M1组与对照组细胞中ATF3 mRNA及ATF3、p-STAT3蛋白相对表达量比较差异无统计学意义(P>0.05);M1组、M2组细胞中STAT3蛋白相对表达量与对照组比较差异无统计学意义(P>0.05)。

表1 对照组、M1组、M2组RAW264.7细胞中ATF3 mRNA及ATF3、STAT3和p-STAT3蛋白相对表达量比较

1:对照组;2:M1组;3:M2组。
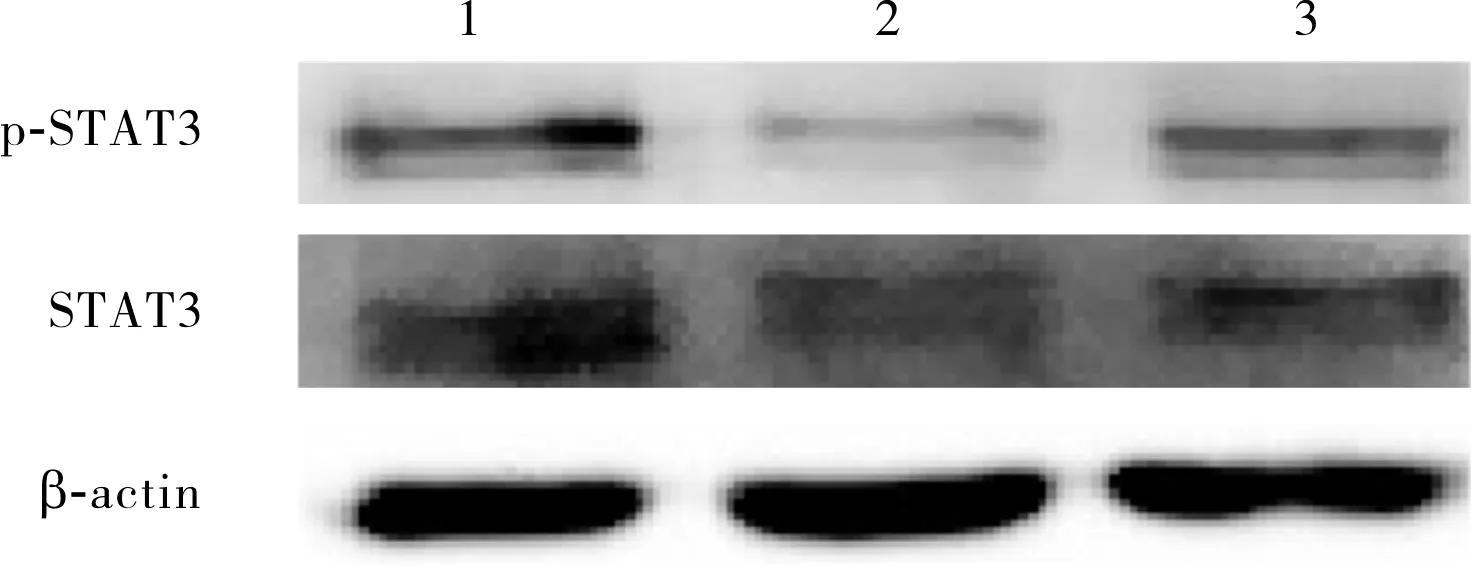
1:对照组;2:M1组;3:M2组。
2.2 对照组、空白转染组、M2对照组、M2 ATF3转染组RAW264.7细胞中ATF3 mRNA及蛋白相对表达量比较结果见表2和图3。M2对照组RAW264.7细胞中ATF3 mRNA及蛋白相对表达量均显著高于对照组和空白转染组,差异有统计学意义(P<0.05);M2 ATF3 转染组RAW264.7细胞中ATF3 mRNA及蛋白相对表达量均显著低于M2对照组,差异有统计学意义(P<0.05);其余各组RAW264.7细胞中ATF3 mRNA及蛋白相对表达量比较差异均无统计学意义(P>0.05)。

表2 对照组、空白转染组、M2对照组、M2 ATF3 转染组RAW264.7细胞中ATF3 mRNA及蛋白相对表达量比较

1:对照组;2:空白转染组;3:M2对照组;4:M2 ATF3 转染组。
2.3 对照组、空白转染组、M2对照组、M2 ATF3 转染组RAW264.7细胞中Arg-1、STAT3和p-STAT3蛋白相对表达量比较结果见表3和图4、图5。M2对照组RAW264.7细胞中Arg-1、p-STAT3蛋白相对表达量均显著高于对照组,差异有统计学意义(P<0.05);M2 ATF3 转染组RAW264.7细胞中Arg-1、p-STAT3蛋白相对表达量均显著低于M2对照组,差异有统计学意义(P<0.05)。其余各组RAW264.7细胞中Arg-1、STAT3及p-STAT3蛋白相对表达量比较差异均无统计学意义(P>0.05)。

表3 对照组、空白转染组、M2对照组、M2 ATF3 转染组RAW264.7细胞中Arg-1、STAT3、p-STAT3蛋白相对表达量比较

1:对照组;2:空白转染组;3:M2对照组;4:M2 ATF3 转染组。

1:对照组;2:空白转染组;3:M2对照组;4:M2 ATF3转染组。
2.4 对照组、空白转染组、M2对照组、M2 ATF3 转染组RAW264.7细胞中IL-10、TGF-β mRNA相对表达量比较结果见表4。M2对照组RAW264.7细胞中IL-10、TGF-β mRNA相对表达量均显著高于对照组,差异有统计学意义(P<0.05);M2 ATF3 转染组RAW264.7细胞中IL-10、TGF-β mRNA相对表达量均显著低于M2对照组,差异有统计学意义(P<0.05)。其余各组RAW264.7细胞中IL-10、TGF-β mRNA相对表达量比较差异均无统计学意义(P>0.05)。

表4 对照组、空白转染组、M2对照组、M2 ATF3 转染组RAW264.7细胞中 IL-10、TGF-β mRNA相对表达量比较
3 讨论
巨噬细胞是机体免疫细胞的一种,参与机体生长发育、稳态调控及免疫反应等重要过程,尤其在机体炎症调控过程中发挥重要作用。巨噬细胞根据环境变化(例如微生物产物、损坏应答细胞,活化的淋巴细胞等)调整其表型和功能。巨噬细胞被不同因素激活后,分为2种极性分化类型,一种为经典激活 M1 型巨噬细胞,另一种为替代激活M2 型巨噬细胞[8]。巨噬细胞的替代性激活在炎症反应、寄生虫感染、过敏反应、伤口愈合、肿瘤发生与发展及代谢稳态中有重要作用。因此,了解巨噬细胞极化过程的分子机制,有助于通过调控巨噬细胞功能来干预病理过程。
转录因子ATF/CREB家族成员ATF3作为应激反应、免疫反应的早期调节因子,在维持机体调节免疫状态及代谢稳态过程中起到了非常重要的作用。在急性肾损伤中,ATF3可以通过抑制促炎因子IL-6和IL-12表达、Toll样受体激活、细胞凋亡这3种途径发挥对肾脏的保护作用,也可以作为生物标志物,为急性肾损伤诊断、预后评估提供参考[9]。另有研究显示,ATF3可通过参与阻止Ⅱ型肺泡上皮细胞内质网应激的过程来改善肺纤维化[10];提示ATF3在相关疾病的发生、发展中起到了重要作用。本研究通过在RAW264.7细胞上建立M1和M2型巨噬细胞的模型,来研究ATF3在巨噬细胞极化中的作用,结果发现,ATF3在M2型巨噬细胞中高表达,表明其可能参与了巨噬细胞M2型的极化。为进一步了解其在M2型巨噬细胞极化中的调控机制,将ATF3 siRNA转染入细胞中,结果显示,当沉默ATF3后,M2型标志蛋白Arg-1表达水平明显降低,同时M2型标记的细胞因子TGF-β、IL-10表达水平也明显下降,说明ATF3表达水平的降低抑制了巨噬细胞向M2型的极化。在炎症性肠病中,通过ToxoROP16I/III体外诱导巨噬细胞RAW264.7发现,M2型标志蛋白Arg-1、IL-10和TGF-β1表达水平增加,p-STAT3和p-STAT 6表达水平也升高[11];此外,来自膀胱癌细胞的miR-21外泌体抑制了巨噬细胞中磷脂酰肌醇3激酶/蛋白激酶B信号通路的磷酸酶和紧张素同源物的激活,并增强了STAT3的表达,促进了向M2型的极化[12]。本研究中,在M2型巨噬细胞中,STAT3的磷酸化水平明显升高,提示STAT3信号通路参与了巨噬细胞M2型极化过程,与相关文献[13]报道一致;当ATF3被沉默后,细胞中STAT3磷酸化蛋白水平明显降低,提示ATF3可能通过激活STAT3信号通路来调节巨噬细胞向M2型的极化。
巨噬细胞种类丰富,且在整个肿瘤进展过程中起重要作用,肿瘤微环境中的肿瘤相关巨噬细胞(tumor-associated macrophage,TAM)可分化为不同的功能表型。M1型被定义为参与杀伤癌细胞的促炎细胞,M2型可特异性促进肿瘤细胞生长转移、组织重塑和免疫抑制[14]。Wilms′ 肿瘤中TAM密度较高,M2型巨噬细胞密度随肿瘤进展而增加,提示患者预后较差[15]。本研究中,ATF3通过STAT3信号通路影响巨噬细胞向M2型极化,但其是否可作为一个影响TAM的靶点,从而给肿瘤的治疗带来新的契机,尚需要进一步的研究。
